- Получение водорода электролизом воды / Статьи и обзоры / Элек.ру
- Новый способ расщепления воды сделает производство водорода «зеленым»
- Получение водорода в домашних условиях
- Водородный генератор своими руками – схема, конструкция установки, чертежи
- Водород в промышленных масштабах. Новости
- Электричество из лужи, или Как получить энергию из воды — Энергетика и промышленность России — № 19 (327) октябрь 2017 года — WWW.EPRUSSIA.RU
- Расщепление воды с эффективностью 100%: полдела сделано / Хабр
- Центр данных по альтернативным видам топлива: производство и распределение водорода
- Как получить водородный газ (4 метода)
- Новый способ получения водородного топлива из морской воды
- В поисках лучших способов получения водородного топлива из воды
- Производство и доставка водорода | Водород и топливные элементы | Водородные и топливные элементы
- Биологическое расщепление воды
- Ферментация
- Конверсия биомассы и отходов
- Фотоэлектрохимическое расщепление воды
- Гелиотермальное водоразделение
- Возобновляемый электролиз
- Надежность шланга дозатора водорода
- Анализ путей производства и доставки водорода
- Сеть энергетических материалов HydroGEN
- Последние публикации
- Контакт
- Новая технология разделения воды для получения чистого водорода
- Метод получения кислорода из воды в условиях невесомости вселяет надежду на дальние космические путешествия
Получение водорода электролизом воды / Статьи и обзоры / Элек.ру
Получение чистого водорода путем электролиза воды — самая очевидная и эффективная технология, и один из наиболее перспективных способов получения альтернативного топлива. Водород добывают из любого водного раствора, а при сгорании он превращается обратно в воду.
По сравнению с прочими методами получения водорода, электролиз воды отличается целым рядом преимуществ. Во-первых, в ход идет доступное сырье — деминерализованная вода и электроэнергия. Во-вторых, во время производства отсутствуют загрязняющие выбросы. В-третьих, процесс целиком автоматизирован. Наконец, на выходе получается достаточно чистый (99,99%) продукт. Из всех методов электролиза наиболее перспективным считают высокотемпературный электролиз (себестоимость водорода от 2,35 до 4,8 $/кг). Его следует иметь на технологическом вооружении, поскольку при определенных экономических условиях он может быть использован в крупнопромышленном масштабе.
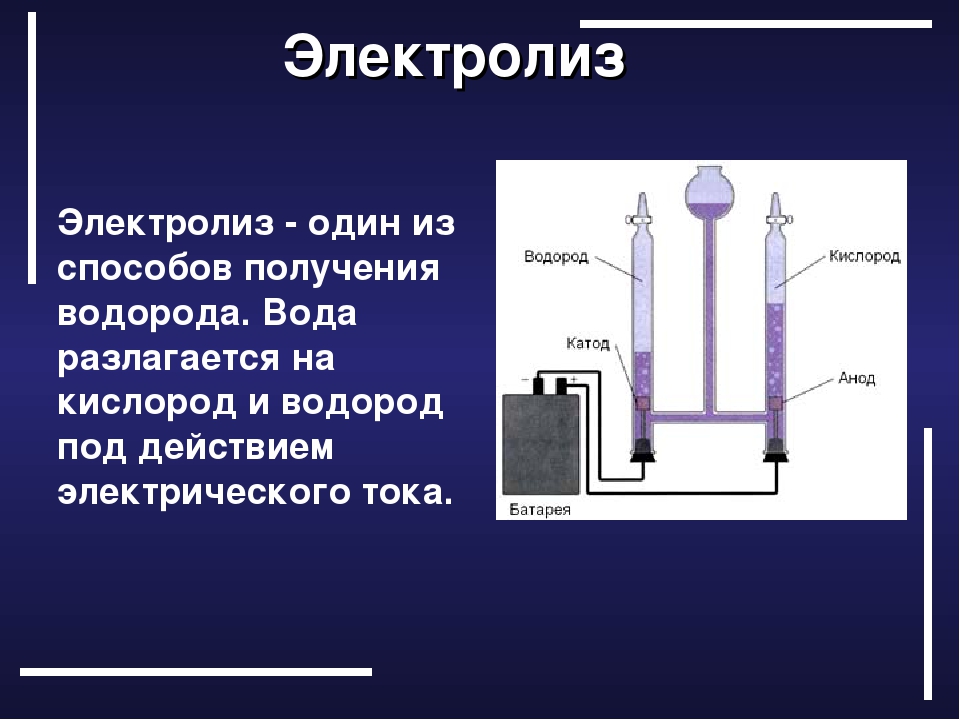
Электролизом воды называется физико-химический процесс, при котором под действием постоянного электрического тока дистиллированная вода разлагается на кислород и водород. В результате разделения на части молекул воды, водорода по объему получается вдвое больше, чем кислорода. Эффективность электролиза такова, что из 500 мл воды получается около кубометра обоих газов с затратами около 4 квт/ч электрической энергии.
Технологический ток для протекания процесса электролиза воды для получения водорода и кислорода получается, как правило, при помощи промышленного выпрямителя с необходимыми рабочими параметрами, Обычно это напряжение до 90В и силой тока до 1500 А. Подходящим агрегатом является Пульсар СМАРТ.
На электронном дисплее выпрямителя Пульсар СМАРТ или в специальном ПО для компьютера можно контролировать все стадии процесса производства, что позволяет оператору следить за параметрами, и круглосуточно журналировать протекание технологического процесса. Полностью автоматическая работа, включающая непрерывный мониторинг всех параметров для безаварийного функционирования без надзора оператора.
Выпрямители тока серии Пульсар СМАРТ разработаны в соответствии с самыми высокими требованиями промышленной эффективности и международными стандартами. При этом технологическое программное обеспечение допускает гибкую адаптацию к требованиям Заказчика, и постоянно совершенствуется.
Новый способ расщепления воды сделает производство водорода «зеленым»
Австралийские ученые разработали более дешевый и эффективный способ получения водорода из воды с использованием железных и никелевых катализаторов, вместо редкоземельных элементов, вроде рутения, платины и иридия, которые по стоимости обходятся в сотни раз дороже.
Развивающаяся концепция «водородной экономики» предполагает, что в скором времени сжатый водород станет таким же распространенным источником энергии, как бензин, а автомобили на топливных элементах будут встречаться не реже, чем электромобили на батареях и машины с двигателями внутреннего сгорания.
Недавно мы писали о первом танкере для транспортировки сжиженного водорода, который был запущен в Японии. Он предназначен для перевозки газа из Австралии, где его получают совсем не «чистым» способом: сжиганием бурого угля, 160 тонн которого дает всего 3 тонны водорода и 100 тонн выбросов С02.
В перспективе десятилетий рынок водорода как источника «чистой энергии» оценивается в триллионы долларов, и особенно это направление набирает обороты в Японии и Корее. Но его большие деньги становятся уже не такими привлекательными, когда речь заходит о технологиях, не причиняющих вреда окружающей среде.
Читайте также: И хранить, и генерировать энергию для зданий сможет гибридная батарея на основе «реверсивных» топливных элементов
Экологически безопасный способ получения водорода состоит в том, чтобы отделить его от воды с помощью электролиза. Пара электродов помещается в емкость с жидкостью и включается питание. Кислород притягивается к аноду, водород – к катоду, и если при этом электричество, которое участвует в процессе, генерируется возобновляемыми источниками, то на выходе можно получить так называемый «зеленый» водород.
Пара электродов помещается в емкость с жидкостью и включается питание. Кислород притягивается к аноду, водород – к катоду, и если при этом электричество, которое участвует в процессе, генерируется возобновляемыми источниками, то на выходе можно получить так называемый «зеленый» водород.
Сегодня проблема промышленного производства водорода заключается в том, что расщепление воды является дорогостоящим и малоэффективным процессом. По этой причине такой вид топлива пока не может конкурировать с бензином. Новая разработка австралийских университетов UNSW, Griffith и Swinburne обещает совершить прорыв в этой области.
В документе, опубликованном в Nature Communications, команда ученых заявила, что им удалось заменить дорогую платину на углеродный катализатор.
«Мы покрываем электроды нашим катализатором, чтобы уменьшить потребление энергии, — уточнил профессор Школы химии UNSW Чуан Чжао. — На этом катализаторе имеется крошечный наноразмерный участок, где железо и никель взаимодействуют на атомном уровне. Именно здесь водород может быть отделен от кислорода, который выделяется в виде экологически чистых отходов».
Исследователи говорят, что наноуровень взаимодействия фундаментально меняет свойства материалов. Таким образом, никель-железный катализатор может быть таким же эффективным, как и платиновый. А дополнительным его преимуществом является возможность применения для катализа как водорода, так и кислорода, что значительно снижает производственные расходы.
Пока неясно, как скоро получится внедрить новую разработку в промышленность и насколько она повлияет на стоимость крупномасштабного производства водорода, но Чжао настроен оптимистично:
«Мы десятилетия говорили об эре водородной экономики, но сейчас эти разговоры могут стать реальностью».
Источник: unsw.edu.au
А вы что думаете по этому поводу? Дайте нам знать – напишите в комментариях!
Понравилась статья? Поделитесь ею и будет вам счастье!
Получение водорода в домашних условиях
На Земле водород в чистом виде почти не встречается, и в повседневной жизни мы с ним не сталкиваемся. Но в соединениях — это второй по количеству атомов элемент в земной коре после кислорода. Все живые существа на Земле, включая нас с вами, примерно на 2/3 состоят из водорода.
Но в соединениях — это второй по количеству атомов элемент в земной коре после кислорода. Все живые существа на Земле, включая нас с вами, примерно на 2/3 состоят из водорода.
Ключевые слова: водород, получение водорода.
Так что же такое водород? Каковы его свойства? Как его получают и применяют в земных условиях? Можно ли получить водород в домашних условиях, и как это делать лучше всего? На эти и другие вопросы мы постараемся ответить в ходе нашей научной работы.
Водород — это самый простой элемент в природе, состоящий из одного протона и вращающегося вокруг него электрона. Впервые получение водорода упоминается у английского учёного Роберта Бойля, который в 1671 году проводил реакцию между железными стружками и разбавленными кислотами. Русское наименование «водород» предложил химик М. Ф. Соловьев в 1824 году — по аналогии с «кислородом» М. В. Ломоносова. Официальное латинское название водорода «Hydrogenium».
В промышленности водород получают в основном из ископаемого топлива. В первую очередь это природный газ, метан, с которым большинство из нас может встретится на кухне, если вас есть газовая плита. Водород получают из лёгких фракций нефти. Третий по популярности источник водорода — это уголь.
Наиболее доступным для повторения в домашних условиях является разложение воды электрическим током (электролиз).
Для проведения нашего эксперимента мы взяли старую зарядку на 5 В 750мА и угольные электроды, извлечённые из обычных солевых батареек. Для измерения протекающего тока использовался мультиметр.
Для сбора и измерения получающихся газов, в бутылки налили воды, и закрепили их на основной ёмкости горлышком вниз, погрузив его при этом в электролит. Таким образом, чтобы воздух в бутылку попадать не смог. Всего в ёмкости и бутылках получилось около 1,5 литров воды. Как и ожидалось, с чистой водой, после подачи напряжения с зарядного устройства ничего не произошло. Мультиметр показывал почти нулевой ток. Но, когда в воду добавили две чайные ложки соды, электролиз пошёл бодрее, на обоих электродах начали появляться пузырьки газа, а мультиметр показал ток 15 мА. С таким маленьким током за сутки (24 часа) удалось собрать только 0,11 литра водорода (примерно полстакана). Во второй бутылке при этом собралось примерно в 2 раза меньше кислорода. Это означает, что в воде водорода в два раза больше, чем кислорода.
Всего в ёмкости и бутылках получилось около 1,5 литров воды. Как и ожидалось, с чистой водой, после подачи напряжения с зарядного устройства ничего не произошло. Мультиметр показывал почти нулевой ток. Но, когда в воду добавили две чайные ложки соды, электролиз пошёл бодрее, на обоих электродах начали появляться пузырьки газа, а мультиметр показал ток 15 мА. С таким маленьким током за сутки (24 часа) удалось собрать только 0,11 литра водорода (примерно полстакана). Во второй бутылке при этом собралось примерно в 2 раза меньше кислорода. Это означает, что в воде водорода в два раза больше, чем кислорода.
Наблюдение выделения водорода в результате взаимодействия металлов с разбавленными кислотами было самых первым в истории химии. И его относительно просто повторить в домашних условиях. Для этого нам понадобится металл, желательно поактивнее и кислота. В нашем эксперименте мы выбрали электролит для свинцовых аккумуляторов, который можно найти в ближайшем автомобильном магазине и цинк из использованных солевых батареек. Для сбора водорода, как и в случае электролиза, использовали перевёрнутую бутылку с опущенным в воду горлышком. Электролит дополнительно развели водой в пропорции 50 мл раствора серной кислоты на 150 мл. воды. Цинка из батарейки получилось примерно 1 г. За 12 часов весь металл растворился и мы получили 0.7 литра водорода.
Другой популярный метод — взаимодействие металлов с щелочами. Для эксперимента мы выбрали два варианта, которые были под рукой — кусочки провода и фольгу для запекания. Щёлочь (гидроксид натрия) можно найти в бытовых магазинах как средство для прочистки канализационных труб (КРОТ, например). Установку для получения использовали почти такую же, что и в опыте с кислотой и цинком. Раствор в обоих опытах был одинаковым: 20 мл щёлочи и 200 мл воды. В первом опыте использовали проволоку диаметром 1.5 мм, во втором — кусочки фольги. В обоих случаях масса алюминия была 1 г. В первом опыте удалось получить 1.
Таким образом, в экспериментах по получению водорода наиболее быстрым и доступным способом оказался вариант взаимодействия алюминиевой фольги со щёлочью. Но если необходимо получать водород регулярно и в больших количествах, то на первое место должен выйти электролиз, так как он не требует никаких расходных материалов кроме воды. Правда для этого понадобится более серьёзная установка, чем зарядка от телефона и пара бутылок.
В ходе научной работы мы познакомились с самым распространённым, но таким редким в быту веществом, как водород. Научились получать его различными способами и выбрали наиболее удобный для осуществления в домашних условиях — воздействие средства для прочистки труб, содержащего щёлочь, на алюминиевую фольгу.
Так же мы на собственном опыте убедились, что водород — горючий и взрывоопасный газ, но им вполне можно наполнять воздушные шарики, чтобы они летали. Правда при этом стоит держать их подальше от открытого огня.
Водородный генератор своими руками – схема, конструкция установки, чертежи
Удорожание энергоносителей стимулирует поиск более эффективных и дешевых видов топлива, в том числе на бытовом уровне. Более всего умельцев–энтузиастов привлекает водород, чья теплотворная способность втрое превышает показатели метана (38.8 кВт против 13.8 с 1 кг вещества). Способ добычи в домашних условиях, казалось бы, известен – расщепление воды путем электролиза. В действительности проблема гораздо сложнее. Наша статья преследует 2 цели:
Наша статья преследует 2 цели:
- разобрать вопрос, как сделать водородный генератор с минимальными затратами;
- рассмотреть возможность применения генератора водорода для отопления частного дома, заправки авто и в качестве сварочного аппарата.
Краткая теоретическая часть
Водород, он же hydrogen, – первый элемент таблицы Менделеева – представляет собой легчайшее газообразное вещество, обладающее высокой химической активностью. При окислении (то бишь, горении) выделяет огромное количество теплоты, образуя обычную воду. Охарактеризуем свойства элемента, оформив их в виде тезисов:
- Горение водорода – процесс экологически чистый, никаких вредных веществ не выделяется.
- Благодаря химической активности газ в свободном виде на Земле не встречается. Зато в составе воды его запасы неиссякаемы.
- Элемент добывается в промышленном производстве химическим способом, например, в процессе газификации (пиролиза) каменного угля. Зачастую является побочным продуктом.
- Другой способ получения газообразного водорода – электролиз воды в присутствии катализаторов – платины и прочих дорогих сплавов.
- Простая смесь газов hydrogen + oxygen (кислород) взрывается от малейшей искры, моментально высвобождая большое количество энергии.
Раньше водородом наполняли баллоны дирижаблей, которые нередко взрывалисьДля справки. Ученые, впервые разделившие молекулу воды на hydrogen и oxygen, назвали смесь гремучим газом из-за склонности к взрыву. Впоследствии она получила название газа Брауна (по фамилии изобретателя) и стала обозначаться гипотетической формулой ННО.
Из вышесказанного напрашивается следующий вывод: 2 атома водорода легко соединяются с 1 атомом кислорода, а вот расстаются весьма неохотно. Химическая реакция окисления протекает с прямым выделением тепловой энергии в соответствии с формулой:
2H2 + O2 → 2H2O + Q (энергия)
Здесь кроется важный момент, который пригодится нам в дальнейшем разборе полетов: hydrogen вступает в реакцию самопроизвольно от возгорания, а теплота выделяется напрямую.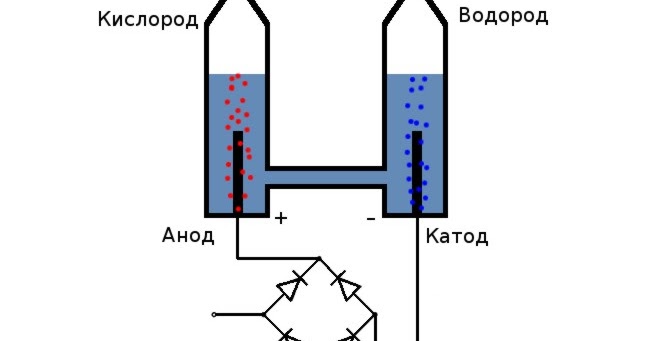 Чтобы разделить молекулу воды, энергию придется затратить:
Чтобы разделить молекулу воды, энергию придется затратить:
2H2O → 2H2 + O2 — Q
Это формула электролитической реакции, характеризующая процесс расщепления воды путем подведения электричества. Как это реализовать на практике и сделать генератор водорода своими руками, рассмотрим далее.
Создание опытного образца
Чтобы вы поняли, с чем имеете дело, для начала предлагаем собрать простейший генератор по производству водорода с минимальными затратами. Конструкция самодельной установки изображена на схеме.
Из чего состоит примитивный электролизер:
- реактор – стеклянная либо пластиковая емкость с толстыми стенками;
- металлические электроды, погружаемые в реактор с водой и подключенные к источнику электропитания;
- второй резервуар играет роль водяного затвора;
- трубки для отвода газа HHO.
Важный момент. Электролитическая водородная установка работает только от постоянного тока. Поэтому в качестве источника питания применяйте сетевой адаптер, автомобильное зарядное устройство или аккумулятор. Электрогенератор переменного тока не подойдет.
Принцип работы электролизера следующий:
- К двум электродам, погруженным в воду, подводится напряжение, желательно от регулируемого источника. Для улучшения реакции в емкость добавляется немного щелочи либо кислоты (в домашних условиях – обычной соли).
- В результате реакции электролиза со стороны катода, подключенного к «минусовой» клемме, станет выделяться водород, а возле анода – кислород.
- Смешиваясь, оба газа по трубке поступают в гидрозатвор, выполняющий 2 функции: отделение водяного пара и недопущение вспышки в реакторе.
- Из второй емкости гремучий газ ННО подается на горелку, где сжигается с образованием воды.
Чтобы своими руками сделать показанную на схеме конструкцию генератора, потребуется 2 стеклянных бутылки с широкими горлышками и крышками, медицинская капельница и 2 десятка саморезов. Полный набор материалов продемонстрирован на фото.
Полный набор материалов продемонстрирован на фото.
Из специальных инструментов потребуется клеевой пистолет для герметизации пластиковых крышек. Порядок изготовления простой:
- Плоские деревянные палочки скрутите саморезами, располагая их концами в разные стороны. Спаяйте головки шурупов между собой и подсоедините провода – получите будущие электроды.
- Проделайте отверстие в крышке, просуньте туда разрезанный корпус капельницы и провода, затем герметизируйте с 2 сторон клеевым пистолетом.
- Поместите электроды в бутылку и завинтите крышку.
- Во второй крышке просверлите 2 отверстия, вставьте трубки капельниц и накрутите на бутылку, заполненную обычной водой.
Для запуска генератора водорода налейте в реактор подсоленную воду и включите источник питания. Начало реакции ознаменуется появлением пузырьков газа в обеих емкостях. Отрегулируйте напряжение до оптимального значения и подожгите газ Брауна, выходящий из иглы капельницы.
Второй важный момент. Слишком высокое напряжение подавать нельзя — электролит, нагревшийся до 65 °С и более, начнет интенсивно испаряться. Из-за большого количества водяного пара разжечь горелку не удастся. Подробности сборки и запуска импровизированного водородного генератора смотрите на видео:
О водородной ячейке Мейера
Если вы сделали и испытали вышеописанную конструкцию, то по горению пламени на конце иглы наверняка заметили, что производительность установки чрезвычайно низкая. Чтобы получить больше гремучего газа, нужно изготовить более серьезное устройство, называемое ячейкой Стэнли Мейера в честь изобретателя.
Принцип действия ячейки тоже основан на электролизе, только анод и катод выполнены в виде трубок, вставляющихся одна в другую.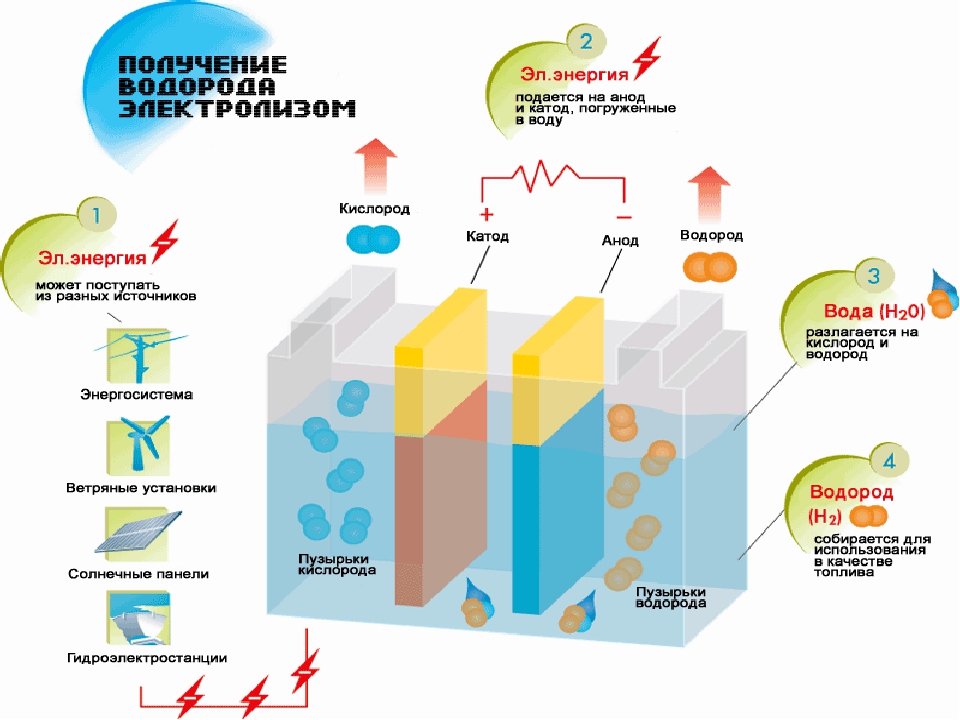 Напряжение подается от генератора импульсов через две резонансные катушки, что позволяет снизить потребляемый ток и увеличить производительность водородного генератора. Электронная схема устройства представлена на рисунке:
Напряжение подается от генератора импульсов через две резонансные катушки, что позволяет снизить потребляемый ток и увеличить производительность водородного генератора. Электронная схема устройства представлена на рисунке:
Примечание. Подробно о работе схемы рассказывается на ресурсе http://www.meanders.ru/meiers8.shtml.
Для изготовления ячейки Мейера потребуется:
- цилиндрический корпус из пластмассы или оргстекла, умельцы нередко используют водопроводный фильтр с крышкой и патрубками;
- трубки из нержавеющей стали диаметром 15 и 20 мм длиной 97 мм;
- провода, изоляторы.
Нержавеющие трубки крепятся к основанию из диэлектрика, к ним припаиваются провода, подключаемые к генератору. Ячейка состоит из 9 или 11 трубок, помещенных в пластиковый либо плексигласовый корпус, как показано на фото.
Под ячейку Мейера можно приспособить готовый пластиковый корпус от обычного водопроводного фильтраСоединение элементов производится по всем известной в интернете схеме, куда входит электронный блок, ячейка Мейера и гидрозатвор (техническое название – бабблер). В целях безопасности система снабжена датчиками критического давления и уровня воды. По отзывам домашних умельцев, подобная водородная установка потребляет ток порядка 1 ампера при напряжении 12 В и обладает достаточной производительностью, хотя точные цифры отсутствуют.
Принципиальная схема включения электролизераРеактор из пластин
Высокопроизводительный генератор водорода, способный обеспечить работу газовой горелки, выполняется из нержавеющих пластин размером 15 х 10 см, количество – от 30 до 70 шт. В них просверливаются отверстия под стягивающие шпильки, а в углу выпиливается клемма для присоединения провода.
Кроме листовой нержавейки марки 316 понадобится купить:
- резина толщиной 4 мм, стойкая к воздействию щелочи;
- концевые пластины из оргстекла либо текстолита;
- шпильки стяжные М10—14;
- обратный клапан для газосварочного аппарата;
- фильтр водяной под гидрозатвор;
- трубы соединительные из гофрированной нержавейки;
- гидроокись калия в виде порошка.
Пластины нужно собрать в единый блок, изолировав друг от друга резиновыми прокладками с вырезанной серединой, как показано на чертеже. Получившийся реактор плотно стянуть шпильками и подключить к патрубкам с электролитом. Последний поступает из отдельной емкости, снабженной крышкой и запорной арматурой.
Схема водородной установки мокрого типаПримечание. Мы рассказываем, как сделать электролизер проточного (сухого) типа. Реактор с погружными пластинами изготовить проще – резиновые прокладки ставить не нужно, а собранный блок опускается в герметичную емкость с электролитом.
Последующая сборка генератора, производящего водород, выполняется по той же схеме, но с отличиями:
- На корпусе аппарата крепится резервуар для приготовления электролита. Последний представляет собой 7—15% раствор гидроокиси калия в воде.
- В «бабблер» вместо воды заливается так называемый раскислитель – ацетон либо неорганический растворитель.
- Перед горелкой обязательно ставится обратный клапан, иначе при плавном выключении водородной горелки обратный удар разорвет шланги и «бабблер».
Для питания реактора проще всего задействовать сварочный инвертор, электронные схемы собирать не нужно. Как устроен самодельный генератор газа Брауна, расскажет домашний мастер в своем видео:
Выгодно ли получать водород в домашних условиях
Ответ на данный вопрос зависит от сферы применения кислородно-водородной смеси. Все чертежи и схемы, публикуемые различными интернет-ресурсами, рассчитаны на выделение газа HHO для следующих целей:
- использовать hydrogen в качестве топлива для автомобилей;
- бездымно сжигать водород в отопительных котлах и печах;
- применять для газосварочных работ.

Главная проблема, перечеркивающая все преимущества водородного топлива: затраты электричества на выделение чистого вещества превышают количество энергии, получаемое от его сжигания. Что бы ни утверждали приверженцы утопичных теорий, максимальный КПД электролизера достигает 50%. Это значит, что на 1 кВт полученной теплоты затрачивается 2 кВт электроэнергии. Выгода – нулевая, даже отрицательная.
Вспомним, что мы писали в первом разделе. Hydrogen – весьма активный элемент и реагирует с кислородом самостоятельно, выделяя уйму тепла. Пытаясь разделить устойчивую молекулу воды, мы не можем подвести энергию непосредственно к атомам. Расщепление производится за счет электричества, половина которого рассеивается на подогрев электродов, воды, обмоток трансформаторов и так далее.Важная справочная информация. Удельная теплота сгорания водорода втрое выше, чем у метана, но – по массе. Если сравнивать их по объему, то при сжигании 1 м³ гидрогена выделится всего 3.6 кВт тепловой энергии против 11 кВт у метана. Ведь водород – легчайший химический элемент.
Теперь рассмотрим гремучий газ, полученный электролизом в самодельном водородном генераторе, как топливо для вышеперечисленных нужд:
- Конечная цена установки, низкая производительность и КПД делает крайне невыгодным сжигание водорода для отопления частного дома. Чем «наматывать» счетчик электролизером, проще поставить любой из электрокотлов – ТЭНовый, индукционный либо электродный.
- Чтобы заменить 1 л бензина для автомобиля, потребуется 4766 литров чистого водорода или 7150 л гремучего газа, треть которого составляет кислород. Самый завравшийся изобретатель в интернете еще не сделал электролизер, способный обеспечить подобную производительность.
- Газосварочный аппарат, сжигающий hydrogen, компактнее и легче баллонов с ацетиленом, пропаном и кислородом. Плюс температура пламени до 3000 °С позволяет работать с любыми металлами, стоимость получения горючего здесь особой роли не играет.

Для справки. Чтобы сжигать гидроген в отопительном котле, придется основательно переработать конструкцию, поскольку водородная горелка способна расплавить любую сталь.
Заключение
Гидроген в составе газа ННО, полученный из самодельного водородного генератора, пригодится для двух целей: экспериментов и газосварки. Даже если отбросить низкий КПД электролизера и затраты на его сборку вместе с потребляемым электричеством, на обогрев здания попросту не хватит производительности. Это касается и бензинового двигателя легковой машины.
Водород в промышленных масштабах. Новости
Технологическим центром «Энергофермы Майнц» является электролизер высокого давления с протонопроводящей мембраной (PEM), которая расположена между двумя электродами, отвечающими за отделение водорода от кислорода. РЕМ электролизер отличается высокодинамичным откликом (в течение миллисекунд) и может быстро справляться как с увеличенной в полтора раза нагрузкой, так и с перепадами напряжения.
На полную мощность в 6 МВт установка выходит в считаные секунды, поэтому способна быстро восполнить недостаток энергии в системе в случае снижения объемов выработки возобновляемыми источниками. При этом основным источником электроэнергии для завода в Майнце являются расположенные поблизости ветряные фермы. Таким образом, поддерживается идеальный баланс энергосистемы, при котором неравномерность генерации компенсируется подключением резервных мощностей завода.
Через сотрудничество – к инновациям
Процесс разработки и промышленного внедрения технологии длился 2 года. Наряду с «Сименс» в нем также принимали участие Университет Рейн-Майн, компания Linde и муниципальные учреждения Майнца (Германия).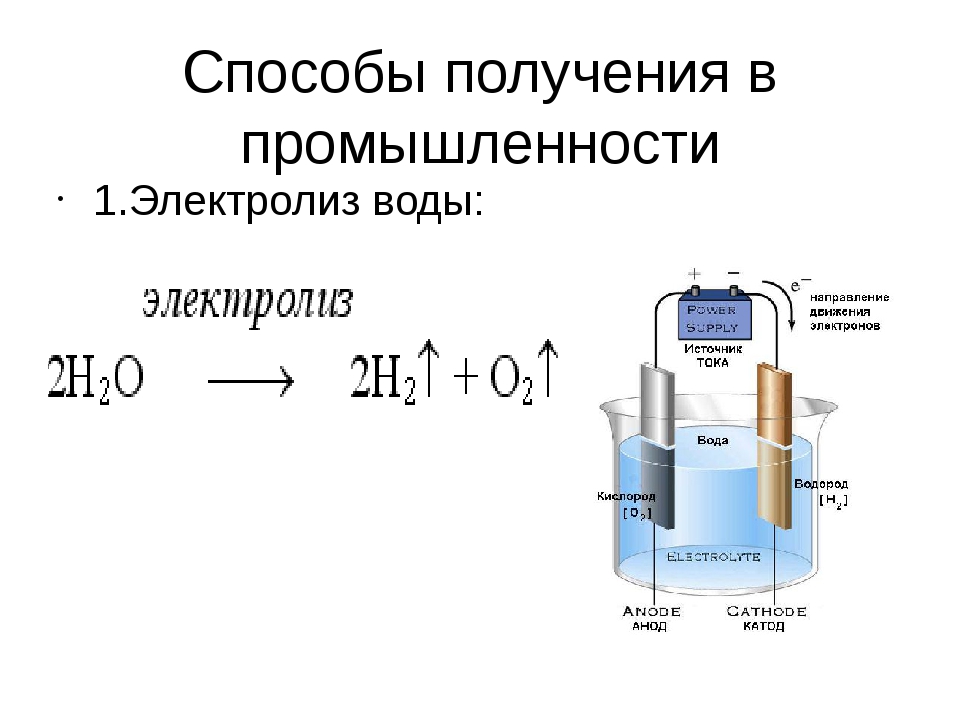
Компания «Сименс» осуществляла поставку базового элемента системы – установки для электролиза. В ее оснащении использовались контроллеры Simatic, отвечающие за автоматизацию технологических процессов. Также «Сименс» предоставила станции среднего напряжения с трансформаторами GEAFOL, питающими энергоблоки низкого и высокого напряжения конвертеров Sinamic, и распределительные устройства среднего напряжения (20 кВ) с газовой изоляцией. Система управления всей энергофермой также выполнена на основе оборудования Simatic.
За обслуживание оборудования отвечает компания Linde. Она также производит очистку, сжатие, хранение и закачку водорода в хранилище.
В функции университета Рейн-Майн входит обеспечение общего научного контроля проекта. В частности, его сотрудники проводят анализ взаимодействия всех компонентов: электролитической установки и компрессора, энергосети и системы передачи газа, и т.д.
Совершенный энергоресурс
Водород – универсальный источник энергии. Его можно снова использовать для получения электричества, им можно заправлять работающие на водороде автомобили или превращать в метан путем соединения с углекислым газом. Метан, являющийся основным компонентом природного газа, можно хранить в уже существующей инфраструктуре для природного газа и использовать в отопительных системах или в качестве топлива для некоторых видов транспорта.
Пока водород производят, в основном, путем расщепления метана. Технология на основе электролиза воды, применяемая на заводе в Майнце, является превосходной альтернативой этому процессу, поскольку предполагает использование возобновляемых источников энергии и сопоставима по производственным затратам.
Электричество из лужи, или Как получить энергию из воды — Энергетика и промышленность России — № 19 (327) октябрь 2017 года — WWW.EPRUSSIA.RU
Газета «Энергетика и промышленность России» | № 19 (327) октябрь 2017 года
Без еды человек может прожить от четырех до шести недель, а вот без воды – не более трех дней. Впрочем, не только человек, все живое нуждается в воде.
Впрочем, не только человек, все живое нуждается в воде.Однако именно человек пошел дальше всех, ведь людям вода нужна не только для поддержания жизни, приготовления пищи и гигиены, но и для многого другого. Воду мы используем и в быту, и на производстве. И вот теперь человечество всерьез задумалось о том, чтобы добывать из воды энергию!
Конечно, человек давно уже умеет добывать энергию с помощью воды, для чего служит огромное количество гидроэлектростанций, построенных по всему миру. Однако можно ли добывать энергию прямо из воды?
Невозможное возможно?
В принципе, современная физика к подобному относится с изрядным скепсисом. Ведь, в соответствии с фундаментальными физическими законами, нет способа извлекать химическую энергию из воды. У воды отрицательная энтальпия образования, следовательно, для разделения ее на элементы требуется затратить энергию. Не существует соединений кислорода и водорода с большей негативной энтальпией образования, за счет которой мог бы быть получен избыток энергии. Поэтому многие изобретатели, которые заявляли, что научились добывать энергию непосредственно из воды, получали клеймо мошенников.Однако изобретателей это не останавливает, и раз за разом ученые пытаются добиться невозможного. Вот и опять не так давно была опубликована информация о том, что ученые разработали технологию, благодаря которой из воды стало возможно получать экологически чистую энергию. Якобы этого добился профессор Массачусетского технологического института Дэниэл Носер.
Прототип получил название Sun Catalytix. Для извлечения водорода из воды устройство использует солнечную энергию. Специальный солнечный элемент помещается в сосуд с водой. При попадании на него света образуются пузырьки водорода. Процесс получения дешевой энергии из воды полностью обратим. При помощи солнечного света происходит разложение воды на водород и кислород. Получаемый кислород впоследствии используется при горении водорода. Конечным продуктом горения снова является вода.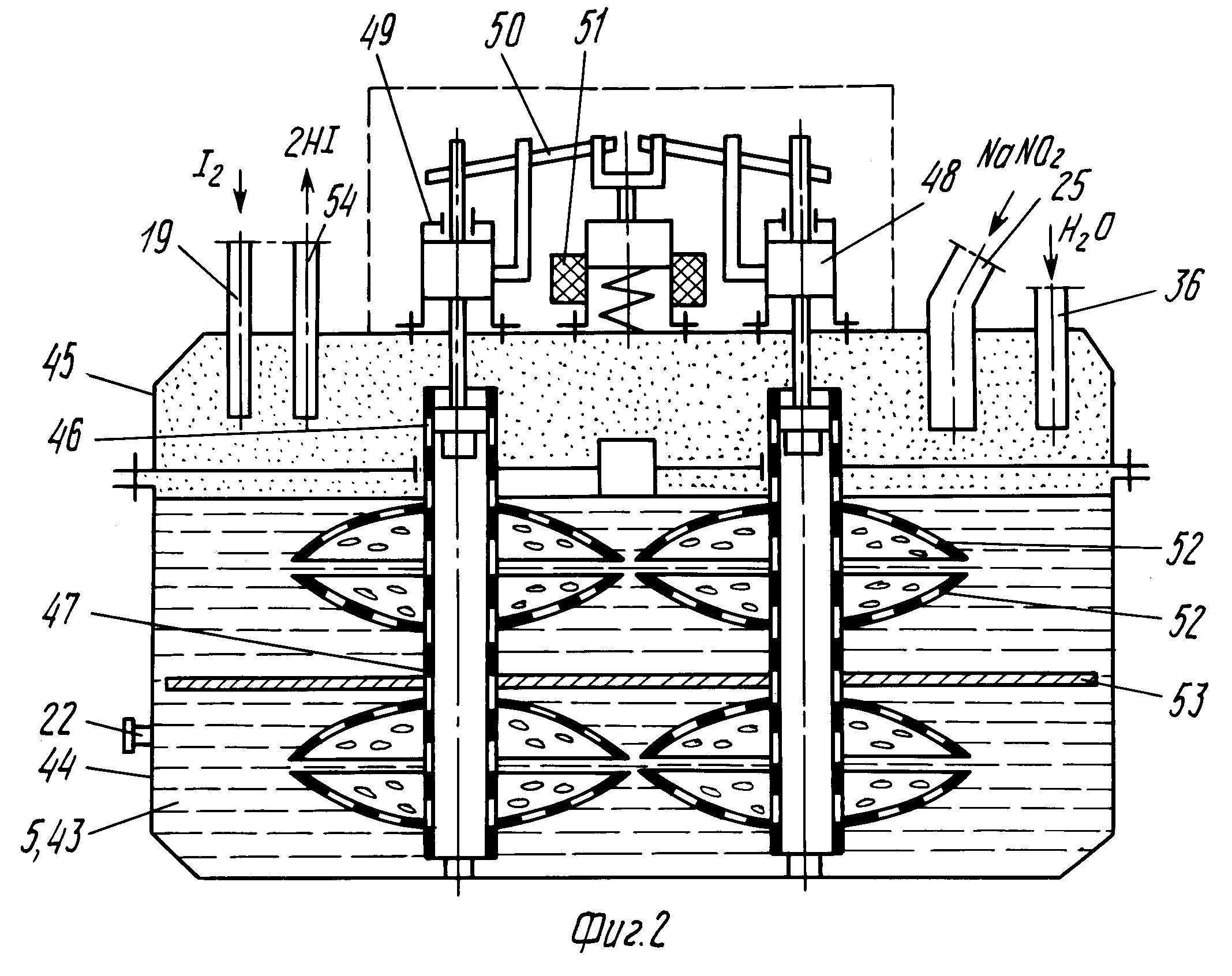 Получается такой себе «круговорот воды в природе» в пределах энергетической установки. По сути, солнечная энергия преобразуется в удобную для использования форму посредством воды.
Получается такой себе «круговорот воды в природе» в пределах энергетической установки. По сути, солнечная энергия преобразуется в удобную для использования форму посредством воды.
Разработчики уверены, что их изобретение сможет применяться не только для обеспечения энергией отдельных домов и учреждений, но даже в транспортных средствах. Их уверенность была подкреплена грантом в размере 4 млн долл. от Агентства исследований в области энергетики и индийского машиностроительного гиганта Tata. Была даже создана «Sun Catalytix Corporation».
По словам разработчиков, их технология обеспечит источниками бесплатной энергии как жилые дома, так и другие объекты в странах третьего мира. Сюда включаются и транспортные решения, и промышленные предприятия и т. д.
Единственное, что смущает в этой «новости» – датирована она 2011 г., а Google даже утверждает, что «по их данным, компания Sun Catalytix Corporation закрыта навсегда».
Топливо из воды
Так что же получается? Неужели физика права, и вода не сможет нам помочь в деле производства энергии? Возможно, это и так, но из воды можно получить топливо. Например, водород. Сейчас водород получают, главным образом, из природного газа методом каталитической конверсии с водяным паром. Пока это самый дешевый способ, но в конечном итоге такой путь ведет в тупик, ведь запасы газа рано или поздно тоже закончатся. Неиссякаемым источником водорода может служить вода. Электролиз воды технически осуществить довольно просто, но этот процесс требует значительных энергозатрат. Технология будет экономически выгодной только в том случае, если использовать дешевую электроэнергию, получаемую желательно из возобновляемых источников, – за счет энергии воды, ветра, солнца.Еще в 1935 г. Чарльз Гаррет продемонстрировал «в течение нескольких минут» работу «водяного автомобиля». Как можно увидеть из патента Гаррета, оформленного в том же году, для генерации водорода применялся электролиз. Повторить успех Гаррета пытались и другие изобретатели. Конечно, в этом деле тоже не все так просто. И многие изобретатели, заявлявшие, что добились в вопросе получения топлива из воды существенного прогресса, также оказались мошенниками.
Конечно, в этом деле тоже не все так просто. И многие изобретатели, заявлявшие, что добились в вопросе получения топлива из воды существенного прогресса, также оказались мошенниками.
Например, в 2002 г. Genesis World Energy анонсировала готовое к продвижению на рынок устройство, которое извлекало бы энергию из воды путем ее разложения на водород и кислород. Увы, в 2006 г. Патрик Келли, собственник GWE, был приговорен в Нью-Джерси к пяти годам тюрьмы за кражу и выплате возмещений в размере 400 тыс. долл.
Другой изобретатель, Дэниэл Дингел, заявлял, что разработал технологию, позволяющую использовать воду в качестве топлива. В 2000 г. Дингел стал бизнес-партнером компании Formosa Plastics Group с целью дальнейшего развития технологии. Но в 2008-м компания подала на изобретателя иск за мошенничество, и 82‑летний Дингел был приговорен к 20 годам тюрьмы.
В том же 2008 г. СМИ Шри-Ланки сообщили о некоем гражданине этой страны по имени Тушара Приямал Эдиризинге, который утверждал, что проехал около 300 км на «водяном автомобиле», потратив 3 литра воды. Тушара продемонстрировал свою технологию премьер-министру Ратнасири Викреманаяке, который пообещал всемерную правительственную поддержку его усилий по продвижению водяного автомобиля на рынок Шри-Ланки. Однако несколько месяцев спустя Тушара был арестован по обвинению в мошенничестве.
Шанс все же есть
Вместе с тем, ошибочно думать, что все, кто занимается проблемой получения топлива из воды, – мошенники. Например, авторитетный ученый Джеффри Хьюитт даже стал лауреатом премии «Глобальная энергия» в 2007 г. за идею производства топлива на основе энергии воды. К сожалению, сам ученый считает, что подобные методы добычи топлива еще долго останутся недоступными для будничного использования в связи с их высокой стоимостью. По его мнению, стоимость такой энергии безумно велика, и время, когда экологичные виды топлива можно будет использовать в повседневной жизни, настанет еще не скоро. Так что пока энергия из воды – не конкурент традиционной энергетики. Однако ученый уверен, что эту отрасль энергетики необходимо активно развивать, так как применение, например, водородного сырья может повысить коэффициент полезного действия электростанций до 85 % с текущего уровня в 50 %. И в будущем новое горючее способно заменить все существующие ныне ресурсы.
Однако ученый уверен, что эту отрасль энергетики необходимо активно развивать, так как применение, например, водородного сырья может повысить коэффициент полезного действия электростанций до 85 % с текущего уровня в 50 %. И в будущем новое горючее способно заменить все существующие ныне ресурсы.Так что ученые не зря бьются над этой проблемой. Возможно, в скором времени это принесет свои плоды. Например, в марте этого года пришло сообщение, что в процессе лабораторных исследований ученые из Калифорнийского университета научились создавать топливо из воды. Над созданием альтернативного вида топлива американские специалисты начали работу еще два года назад. На протяжении этого времени ученые обнаружили, что при правильном расщеплении молекул воды получается горючее, которое в будущем способно заменить все существующие ныне ресурсы. Полученный результат не до конца удовлетворил ученых, поэтому исследовательская работа еще продолжается.
Новый метод, который разработали специалисты, способен расщеплять воду на несколько молекул. При правильном синтезе водорода возникают процессы, которые присущи топливу. Однако существует основная проблема, решением которой занимаются ученые. Дело в том, что расщепленные молекулы подвергаются стремительному разрушению, в результате чего синтезировать все элементы не представляется возможным.
На сегодняшний день ученые работают над созданием метода, который бы позволил использовать все полученные элементы. Конечно, это вновь может оказаться уткой, но возможно что и нет. И если результаты научной работы окажутся положительными, то человечество получит новый альтернативный вид топлива, ресурсы которого будут неограниченными.
Расщепление воды с эффективностью 100%: полдела сделано / Хабр
Если найти дешёвый и простой способ электролиза/фотолиза воды, то мы получим невероятно богатый и чистый источник энергии — водородное топливо. Сгорая в кислороде, водород не образует никаких побочных выделений, кроме воды. Теоретически, электролиз — очень простой процесс: достаточно пропустить электрический ток через воду, и она разделяется на водород и кислород. Но сейчас все разработанные техпроцессы требуют такого большого количества энергии, что электролиз становится невыгодным.
Но сейчас все разработанные техпроцессы требуют такого большого количества энергии, что электролиз становится невыгодным.
Теперь учёные решили часть головоломки. Исследователи из Технион-Израильского технологического института разработали метод проведения второго из двух шагов окислительно-восстановительной реакции — восстановления — в видимом (солнечном) свете с энергетической эффективностью 100%, значительно превзойдя предыдущий рекорд 58,5%.
Осталось усовершенствовать полуреакцию окисления.
Столь высокой эффективности удалось добиться благодаря тому, что в процессе используется только энергия света. Катализаторами (фотокатализаторами) выступают наностержни длиной 50 нм. Они абсорбируют фотоны от источника освещения — и выдают электроны.
В полуреакции окисления производятся четыре отдельных атома водорода и молекула О2 (которая не нужна). В полуреакции восстановления четыре атома водорода спариваются в две молекулы H2, производя полезную форму водорода — газ H2,
Эффективность 100% означает, что все фотоны, поступившие в систему, участвуют в генерации электронов.
На такой эффективности каждый наностержень генерирует около 100 молекул H2 в секунду.
Сейчас учёные работают над оптимизацией техпроцесса, который пока что требует щелочной среды с невероятно высоким pH. Такой уровень никак не приемлем для реальных условий эксплуатации.
К тому же, наностержни подвержены коррозии, что тоже не слишком хорошо.
Тем не менее, сегодня человечество стало на шажок ближе к получению неиссякаемого источника чистой энергии в виде водородного топлива.
Научная работа опубликована в журнале Nano Letters (зеркало).
Центр данных по альтернативным видам топлива: производство и распределение водорода
Несмотря на то, что водород присутствует в большом количестве на Земле как элемент, он почти всегда присутствует в составе другого соединения, такого как вода (H 2 O) или метан (CH 4 ), и его необходимо разделить на чистый водород (H 2).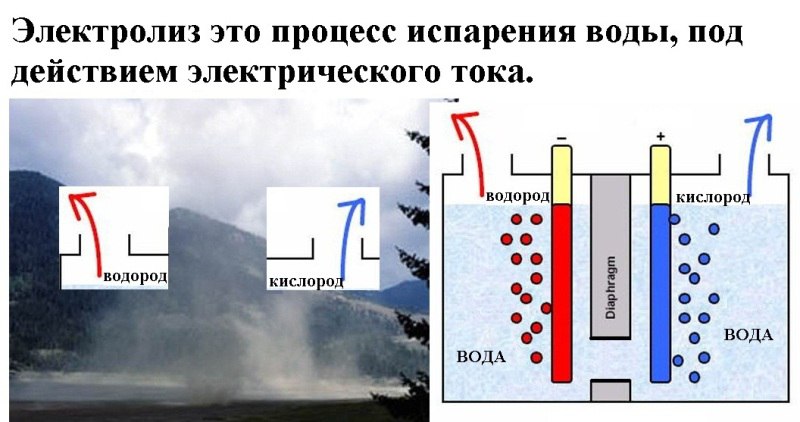 ) для использования в электромобилях на топливных элементах. Водородное топливо соединяется с кислородом воздуха через топливный элемент, создавая электричество и воду в результате электрохимического процесса.
) для использования в электромобилях на топливных элементах. Водородное топливо соединяется с кислородом воздуха через топливный элемент, создавая электричество и воду в результате электрохимического процесса.
Производство
Водород можно производить из различных внутренних ресурсов, включая ископаемое топливо, биомассу и электролиз воды с помощью электричества. Воздействие водорода на окружающую среду и энергоэффективность зависят от того, как он производится. Реализуется несколько проектов по снижению затрат, связанных с производством водорода.
Есть несколько способов производства водорода:
Риформинг / газификация природного газа: Синтез-газ, смесь водорода, окиси углерода и небольшого количества двуокиси углерода, образуется в результате реакции природного газа с высокотемпературным паром.Окись углерода реагирует с водой с образованием дополнительного водорода. Этот метод самый дешевый, эффективный и самый распространенный. На конверсию природного газа с использованием пара приходится большая часть водорода, ежегодно производимого в Соединенных Штатах.
Синтез-газ также может быть создан путем реакции угля или биомассы с высокотемпературным паром и кислородом в газификаторе под давлением, который преобразуется в газообразные компоненты — процесс, называемый газификация . Полученный синтез-газ содержит водород и монооксид углерода, который реагирует с водяным паром для отделения водорода.
Электролиз: Электрический ток расщепляет воду на водород и кислород. Если электричество производится из возобновляемых источников, таких как солнце или ветер, образующийся водород также будет считаться возобновляемым и имеет множество преимуществ по выбросам. Набирают обороты проекты по производству водорода, когда избыточная возобновляемая электроэнергия, если таковая имеется, используется для производства водорода посредством электролиза.

Возобновляемый жидкий риформинг: Возобновляемое жидкое топливо, такое как этанол, реагирует с высокотемпературным паром с образованием водорода вблизи точки конечного использования.
Ферментация: Биомасса превращается в сырье, богатое сахаром, которое можно ферментировать для получения водорода.
Ряд методов производства водорода находится в стадии разработки:
Основными производителями водорода являются Калифорния, Луизиана и Техас. Сегодня почти весь водород, производимый в Соединенных Штатах, используется для очистки нефти, обработки металлов, производства удобрений и обработки пищевых продуктов.
Основной задачей производства водорода является снижение стоимости технологий производства, чтобы сделать получаемый водород конкурентоспособным по сравнению с обычным транспортным топливом.Государственные и промышленные научно-исследовательские и опытно-конструкторские проекты снижают стоимость, а также снижают воздействие на окружающую среду технологий производства водорода. Узнайте больше о производстве водорода в Управлении технологий производства водорода и топливных элементов.
Распределение
Большая часть водорода, используемого в Соединенных Штатах, производится там или поблизости от того места, где он используется, обычно на крупных промышленных предприятиях. Инфраструктура, необходимая для распределения водорода по общенациональной сети заправочных станций, необходимых для повсеместного использования электромобилей на топливных элементах, все еще нуждается в развитии.Первоначальное развертывание транспортных средств и станций сосредоточено на построении этих распределительных сетей, в первую очередь в южной и северной Калифорнии.
В настоящее время водород распределяется тремя способами:
Трубопровод: Этот наименее дорогой способ доставки больших объемов водорода ограничен, поскольку в настоящее время доступно только около 1600 миль трубопроводов США для доставки водорода.
 Эти трубопроводы расположены недалеко от крупных нефтеперерабатывающих и химических заводов в Иллинойсе, Калифорнии и на побережье Мексиканского залива.
Эти трубопроводы расположены недалеко от крупных нефтеперерабатывающих и химических заводов в Иллинойсе, Калифорнии и на побережье Мексиканского залива.Трубные прицепы высокого давления: Транспортировка сжатого водородного газа грузовиком, железнодорожным вагоном, кораблем или баржей в трубчатых прицепах высокого давления является дорогостоящей и используется в основном на расстояния до 200 миль или меньше.
Цистерны для сжиженного водорода: Криогенное сжижение — это процесс, при котором водород охлаждается до температуры, при которой он становится жидкостью. Хотя процесс сжижения является дорогостоящим, он позволяет транспортировать водород более эффективно (по сравнению с использованием трубных прицепов высокого давления) на большие расстояния грузовиком, железнодорожным вагоном, кораблем или баржей.Если сжиженный водород не используется с достаточно высокой скоростью в точке потребления, он выкипает (или испаряется) из резервуаров для хранения. В результате необходимо тщательно согласовывать скорости доставки и потребления водорода.
Создание инфраструктуры для распределения и доставки водорода на тысячи будущих заправочных станций представляет собой множество проблем. Поскольку водород содержит меньше энергии на единицу объема, чем все другие виды топлива, его транспортировка, хранение и доставка к месту конечного использования обходятся дороже в пересчете на галлоновый эквивалент бензина (на ГПЭ).Строительство новой сети водородных трубопроводов связано с высокими начальными капитальными затратами, а свойства водорода создают уникальные проблемы для материалов трубопроводов и конструкции компрессора. Однако, поскольку водород можно производить из самых разных ресурсов, региональное или даже местное производство водорода может максимально использовать местные ресурсы и минимизировать проблемы с распределением.
Необходимо учитывать компромисс между централизованным и распределенным производством. Производство водорода централизованно на крупных заводах снижает производственные затраты, но увеличивает затраты на сбыт.Производство водорода в точке конечного использования — например, на заправочных станциях — снижает затраты на сбыт, но увеличивает производственные затраты из-за затрат на создание производственных мощностей на месте.
Производство водорода централизованно на крупных заводах снижает производственные затраты, но увеличивает затраты на сбыт.Производство водорода в точке конечного использования — например, на заправочных станциях — снижает затраты на сбыт, но увеличивает производственные затраты из-за затрат на создание производственных мощностей на месте.
Государственные и промышленные научно-исследовательские проекты преодолевают препятствия на пути к эффективному распределению водорода. Узнайте больше о распределении водорода в Управлении технологий водорода и топливных элементов.
Как получить водородный газ (4 метода)
Газообразный водород легко получить дома или в лаборатории, используя обычные бытовые материалы.Вот как безопасно получить водород.
Сделайте водородный газ — метод 1
Один из самых простых способов получить водород — это получить его из воды, H 2 O. В этом методе используется электролиз, при котором вода расщепляется на водород и газообразный кислород.
Необходимые материалы
- вода
- 9-вольтовая батарея
- 2 скрепки
- другая емкость с водой
Ступеньки
- Разогните скрепки и подсоедините по одной к каждой клемме аккумулятора.
- Остальные концы, не касаясь, опустить в емкость с водой. Вот и все!
- На обоих проводах появятся пузыри. Тот, у которого больше пузырьков, выделяет чистый водород. Остальные пузырьки — это нечистый кислород. Вы можете проверить, какой газ является водородом, зажег спичку или зажигалку над контейнером. Пузырьки водорода загорятся; пузырьки кислорода не горят.
- Соберите газообразный водород, перевернув заполненную водой трубку или сосуд над проволокой, производящей газообразный водород. Причина, по которой вам нужна вода в контейнере, заключается в том, чтобы вы могли собирать водород, не получая воздуха.Воздух содержит 20% кислорода, который вы не должны попадать в контейнер, чтобы он не стал опасно воспламеняющимся.
По той же причине не собирайте газ, отходящий от обоих проводов, в один и тот же контейнер, так как смесь может взорваться при возгорании. При желании вы можете собирать кислород так же, как водород, но имейте в виду, что этот газ не очень чистый.
- Закройте или закройте контейнер перед его переворачиванием, чтобы избежать контакта с воздухом. Отсоедините аккумулятор.
Получение газообразного водорода — метод 2
Есть два простых улучшения, которые вы можете сделать, чтобы повысить эффективность производства газообразного водорода.Вы можете использовать графит (уголь) в виде грифеля карандаша в качестве электродов, и вы можете добавить щепотку соли в воду, чтобы она действовала как электролит.
Из графита получаются хорошие электроды, поскольку он электрически нейтрален и не растворяется во время реакции электролиза. Соль полезна, потому что она диссоциирует на ионы, которые увеличивают ток.
Необходимые материалы
- 2 карандаша
- соль
- картон
- вода
- батарея (может опуститься до 1.5 В с электролитом)
- 2 скрепки или (еще лучше) 2 куска электрического провода
- другая емкость с водой
Ступеньки
- Подготовьте карандаши, удалив стиральную и металлическую заглушки и заточив оба конца карандаша.
- Вы собираетесь использовать картон, чтобы держать карандаши в воде. Положите картон на емкость с водой. Вставьте карандаши в картон так, чтобы грифель был погружен в жидкость, но не касался дна или стенок емкости.
- Отложите картон с карандашами на мгновение и добавьте в воду щепотку соли. Вы можете использовать поваренную соль, английскую соль и т. Д.
- Замените картон / карандаш. К каждому карандашу прикрепите провод и подключите его к клеммам аккумулятора.
- Собрать газ, как и прежде, в емкость, наполненную водой.
Получение газообразного водорода — метод 3
Вы можете получить газообразный водород, реагируя соляной кислотой с цинком:
Цинк + соляная кислота → хлорид цинка + водород
Zn (т) + 2HCl (л) → ZnCl 2 (л) + H 2 (г)
Необходимые материалы
- соляная кислота (соляная кислота)
- гранулы цинка (или железные опилки или полосы алюминия)
Пузырьки газообразного водорода будут выпущены, как только кислота и цинк будут смешаны.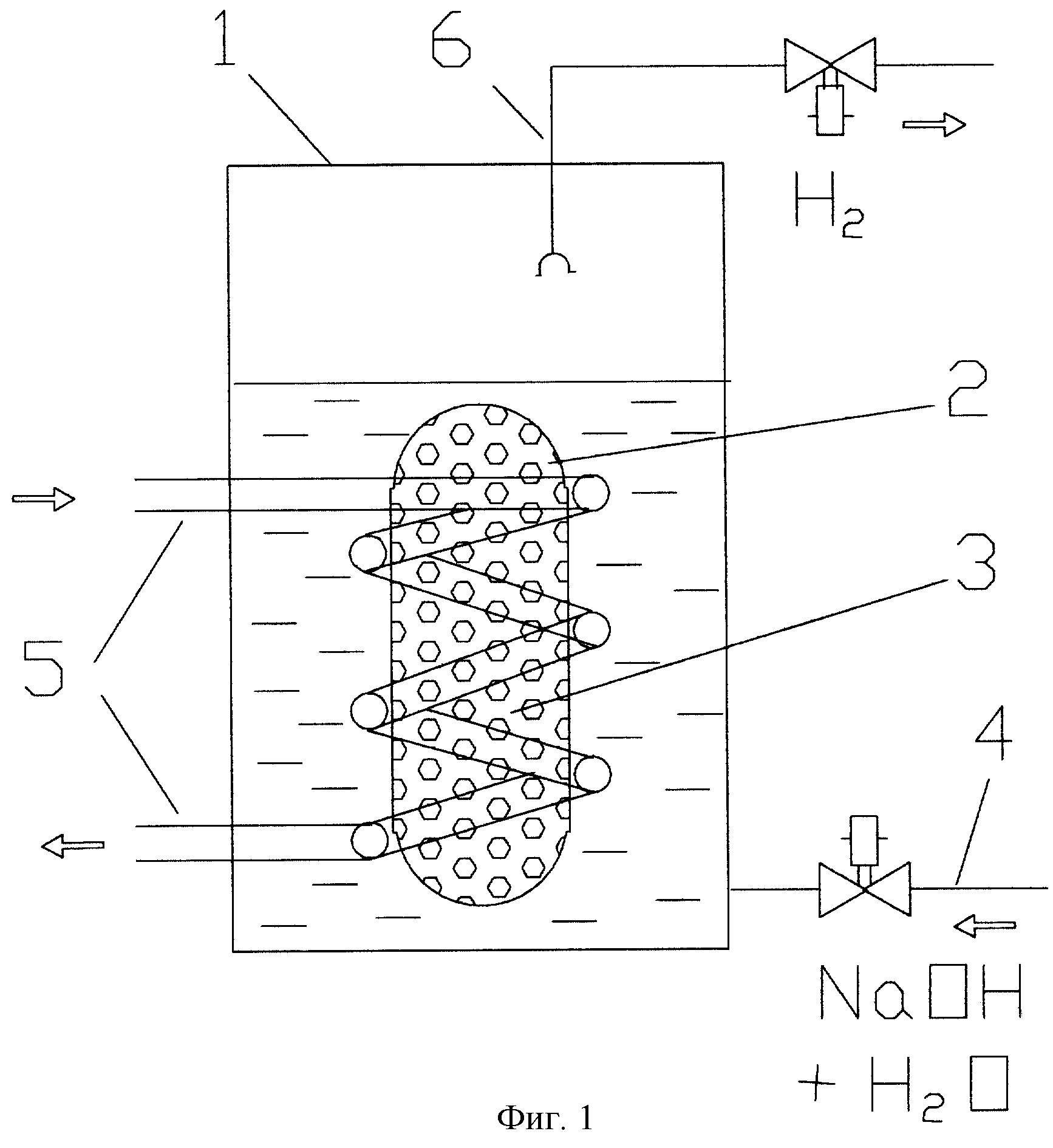 Будьте очень осторожны, чтобы избежать контакта с кислотой. Кроме того, эта реакция выделяет тепло.
Будьте очень осторожны, чтобы избежать контакта с кислотой. Кроме того, эта реакция выделяет тепло.
Самодельный водородный газ — метод 4
Алюминий + гидроксид натрия → Водород + алюминат натрия
2Al (s) + 6NaOH (водн.) → 3H 2 (г) + 2Na 3 AlO 3 (водн.)
Необходимые материалы
- гидроксид натрия (содержится в некоторых средствах для удаления засоров слива)
- алюминий (входит в состав средств для удаления слива или можно использовать фольгу)
Это чрезвычайно простой способ получения газообразного водорода в домашних условиях.Просто добавьте немного воды в средство для удаления засоров слива! Реакция экзотермична, поэтому используйте стеклянную (не пластиковую) бутылку для сбора образовавшегося газа.
Безопасность водородного газа
- Главное соображение безопасности — исключить возможность смешивания газообразного водорода с кислородом воздуха. Если это произойдет, ничего плохого не произойдет, но полученная смесь воздух-водород гораздо более горючая, чем сам по себе водород, потому что теперь она содержит кислород, который будет действовать как окислитель.
- Храните газообразный водород вдали от открытого пламени или другого источника воспламенения.
Новый способ получения водородного топлива из морской воды
Эрин И. Гарсия де Хесус
Исследователи из Стэнфорда разработали способ получения водородного топлива с использованием солнечной энергии, электродов и соленой воды из залива Сан-Франциско.
Хунцзе Дай и его исследовательская лаборатория в Стэнфордском университете разработали прототип, который может генерировать водородное топливо из морской воды. (Изображение предоставлено H.Дай, Юн Куанг, Майкл Кенни)
Результаты, опубликованные 18 марта в Трудах Национальной академии наук , демонстрируют новый способ отделения газообразного водорода и кислорода от морской воды с помощью электричества. В существующих методах разделения воды используется вода высокой степени очистки, которая является ценным ресурсом и требует больших затрат в производстве.
В существующих методах разделения воды используется вода высокой степени очистки, которая является ценным ресурсом и требует больших затрат в производстве.
Теоретически, чтобы приводить в действие города и автомобили, «вам нужно столько водорода, что невозможно использовать очищенную воду», — сказал Хунцзе Дай, Дж.Дж. Джексон и С.Дж. Вуд, профессор химии Стэнфордской школы гуманитарных и естественных наук и соавтор статьи. «У нас едва хватает воды для наших текущих потребностей в Калифорнии».
Водород является привлекательным вариантом в качестве топлива, поскольку он не выделяет углекислый газ, сказал Дай. Сжигание водорода дает только воду и должно облегчить усугубление проблем, связанных с изменением климата.
Дай сказал, что его лаборатория продемонстрировала доказательство концепции с помощью демонстрации, но исследователи предоставят производителям возможность масштабировать и массово производить дизайн.
Борьба с коррозией
По идее, разделение воды на водород и кислород с помощью электричества — называемое электролизом — это простая и старая идея: источник энергии подключается к двум электродам, помещенным в воду. Когда включается питание, газообразный водород выходит из отрицательного конца, называемого катодом, а кислород, пригодный для дыхания, выходит из положительного конца — анода.
Но отрицательно заряженный хлорид в морской воде может вызвать коррозию положительного конца, ограничивая срок службы системы.Дай и его команда хотели найти способ не дать компонентам морской воды разрушить затопленные аноды.
Исследователи обнаружили, что если они покрыли анод слоями, богатыми отрицательными зарядами, эти слои отталкивали хлорид и замедляли распад лежащего под ним металла.
Они нанесли слой гидроксида никеля и железа поверх сульфида никеля, который покрывает сердцевину из пены никеля. Пена никеля действует как проводник, переносящий электричество от источника питания, а гидроксид никеля и железа вызывает электролиз, разделяя воду на кислород и водород. Во время электролиза сульфид никеля превращается в отрицательно заряженный слой, который защищает анод. Так же, как отрицательные концы двух магнитов прижимаются друг к другу, отрицательно заряженный слой отталкивает хлорид и не дает ему достичь металла сердечника.
Во время электролиза сульфид никеля превращается в отрицательно заряженный слой, который защищает анод. Так же, как отрицательные концы двух магнитов прижимаются друг к другу, отрицательно заряженный слой отталкивает хлорид и не дает ему достичь металла сердечника.
По словам Майкла Кенни, аспиранта лаборатории Dai и соавтора статьи, без отрицательно заряженного покрытия анод работает в морской воде только около 12 часов. «Весь электрод разваливается в крошку», — сказал Кенни.«Но с этим слоем он может работать более тысячи часов».
В предыдущих исследованиях по разделению морской воды для получения водородного топлива использовались небольшие количества электрического тока, поскольку коррозия происходит при более высоких токах. Но Дай, Кенни и их коллеги смогли провести в 10 раз больше электричества через свое многослойное устройство, что помогает ему быстрее вырабатывать водород из морской воды.
«Я думаю, что мы установили рекорд по разделению морской воды на течении», — сказал Дай.
Члены команды провели большую часть своих тестов в контролируемых лабораторных условиях, где они могли регулировать количество электричества, поступающего в систему. Но они также разработали демонстрационную машину на солнечной энергии, которая производила газообразный водород и кислород из морской воды, собранной в заливе Сан-Франциско.
И без риска коррозии из-за солей, устройство соответствует современным технологиям, использующим очищенную воду. «Самое впечатляющее в этом исследовании заключалось в том, что мы смогли работать при таких же электрических токах, как те, которые используются в промышленности сегодня», — сказал Кенни.
На удивление просто
Оглядываясь назад, Дай и Кенни видят простоту их конструкции. «Если бы у нас был хрустальный шар три года назад, это было бы сделано за месяц», — сказал Дай. Но теперь, когда разработан базовый рецепт электролиза с морской водой, новый метод откроет двери для увеличения доступности водородного топлива, работающего на солнечной или ветровой энергии.
В будущем эту технологию можно будет использовать не только для производства энергии. Поскольку этот процесс также производит пригодный для дыхания кислород, водолазы или подводные лодки могут приносить устройства в океан и генерировать кислород внизу, не поднимаясь на поверхность для доступа к воздуху.
Что касается передачи технологии, «можно было бы просто использовать эти элементы в существующих системах электролизера, и это могло бы быть довольно быстро», — сказал Дай. «Это не похоже на начало с нуля — это больше похоже на начало с 80 или 90 процентов».
Среди других со-ведущих авторов — приглашенный ученый Юнь Куанг из Пекинского химико-технологического университета и Юнтао Мэн из Шаньдунского университета науки и технологий. Дополнительные авторы включают Вэй-Сюань Хунг, Иджин Лю, Цзянан Эрик Хуанг, Рохит Прасанна и Майкл МакГихи.
Эта работа финансировалась Министерством энергетики США, Национальным научным фондом, Национальным научным фондом Китая и Национальным проектом ключевых исследований и разработок Китая.
Чтобы читать все истории о Стэнфордской науке, подпишитесь на еженедельный Stanford Science Digest.
В поисках лучших способов получения водородного топлива из воды
С водородными электростанциями в Калифорнии, новым японским потребительским автомобилем и портативными водородными топливными элементами для электроники, водород в качестве источника топлива с нулевым уровнем выбросов теперь наконец становится реальностью для среднего потребителя.В сочетании с кислородом в присутствии катализатора водород выделяет энергию и связывается с кислородом с образованием воды.
Две основные трудности, мешающие нам иметь водородную энергию. Все, что у нас есть, — это хранение и производство. В настоящее время производство водорода энергоемкое и дорогое. Обычно промышленное производство водорода требует высоких температур, больших мощностей и огромного количества энергии. Фактически, он обычно поступает из ископаемого топлива, такого как природный газ, и поэтому на самом деле не является источником топлива с нулевым уровнем выбросов.Удешевление, эффективность и экологичность процесса будет иметь большое значение для превращения водорода в более широко используемое топливо.
Фактически, он обычно поступает из ископаемого топлива, такого как природный газ, и поэтому на самом деле не является источником топлива с нулевым уровнем выбросов.Удешевление, эффективность и экологичность процесса будет иметь большое значение для превращения водорода в более широко используемое топливо.
Отличным и обильным источником водорода является вода. Но химически это требует обращения вспять реакции, в которой водород выделяет энергию при соединении с другими химическими веществами. Это означает, что мы должны вложить энергию в соединение, чтобы получить водород. Максимальное повышение эффективности этого процесса было бы значительным прогрессом на пути к экологически чистой энергии в будущем.
Один из методов включает смешивание воды с полезным химическим веществом, катализатором, для уменьшения количества энергии, необходимой для разрыва связей между атомами водорода и кислорода.Есть несколько многообещающих катализаторов генерации водорода, в том числе сульфид молибдена, графен и сульфат кадмия. Мои исследования направлены на изменение молекулярных свойств сульфида молибдена, чтобы сделать реакцию еще более эффективной и действенной.
Производство водорода
Водород — самый распространенный элемент во Вселенной, но он редко доступен в виде чистого водорода. Скорее, он соединяется с другими элементами, образуя множество химических веществ и соединений, таких как органические растворители, такие как метанол, и белки в организме человека.Его чистая форма, H₂, может использоваться в качестве транспортабельного и эффективного топлива.
Есть несколько способов производства водорода для использования в качестве топлива. Электролиз использует электричество для разделения воды на водород и кислород. Паровая конверсия метана начинается с метана (четыре атома водорода, связанных с атомом углерода) и нагревает его, отделяя водород от углерода. Этот энергоемкий метод обычно используется в промышленности для производства водорода, который используется в таких вещах, как производство аммиака или очистка нефти.
Метод, на котором я остановился, — это фотокаталитическое расщепление воды. С помощью катализатора количество энергии, необходимое для «расщепления» воды на водород и кислород, может быть обеспечено другим богатым ресурсом — светом. Под воздействием света правильная смесь воды и катализатора производит кислород и водород. Это очень привлекательно для промышленности, поскольку позволяет нам использовать воду в качестве источника водорода вместо грязного ископаемого топлива.
Что такое катализаторы
Так же, как не каждые два человека начинают разговор, находясь в одном лифте, некоторые химические взаимодействия не происходят только потому, что эти два материала вводятся.Молекулы воды можно разделить на водород и кислород с добавлением энергии, но количество необходимой энергии будет больше, чем было бы произведено в результате реакции.
Иногда для работы нужна третья сторона. В химии это называется катализатором. С химической точки зрения катализатор снижает количество энергии, необходимое для реакции двух соединений. Некоторые катализаторы действуют только на свету. Эти соединения, как и диоксид титана, называются фотокатализаторами.
При добавлении фотокатализатора энергия, необходимая для расщепления воды, значительно падает, так что усилие дает выигрыш в энергии в конце процесса. Мы можем сделать расщепление еще более эффективным, добавив другое вещество в роли сокатализатора. Сокатализаторы при производстве водорода изменяют электронную структуру реакции, делая ее более эффективной при производстве водорода.
Пока нет коммерческих систем для производства водорода таким способом.Отчасти это из-за стоимости. Лучшие катализаторы и сокатализаторы, которые мы обнаружили, эффективны при химической реакции, но очень дороги. Например, первая многообещающая комбинация диоксида титана и платины была открыта в 1972 году. Платина, однако, является очень дорогим металлом (более 1000 долларов США за унцию). Даже рений, еще один полезный катализатор, стоит около 70 долларов за унцию. Подобные металлы настолько редки в земной коре, что это делает их непригодными для крупномасштабных применений, даже несмотря на то, что разрабатываются процессы для вторичной переработки этих материалов.
Подобные металлы настолько редки в земной коре, что это делает их непригодными для крупномасштабных применений, даже несмотря на то, что разрабатываются процессы для вторичной переработки этих материалов.
В поисках нового катализатора
К хорошему катализатору предъявляется множество требований, например, способность рециркулировать и выдерживать тепло и давление, связанные с реакцией. Но не менее важно то, насколько распространен этот материал, потому что самые распространенные катализаторы являются самыми дешевыми.
Свойства хорошего фотокатализатора. Питер БирлиОдним из новейших и перспективных материалов является сульфид молибдена MoS₂. Поскольку он состоит из элементов молибдена и серы, которые относительно распространены на Земле, он намного дешевле, чем более традиционные катализаторы, намного меньше доллара за унцию.Он также имеет правильные электронные свойства и другие атрибуты.
Стружка сульфида молибдена. Материаловед, CC BY-SA Одиночные слои сульфида молибдена (MoS₂) на стекле (SiO). Масштабная линейка составляет 10 микрометров (мкм). Питер БирлиДо конца 1990-х исследователи обнаружили, что сульфид молибдена не особенно эффективен при превращении воды в водород. Но это произошло потому, что исследователи использовали толстые куски минерала, по сути, в той форме, в которой он был добыт из земли.Однако сегодня мы можем использовать такие процессы, как химическое осаждение из паровой фазы или процессы на основе растворов, для создания гораздо более тонких кристаллов MoS₂ — даже до толщины одной молекулы — которые намного эффективнее извлекают водород из воды.
Сделать процесс еще лучше
Сульфид молибдена можно сделать еще более эффективным, изменив его физические и электрические свойства. Процесс, известный как «фазовый переход», делает больше вещества доступным для участия в реакции образования водорода.
Когда сульфид молибдена образует кристаллы, атомы и молекулы за пределами твердой массы готовы принимать или отдавать электроны воде при возбуждении светом для создания водорода.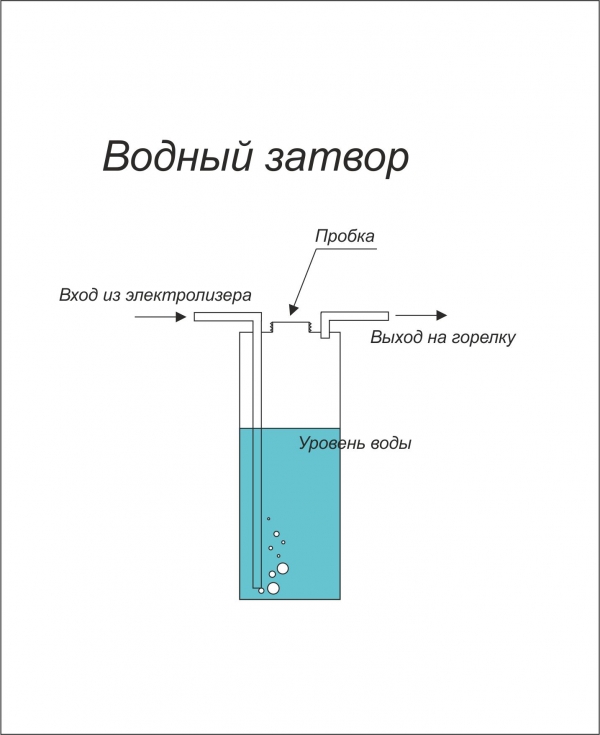 Обычно молекулы MoS₂ внутри структуры не отдают или принимают электроны так же эффективно, как краевые узлы, и поэтому не могут так сильно помочь в реакции.
Обычно молекулы MoS₂ внутри структуры не отдают или принимают электроны так же эффективно, как краевые узлы, и поэтому не могут так сильно помочь в реакции.
Но добавление энергии к MoS₂ путем бомбардировки его электронами или увеличения окружающего давления вызывает то, что называется «фазовым переходом».Это фазовое изменение — это не то, что вы изучаете в базовой химии (с участием одного вещества в форме газа, жидкости или твердого тела), а скорее небольшое структурное изменение в молекулярном расположении, которое превращает MoS₂ из полупроводника в металл.
В результате электрические свойства молекул внутри также становятся доступными для реакции. Это делает то же количество катализатора потенциально в 600 раз более эффективным в реакции выделения водорода.
Если методы, лежащие в основе такого прорыва, удастся усовершенствовать, то мы сможем сделать большой шаг ближе к тому, чтобы сделать производство водорода более дешевым и эффективным, что, в свою очередь, продвинет нас к будущему, основанному на действительно чистой возобновляемой энергии.
Производство и доставка водорода | Водород и топливные элементы | Водородные и топливные элементы
Исследователи из NREL разрабатывают передовые процессы для экономичного производства водорода. из устойчивых ресурсов.
Узнайте, как NREL развивает и продвигает ряд путей к возобновляемому водороду производство.Текстовая версия
Биологическое расщепление воды
Некоторые фотосинтетические микробы используют световую энергию для производства водорода из воды в виде
часть их метаболических процессов. Поскольку кислород образуется вместе с водородом,
фотобиологическая технология производства водорода должна преодолевать присущую ему чувствительность к кислороду
ферментативных систем, выделяющих водород. Исследователи NREL решают эту проблему с помощью
скрининг на естественные организмы, которые более устойчивы к кислороду и
создание новых генетических форм организмов, способных поддерживать производство водорода в
наличие кислорода.Исследователи также разрабатывают новую систему, в которой используется метаболический
переключение (лишение серы) на цикл клеток водорослей между фотосинтетическим ростом
фаза и фаза производства водорода.
Исследователи NREL решают эту проблему с помощью
скрининг на естественные организмы, которые более устойчивы к кислороду и
создание новых генетических форм организмов, способных поддерживать производство водорода в
наличие кислорода.Исследователи также разрабатывают новую систему, в которой используется метаболический
переключение (лишение серы) на цикл клеток водорослей между фотосинтетическим ростом
фаза и фаза производства водорода.
Контактное лицо: Мария Гирарди
Ферментация
Ученые NREL разрабатывают технологии предварительной обработки для преобразования лигноцеллюлозного биомасса в сырье, богатое сахаром, которое может быть непосредственно ферментировано для получения водорода, этанол и ценные химикаты.Исследователи также работают над определением консорциума. Clostridium, которые могут непосредственно сбраживать гемицеллюлозу до водорода. Другие исследования области включают в себя биоразведку эффективных целлюлолитических микробов, таких как Clostridium thermocellum, который может сбраживать кристаллическую целлюлозу непосредственно до водорода, чтобы снизить затраты на сырье. После идентификации модельной целлюлолитической бактерии ее потенциал для генетических манипуляций, включая чувствительность к антибиотикам и простоту генетического трансформация, будет определена.Будущие проекты ферментации NREL будут сосредоточены на по разработке стратегий для создания мутантов, которые селективно блокируются от производства отработанные кислоты и растворители для максимального увеличения выхода водорода.
Контактное лицо: Пин-Чинг Манесс
Конверсия биомассы и отходов
Водород можно производить путем пиролиза или газификации ресурсов биомассы, таких как
сельскохозяйственные остатки, такие как скорлупа арахиса; бытовые отходы, включая пластмассы и отходы
смазка; или биомасса, специально выращенная для использования в энергии. Пиролиз биомассы производит
жидкий продукт (био-масло), содержащий широкий спектр компонентов, которые могут быть
разделены на ценные химические вещества и топливо, включая водород. Исследователи NREL
в настоящее время сосредоточены на производстве водорода путем каталитического риформинга пиролиза биомассы
товары. Конкретные области исследований включают реформирование потоков пиролиза и разработку
и испытание псевдоожижаемых катализаторов.
Пиролиз биомассы производит
жидкий продукт (био-масло), содержащий широкий спектр компонентов, которые могут быть
разделены на ценные химические вещества и топливо, включая водород. Исследователи NREL
в настоящее время сосредоточены на производстве водорода путем каталитического риформинга пиролиза биомассы
товары. Конкретные области исследований включают реформирование потоков пиролиза и разработку
и испытание псевдоожижаемых катализаторов.
Контактное лицо: Ричард Френч
Фотоэлектрохимическое расщепление воды
Самый чистый способ получения водорода — использование солнечного света для прямого разделения воды. в водород и кислород.Технология многопереходных ячеек, разработанная фотоэлектрическими промышленность используется для фотоэлектрохимических (PEC) систем сбора света, которые генерируют достаточное напряжение для разделения воды и стабильны в среде вода / электролит. Разработанная NREL система PEC производит водород из солнечного света без дополнительных затрат. и усложнение электролизеров, при КПД преобразования солнечной энергии в водород На 12,4% ниже теплотворная способность при использовании отраженного света.Ведутся исследования, чтобы выявить больше эффективные, недорогие материалы и системы, долговечные и устойчивые к коррозии в водной среде.
Контактное лицо: Джон Тернер или Тодд Дойч
Гелиотермальное водоразделение
Исследователи NREL используют реактор High-Flux Solar Furnace, чтобы концентрировать солнечную энергию и генерировать температуры от 1000 до 2000. градусов Цельсия.Для термохимической реакции требуются сверхвысокие температуры.
циклы для производства водорода. Такой высокотемпературный, высокопоточный, термохимический
процессы предлагают новый подход к экологически безопасному производству водорода.
Очень высокие скорости реакции при таких повышенных температурах вызывают очень быструю реакцию.
скорости, которые значительно увеличивают производительность и более чем компенсируют
прерывистый характер солнечного ресурса.
градусов Цельсия.Для термохимической реакции требуются сверхвысокие температуры.
циклы для производства водорода. Такой высокотемпературный, высокопоточный, термохимический
процессы предлагают новый подход к экологически безопасному производству водорода.
Очень высокие скорости реакции при таких повышенных температурах вызывают очень быструю реакцию.
скорости, которые значительно увеличивают производительность и более чем компенсируют
прерывистый характер солнечного ресурса.
Контактное лицо: Джуди Неттер
Возобновляемый электролиз
Возобновляемые источники энергии, такие как фотоэлектрическая энергия, ветер, биомасса, гидро- и геотермальная энергия. может обеспечить нашу страну чистой и устойчивой электроэнергией. Однако возобновляемая энергия источники естественным образом изменчивы, требуют накопления энергии или гибридной системы для размещения суточные и сезонные изменения.Одно из решений — производить водород путем электролиза — расщепления с помощью электрического тока — воды и использовать этот водород в топливном элементе для производства электричество в периоды низкого производства электроэнергии или пикового спроса, или для использования водорода в транспортных средствах на топливных элементах.
Исследователи из Центра интеграции энергетических систем NREL и Центра испытаний и исследований водородной инфраструктуры изучают вопросы, связанные с использованием возобновляемых источников энергии для производства
водород путем электролиза воды.NREL тестирует интегрированные системы электролиза
и исследует варианты дизайна для снижения капитальных затрат и повышения производительности.
Узнайте больше об исследованиях электролиза возобновляемых источников энергии NREL.
Контактное лицо: Кевин Харрисон
Надежность шланга дозатора водорода
С акцентом на снижение затрат и повышение надежности и безопасности, NREL выполняет ускоренные испытания и циклическое использование шлангов для подачи водорода на 700 бар на предприятии по интеграции энергетических систем с использованием автоматизированной робототехники для моделирования полевых условий.Посмотрите видео с роботом, который имитирует повторяющееся напряжение человека, сгибающегося и скручивающегося. шланг для подачи водорода в бортовой накопительный бак транспортного средства на топливных элементах. Исследователи проводить механические, термические испытания и испытания под давлением для новых и бывших в употреблении систем подачи водорода шланги. Материал шланга анализируется для выявления проникновения водорода, охрупчивания, и зарождение / распространение трещины.
Контактное лицо: Кевин Харрисон
Анализ путей производства и доставки водорода
NREL выполняет анализ на системном уровне в различных областях устойчивого производства водорода.
и пути доставки.Эти усилия сосредоточены на определении улучшений статуса, в результате
от технологических достижений, стоимости как функции объема производства и потенциала
для снижения затрат. Результаты помогают выявить препятствия на пути к успеху этих путей.
основные факторы затрат и остающиеся проблемы НИОКР. Разработанные NREL тематические исследования по анализу водорода обеспечивают прозрачные прогнозы текущих и будущих затрат на производство водорода. Узнайте больше о работе NREL по системному анализу.
Узнайте больше о работе NREL по системному анализу.
Контактное лицо: Женевьева Заур
Сеть энергетических материалов HydroGEN
NREL служит ведущей лабораторией консорциума HydroGEN Energy Materials Network (EMN).
Последние публикации
Прямое преобразование солнечной энергии в водород с помощью инвертированного метаморфического многопереходного полупроводника Архитектура, Энергия природы (2017)
Замечательная стабильность немодифицированных фотокатодов GaAs при выделении водорода в Кислый электролит, Журнал химии материалов A (2016)
Эффективность преобразования солнечной энергии в водород: яркий свет на производительность фотоэлектрохимических устройств, Энергетика и экология (2016)
Обратимая пассивация поверхности GaInP2 за счет адсорбции воды: модельная система для зависимости от окружающей среды Фотолюминесценция, Журнал физической химии C (2016)
CO2-фиксирующий метаболизм одного углерода в разрушающей целлюлозу бактерии Clostridium thermocellum, Proceedings of the National Academy of Sciences (2016)
Путь фосфокетолазы способствует метаболизму углерода у цианобактерий, Природные растения (2016)
Контакт
Huyen Dinh
Электронная почта
303-275-3605
Новая технология разделения воды для получения чистого водорода
Фотография исследователей, на которой изображены (слева направо): Dr.Производство электролитического водорода влечет за собой производство водорода из воды с использованием электроэнергии, которая в идеале должна поступать из возобновляемых источников энергии, таких как солнечный свет и ветер. Хотя этот метод производства водорода может быть очень многообещающим решением для повышения устойчивости, исследователям придется преодолеть несколько ключевых проблем, чтобы он получил широкое распространение.
В недавнем исследовании, опубликованном в Nature Energy , группа исследователей из Израильского технологического института Техниона рассмотрела некоторые из этих проблем, представив новую технику расщепления воды, которая может улучшить существующие методы электролитического производства водорода. Их исследование черпает вдохновение из одного из их предыдущих исследований фотоэлектрохимического (PEC) расщепления воды, в котором они пытались объединить солнечную энергию и электролиз воды (фото) для получения водорода из солнечного света и воды.
Одной из самых серьезных проблем, описанных в этой предыдущей работе, был сбор газообразного водорода из миллионов ячеек PEC, распределенных в солнечной области. В своем исследовании исследователи из Техниона попытались разработать метод, который мог бы эффективно решить эту проблему.
«Принимая фотоэлектрические (PV) солнечные электростанции в качестве базового сценария, солнечная ферма состоит из миллионов отдельных фотоэлементов, где ток (и напряжение) собираются от каждого из них в металлическую сеть», — сказал Авнер Ротшильд. , один из исследователей, проводивших исследование, сообщил TechXplore.«Это легко с электричеством, но не с водородом».
В идеальной солнечной установке PEC будущего фотоэлементы будут заменены на элементы PEC, которые могут производить водород в компоненте, известном как катодный отсек, и кислород в отдельной камере, называемой анодным отсеком.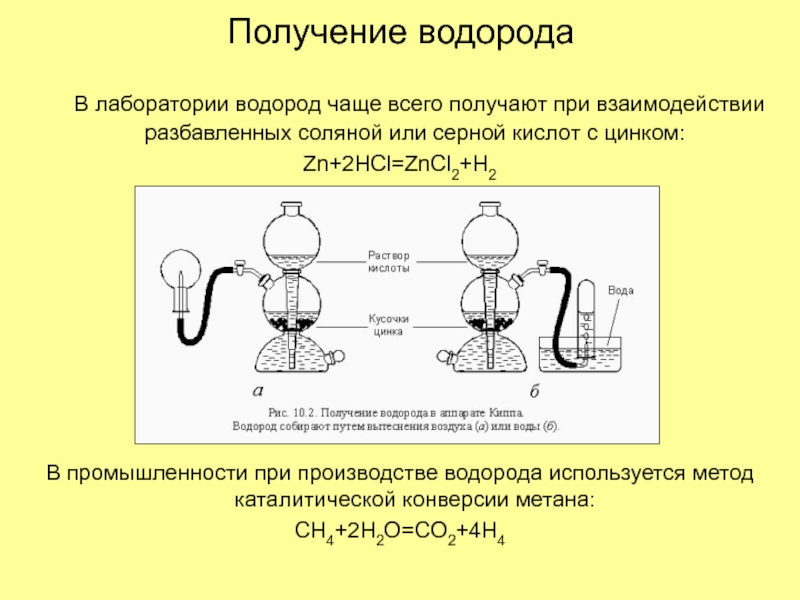 Эти два отсека должны быть разделены, по крайней мере, мембраной, чтобы гарантировать, что водород и кислород не смешиваются, поскольку это может вызвать взрыв. Кроме того, газообразный водород необходимо собирать из каждой отдельной ячейки.
Эти два отсека должны быть разделены, по крайней мере, мембраной, чтобы гарантировать, что водород и кислород не смешиваются, поскольку это может вызвать взрыв. Кроме того, газообразный водород необходимо собирать из каждой отдельной ячейки.
Создание такой установки до сих пор оказалось технически сложным и дорогостоящим, так как для этого требовался очень дорогостоящий трубопроводный коллектор. В конечном итоге это сделало нереальной реализацию решений для крупномасштабного производства водорода путем разделения воды PEC.
«Мы искали выход из этой проблемы и пришли к идее разделения кислородного и водородного отсеков в ячейке PEC на две отдельные ячейки, чтобы кислород генерировался в солнечном поле и выбрасывался в атмосферу. в то время как водород генерируется в центральном реакторе на углу поля », — сказал Ротшильд.«Разделение на две ячейки стало возможным благодаря установке еще одного набора из двух электродов, называемых вспомогательными электродами, которые заряжаются и разряжаются одновременно ионами OH —, участвующими в реакции расщепления воды, тем самым опосредуя ионный обмен между двумя ячеек (что необходимо для замыкания электрической цепи) ».
В своей предыдущей статье, опубликованной в Nature Materials , Ротшильд и его коллеги представили революционный новый подход к архитектуре электролиза воды (электролизеры) и фотоэлектролиза (PEC).Однако этот многообещающий подход поставил еще одну проблему — регенерацию вспомогательных электродов, когда они насыщаются в конце производственного цикла. Исследователи предположили, что электроды можно менять местами в конце каждого цикла, но это было бы довольно громоздко, поэтому они продолжили поиск альтернативных решений.
«Затем мы обнаружили, что при нагревании вспомогательного электрода в водородной ячейке после того, как он был заряжен (чтобы стать NiOOH), он самопроизвольно выделяет пузырьки газообразного кислорода и восстанавливается до своего исходного состояния (Ni (OH) 2 )», — сказал Ротшильд. «Это открытие привело к развитию процесса расщепления воды E-TAC, который представлен в настоящей работе».
«Это открытие привело к развитию процесса расщепления воды E-TAC, который представлен в настоящей работе».
E-TAC, новый метод разделения воды, предложенный Ротшильдом и его коллегами, имеет высокую энергоэффективность 98,7 процента, следовательно, он значительно превосходит обычные электролизеры, которые обычно имеют энергоэффективность от ~ 70 до 80 процентов в рабочем состоянии. ультрасовременные устройства. Еще одним преимуществом E-TAC является то, что он производит водород и кислород последовательно, тогда как в большинстве других электролизеров они производятся одновременно.Это в конечном итоге устраняет необходимость в мембране, разделяющей газы водорода и кислорода, что значительно упрощает конструкцию и сборку ячеек, а также их эксплуатацию и техническое обслуживание.
«Потенциально это может привести к значительной экономии капитальных и эксплуатационных затрат, что приведет к разработке рентабельной технологии разделения воды, которая может конкурировать с SMR (паровой риформинг метана), предлагая дешевый водород без выбросов CO 2 , при условии, что электроэнергия поступает из возобновляемых источников, таких как гидроэнергия, солнечная или ветровая энергия », — сказал Ротшильд.
При обычном электролизе воды водород и кислород всегда одновременно производятся в катодном и анодном отсеках соответственно. Отделения расположены как можно ближе друг к другу, чтобы минимизировать электрические омические потери, и они разделены мембраной, чтобы избежать образования взрывоопасной смеси H 2 / O 2 .
«Катод восстанавливает воду, генерируя водород (H 2 молекул) и гидроксид-ионы (OH — ) посредством реакции, известной как HER (реакция выделения водорода)», — сказал Ротшильд.«Ионы OH — мигрируют к аноду через электролит и через мембрану, где они окисляются посредством OER (реакция выделения кислорода). Вместе эти две реакции (HER и OER) завершают реакцию расщепления воды: 2H 2 O 2H 2 + O 2 .![]() »
»
В обычном электролизе воды две электрохимические реакции, описанные Ротшильдом, связаны как во времени, так и в пространстве, поскольку они происходят одновременно, в одной и той же ячейке и в непосредственной близости.Более того, эти характеристики одинаковы независимо от того, применяется ли процесс к щелочным электролизерам или электролизерам с ПЭМ.
Изображение, показывающее разницу между традиционным подходом к расщеплению воды (щелочной электролиз) и техникой расщепления воды E-TAC, предложенной исследователями. Предоставлено: Дотан и др.В отличие от этого традиционного подхода к электролизу воды, процесс разделения воды, разработанный исследователями, разделяет реакции HER и OER, которые вместо этого происходят в разное время и потенциально в разных частях устройства.Поэтому E-TAC может быть описан не как непрерывный процесс, а как «периодический процесс» с двумя циклами, первый из которых генерирует водород электрохимически, а второй кислород — посредством спонтанной химической реакции.
«Мы помещаем катод (тот же катод, который используется в щелочном электролизе) и анод (который отличается от анода при обычном электролизе) в электролитической ячейке и пропускаем ток между ними», — сказал Ротшильд. «Катод генерирует водород в результате реакции HER, как и в случае обычного электролиза воды, но анод делает совершенно другое.Анод по существу заряжается за счет поглощения ионов OH — , которые генерируются на катоде, и постепенно превращаются из Ni (OH) 2 (гидроксид никеля) в NiOOH (оксигидроксид никеля) »
.Интересно, что реакция, производимая на аноде, аналогична реакции, которая происходит на катоде щелочных батарей (например, никель-металлгидридных батарей) во время их зарядки. Это говорит о том, что он может хорошо работать в течение многих циклов, как и в щелочных батареях.
Однако иногда заряд анода в процессе E-TAC необходимо прервать, потому что, если он перезарядится, он может начать генерировать кислород.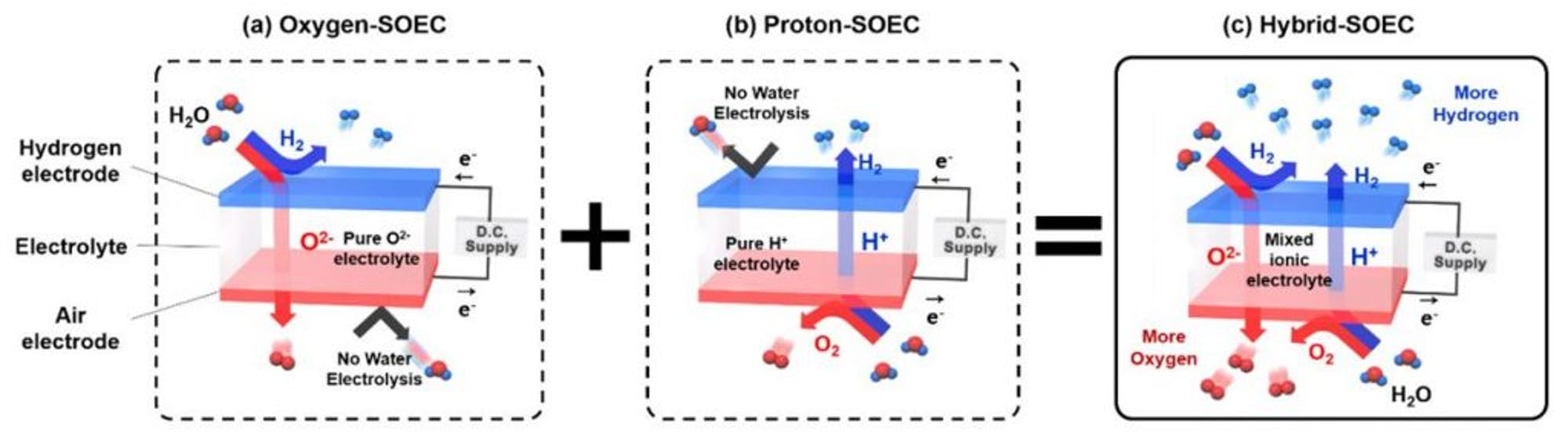 Поэтому, когда заряд превышает определенный уровень, исследователям необходимо ограничить напряжение, прикладываемое к ячейкам, чтобы избежать возможных взрывов, возникающих в результате совместного производства кислорода и водорода.
Поэтому, когда заряд превышает определенный уровень, исследователям необходимо ограничить напряжение, прикладываемое к ячейкам, чтобы избежать возможных взрывов, возникающих в результате совместного производства кислорода и водорода.
«Чтобы продолжить процесс E-TAC, нам необходимо регенерировать заряженный анод (NiOOH) обратно в его исходное состояние (Ni (OH) 2 )», — пояснил Ротшильд. «Мы делаем это, повышая его температуру, тем самым ускоряя скорость спонтанной химической реакции между заряженным анодом и водой, которая высвобождает кислород и восстанавливает анод обратно в исходное состояние.«
Таким образом, метод, разработанный Ротшильдом и его коллегами, предполагает использование тепла для управления химической реакцией, в результате которой образуется кислород, поскольку скорость реакции замедляется при низких температурах и ускоряется при высоких температурах. Генерация водорода происходит при низкой температуре или температуре окружающей среды, а образование кислорода — при высоких температурах около 95 градусов Цельсия. Вот почему исследователи решили назвать это процессом E-TAC, что означает электрохимически-термически активированный химический процесс.
«В лабораторных испытаниях, представленных в нашей статье, мы вручную переместили анод из холодной ячейки (т. Е. Стеклянного стакана, наполненного щелочным водным раствором при температуре окружающей среды) в горячую камеру (т. Е. Стакан того же типа. , но нагретый до 95 градусов Цельсия), поэтому разделение между производством водорода и кислорода было не только по времени, но и по месту », — пояснил Ротшильд. «Однако в реальной промышленной системе мы предвидим другой сценарий, в котором два электрода (анод и катод) и неподвижны (неподвижны), тогда как ячейка, в которой они находятся, последовательно заполняется холодными или горячими растворами электролита.«
Разделение производства водорода и кислорода, которое устраняет необходимость в мембране, разделяющей две разные камеры внутри электролитических ячеек, приводит к значительной экономии по сравнению с традиционными подходами к электролизу.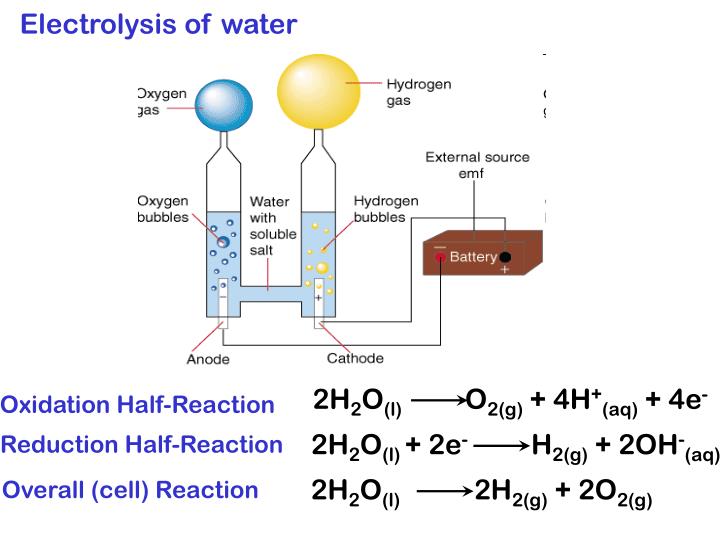 Фактически, герметизация мембраны обычно является дорогостоящей, а также усложняет весь производственный процесс. Мембрана в обычных системах требует воды высокой чистоты и постоянного обслуживания, и все это не требуется в E-TAC.
Фактически, герметизация мембраны обычно является дорогостоящей, а также усложняет весь производственный процесс. Мембрана в обычных системах требует воды высокой чистоты и постоянного обслуживания, и все это не требуется в E-TAC.
Кроме того, методика, разработанная Ротшильдом и его коллегами, полностью исключает риск летучих столкновений кислорода и водорода, а также связанных с этим взрывов.С другой стороны, в традиционных системах этот риск все еще присутствует, поскольку мембрана может порваться или ее уплотнение может сломаться.
«В настоящее время использование мембран также ограничивает давление при производстве водорода», — сказал Ротшильд. «E-TAC делает мембрану ненужной, тем самым облегчая производство водорода при гораздо более высоком давлении и устраняя некоторые из высоких затрат на последующее сжатие водорода. Более того, в новом процессе, который мы предложили, кислород образуется в результате спонтанной химической реакции между заряженными анод и воду без использования электрического тока.Эта реакция устраняет необходимость в электричестве во время производства кислорода и увеличивает энергетический КПД с ~ 70 до 80 процентов при использовании обычных методов до беспрецедентных 98,7 процента ».
Метод, разработанный Ротшильдом и его коллегами, может снизить эксплуатационные расходы на устойчивое производство водорода и стоимость оборудования. Исследователи подсчитали, что производственные затраты на оборудование на основе E-TAC будут примерно вдвое меньше, чем на существующие технологии.
«Процесс, который мы изобрели, представляет собой концептуальный прорыв в разделении воды, и с учетом преимуществ, которые он предлагает, он может изменить правила игры и привести к новой технологии производства водорода из воды без выбросов CO 2 , что может конкурировать с SMR за производство чистого водорода и обеспечить переход от ископаемого топлива к чистому водородному топливу », — сказал Ротшильд.
После того, как они закончили писать свою статью, исследователи из Техниона запатентовали свое изобретение и основали стартап под названием H 2 Pro с миссией разработки и распространения новой технологии разделения воды на основе техники E-TAC. Они надеются вскоре коммерциализировать эту технологию путем увеличения размеров электродов и ячеек, используемых в их исследовании, создания и тестирования генераторов водорода на основе процесса разделения воды E-TAC, оптимизации своей схемы работы и изучения производства водорода под высоким давлением.
Они надеются вскоре коммерциализировать эту технологию путем увеличения размеров электродов и ячеек, используемых в их исследовании, создания и тестирования генераторов водорода на основе процесса разделения воды E-TAC, оптимизации своей схемы работы и изучения производства водорода под высоким давлением.
«Мы также планируем проводить дальнейшие академические исследования для изучения новых электродных материалов и применять передовые аналитические методы, чтобы понять корреляцию между электродным составом и микроструктурой и его функциональными свойствами, чтобы разработать следующее поколение Ni (OH) 2 — электроды для нашего процесса водоразделения E-TAC », — сказал Ротшильд. «Наша цель — повысить их производительность (чтобы мы могли запускать более длительные процессы) за счет быстрой зарядки и регенерации, чтобы обеспечить высокую скорость производства водорода.»
Исследователи совершили прорыв в производстве водородного топлива.
Дополнительная информация: Разделение выделения водорода и кислорода с помощью двухступенчатого электрохимико-химического цикла для эффективного общего расщепления воды. Nature Energy , DOI: 10.1038 / s41560-019-0462-7
Avigail Landman et al. Фотоэлектрохимическое расщепление воды на отдельные ячейки кислорода и водорода, Nature Materials (2017). DOI: 10.1038 / nmat4876
© 2019 Сеть Science X
Ссылка :
Новая технология расщепления воды для получения чистого водорода (2 октября 2019 г. )
получено 16 марта 2021 г.
из https: // techxplore.ru / news / 2019-09-water-splitting-Technologie-Hydrogen.html
)
получено 16 марта 2021 г.
из https: // techxplore.ru / news / 2019-09-water-splitting-Technologie-Hydrogen.html
Этот документ защищен авторским правом. За исключением честных сделок с целью частного изучения или исследования, никакие часть может быть воспроизведена без письменного разрешения. Контент предоставляется только в информационных целях.
Метод получения кислорода из воды в условиях невесомости вселяет надежду на дальние космические путешествия
Следующее эссе перепечатано с разрешения The Conversation, онлайн-публикации, посвященной последним исследованиям.
Космические агентства и частные компании уже разработали планы по отправке людей на Марс в ближайшие несколько лет — окончательной его колонизации. А с ростом числа открытий планет, похожих на Землю, вокруг ближайших звезд, дальние космические путешествия никогда не казались более захватывающими.
Однако людям нелегко выжить в космосе в течение длительного периода времени. Одна из основных проблем, связанных с космическими полетами на большие расстояния, — это транспортировка достаточного количества кислорода, чтобы астронавты могли дышать, и достаточного количества топлива для питания сложной электроники.К сожалению, в космосе очень мало кислорода, а большие расстояния затрудняют быстрое пополнение запасов.
Но теперь новое исследование, опубликованное в Nature Communications, показывает, что можно производить водород (для топлива) и кислород (для жизни) только из воды, используя полупроводниковый материал и солнечный свет (или звездный свет) в условиях невесомости, что обеспечивает устойчивую космические путешествия реальная возможность.
Использование неограниченного ресурса солнца для питания нашей повседневной жизни — одна из самых больших проблем на Земле.Поскольку мы постепенно уходим от нефти к возобновляемым источникам энергии, исследователей интересует возможность использования водорода в качестве топлива. Лучший способ сделать это — расщепить воду (h3O) на составляющие: водород и кислород. Это возможно с помощью процесса, известного как электролиз, который включает пропускание тока через образец воды, содержащий некоторое количество растворимого электролита. Это расщепляет воду на кислород и водород, которые отдельно выделяются двумя электродами.
Хотя этот метод технически возможен, он еще не стал легкодоступным на Земле, поскольку нам нужно больше инфраструктуры, связанной с водородом, такой как станции заправки водорода, чтобы масштабировать его.
Солнечная энергия
Водород и кислород, полученные таким образом из воды, также можно использовать в качестве топлива на космических кораблях. На самом деле запуск ракеты с водой был бы намного безопаснее, чем запуск ее с дополнительным ракетным топливом и кислородом на борту, который может быть взрывоопасным. Оказавшись в космосе, специальная технология могла бы разделить воду на водород и кислород, которые, в свою очередь, можно было бы использовать для поддержания жизни или для питания электроники через топливные элементы.
Для этого есть два варианта. Один из них включает в себя электролиз, как мы делаем на Земле, с использованием электролитов и солнечных элементов для улавливания солнечного света и преобразования его в ток.
Альтернативой является использование «фотокатализаторов», которые работают за счет поглощения световых частиц — фотонов — полупроводниковым материалом, помещенным в воду. Энергия фотона поглощается электроном в материале, который затем подпрыгивает, оставляя дыру. Свободный электрон может реагировать с протонами (которые вместе с нейтронами составляют атомное ядро) в воде с образованием водорода. Между тем дыра может поглощать электроны из воды с образованием протонов и кислорода.
Между тем дыра может поглощать электроны из воды с образованием протонов и кислорода.
Процесс также можно обратить. Водород и кислород можно собрать вместе или «рекомбинировать» с помощью топливного элемента, возвращающего солнечную энергию, полученную в результате «фотокатализа» — энергию, которая может использоваться для питания электроники. В результате рекомбинации в качестве продукта образуется только вода, то есть вода также может быть переработана. Это ключ к дальним космическим путешествиям.
Процесс с использованием фотокатализаторов — лучший вариант для космических путешествий, поскольку оборудование весит намного меньше, чем необходимое для электролиза.По идее должно работать легко. Отчасти это связано с тем, что интенсивность солнечного света намного выше, поскольку атмосфера Земли не поглощает большие количества на своем пути к поверхности.
Управление пузырьками
В новом исследовании исследователи сбросили всю экспериментальную установку для фотокатализа на 120-метровую башню, создав среду, похожую на микрогравитацию. По мере того как объекты ускоряются по направлению к Земле в свободном падении, влияние гравитации уменьшается, поскольку силы, действующие под действием гравитации, компенсируются равными и противоположными силами из-за ускорения.Это противоположно силам G, которые испытывают космонавты и летчики-истребители, когда они ускоряются в своих самолетах.
Исследователям удалось показать, что разделение воды в этой среде действительно возможно. Однако, когда вода расщепляется, образуя газ, образуются пузырьки. Важно избавиться от пузырьков из однажды образовавшегося материала катализатора — пузырьки препятствуют процессу образования газа. На Земле гравитация заставляет пузыри автоматически всплывать на поверхность (вода у поверхности более плотная, чем пузыри, что делает их буйонантными), освобождая пространство на катализаторе для образования следующего пузыря.
В условиях невесомости это невозможно, и пузырек останется на катализаторе или рядом с ним.
