- Солнечные батареи для дома и дачи: как правильно выбрать и установить
- Что такое солнечная батарея
- Принцип работы солнечных батарей
- Области применения
- Преимущества и нюансы солнечных батарей
- Виды солнечных батарей
- Комплектация и общие характеристики
- Как правильно выбрать автономную систему
- Краткий обзор производителей
- Установка солнечных панелей
- Выгодно ли использовать солнечные батареи на даче
- Отопление от солнечных батарей в России
- Солнечные батареи: ставить или нет
- Гигантская батарея Tesla заработала в Австралии
- Резервное питание дома от аккумулятора — есть ли жизнь после отключения от электричества?
- Батарея (электричество) — Энциклопедия Нового Света
- Батарея (электричество) — Энциклопедия Нового Света
- Батарея (электричество) — Энциклопедия Нового Света
Солнечные батареи для дома и дачи: как правильно выбрать и установить
Что такое солнечная батарея
Солнечная батарея представляет собой устройство, которое собирает световую энергию солнечных лучей и преобразует её в электрический ток. В её основе используются фотоэлементы – полупроводниковые фотоэлектрические преобразователи.
Принцип работы солнечных батарей
Солнечный свет, попадая на кремниевые пластины, высвобождает электроны, которые начинают двигаться по проводникам. Инвертор преобразует постоянный ток в переменный для питания стандартных бытовых приборов.
Области применения
С каждым годом сфера применения солнечных батарей становится всё шире. Устройства активно используются в сельском хозяйстве, промышленности, военно-космической области, медицине, дорожном строительстве, автомобилестроении, авиации и быту.
Вырабатываемая электроэнергия используется для:
- Освещения жилых и нежилых объектов, улиц, придомовых территорий.

- Обеспечения энергией медицинского и телекоммуникационного оборудования.
- Накопления энергии и подзарядки портативных устройств и микроэлектроники.
- Энергообеспечения зданий.
Преимущества и нюансы солнечных батарей
Преимущества:
- Бесшумная работа.
- Отсутствие выбросов парниковых газов и образования отходов.
- Неисчерпаемый запас энергии.
- Минимальные затраты при эксплуатации.
- Отсутствие технического обслуживания.
- Длительный срок службы без ухудшения эксплуатационных характеристик.
Нюансы:
- Зависимость от погоды.
- Относительно высокая цена.
- Необходимость специальных навыков при монтаже.
Виды солнечных батарей
Солнечные батареи для дома или дачи можно разделить на три большие группы: кремниевые, плёночные и аморфные.
Батареи, которые относятся к последним двум группам, не выгодны для использования в частном доме.
К кремниевым батареям относятся монокристаллические и поликристаллические системы, которые являются наиболее популярными.
Монокристаллические
Более эффективные, но при этом более дорогие. Кремниевые пластины по форме напоминают квадрат со срезанными углами. Благодаря однородной поверхности достигается высокий КПД – до 20%, но только при прямых лучах солнца. Они хуже воспринимают рассеянный и боковой свет.
Поликристаллические
Производительность панелей составляет 11-16%.
- Имеют более низкую стоимость.
- Большой выбор производителей.
- Подходят для рассеянного света и имеют более широкий угол восприятия солнечных лучей.
Комплектация и общие характеристики
В базовую комплектацию автономной солнечной электростанции входит:
- Солнечная батарея.
 Преобразует солнечный свет в электричество.
Преобразует солнечный свет в электричество. - Контроллер. Оптимизирует работу батареи и повышает эффективность выработки электроэнергии.
- Инвертор. Преобразует постоянный ток в переменный.
- Аккумулятор. Сохраняет полученную электроэнергию.
- Суточное потребление подключаемых электроприборов.

- Место установки солнечных панелей (ориентация на юг, оптимальный угол наклона, отсутствие тени на панелях).
- Место установки АКБ (должны находиться в помещении при плюсовой температуре, но не выше 25 градусов).
- Пиковые нагрузки электроприборов (насосы, холодильник).
- Круглогодичная или только летняя эксплуатация системы.
- TopRaySolar (Китай) выпускает панели из монокристаллического кремния мощностью 20-300 Вт и поликристаллические кремниевые батареи мощностью 20-300 Вт.

- Axitec (Германия) разрабатывает фотоэлементы на основе монокристаллического и поликристаллического кремния мощностью от 260 до 330 Вт.
- Hevel (Россия) – производитель микроморфных панелей, а также гетероструктурных с высоким КПД (22%).
- Срок окупаемости в среднем составляет 5-10 лет в зависимости от тарифа на электричество.
- Максимальную эффективность данная установка принесёт тем владельцам дачных участков, которые проживают в широтах с преобладающим большинством солнечных дней.
- В зимнее время в средней полосе России количество солнечных дней сильно уменьшается и на все нужды вырабатываемой энергии не хватит.
| Показатель | Монокристаллические солнечные батареи | Поликристаллические солнечные батареи |
|---|---|---|
| Кристаллическая структура | Зёрна кристалла параллельны. Кристаллы ориентированы в одну сторону. | Зёрна кристалла не параллельны. Кристаллы ориентированы в разные стороны. |
| Температура производства | 1400°С | 800-1000°С |
| Цвет | Чёрный | Синий |
| Стабильность | Высокая | Высокая, но меньше, чем у моно |
| Цена | Высокая | Высокая, но меньше, чем у моно |
Как правильно выбрать автономную систему
Перед покупкой солнечной электростанции учитывайте следующие параметры:
Монокристаллические чаще используются в регионах с высокой солнечной активностью, поликристаллические – с низкой активностью солнца. Если вам нужна солнечная батарея для дачи – обратите внимание на микроморфные модели. Они недорогие, но имеют в 2 раза большую площадь. Системы из микроморфного кремния могут эффективно работать под широким углом и в пасмурную погоду. Для больших станций, которые устанавливаются на крышах предприятий и на земле, лучше использовать гетероструктурные модули (КПД 22%) российского производителя «Хевел» (Hevel).
Краткий обзор производителей
Установка солнечных панелей
Монтаж системы требует специальных навыков. Самостоятельная установка не рекомендуется, поскольку при малейшей ошибке в расчётах вы рискуете обесточить дом. В случае неудачи стоимость ремонта может превысить цену за монтажные услуги.
Чаще всего цена монтажа рассчитывается от стоимости системы в размере 10-15%. Высоких цен пугаться не стоит. компании, которые устанавливают данное оборудование, за эту сумму предоставляют гарантию (что всё будет подключено и установлено правильно) как минимум на 1 год.
Заказывая профессиональную установку, вы избавитесь от проблем. Специалисты рассчитают необходимое количество панелей, помогут определиться с типом батарей, правильно определят оптимальное место установки, угол наклона и другие параметры.
Монтаж стандарной установки до 5 кВт выполняется в течение одного дня.
Выгодно ли использовать солнечные батареи на даче
Устанавливая солнечные батареи на своём загородном участке, владелец дома предполагает, что сразу же начнёт экономить на освещении. Это правда, но только при установке СЕТЕВОЙ солнечной электростанции без использования аккумуляторов.
Отопление от солнечных батарей в России
Считается, что установка солнечных батарей является отличной инвестицией в дом и в будущее.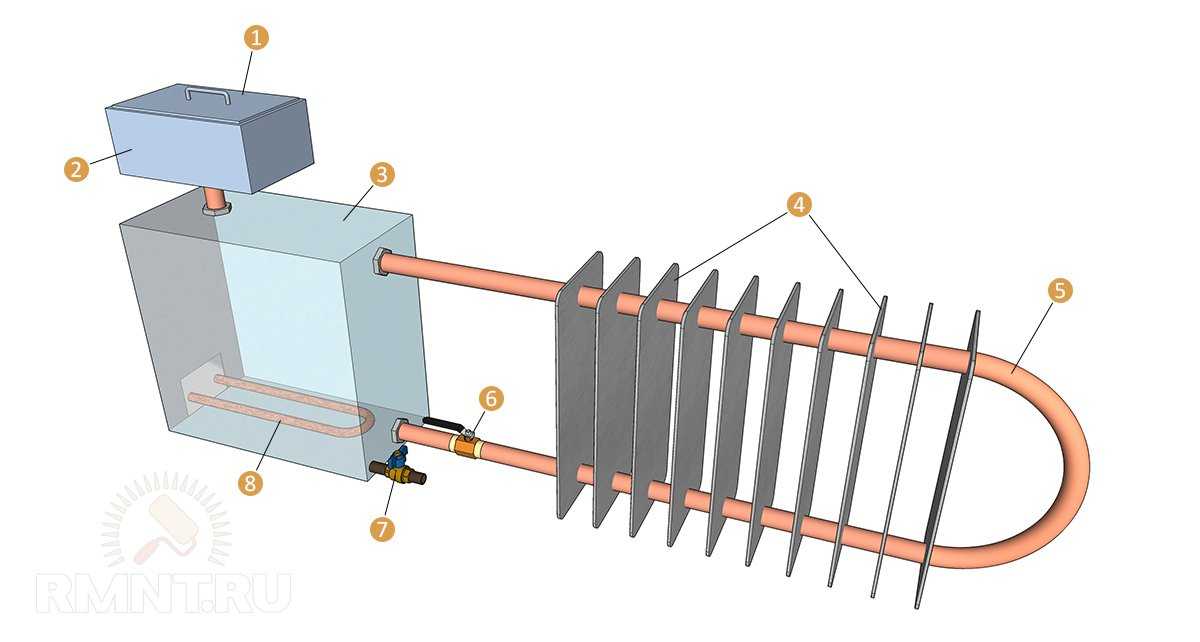 Системы недорогие, экологичные и автономные. На первый взгляд кажется, что про перебои с электричеством и счета можно забыть. Однако в России отопление от солнечных панелей, как и желание отказаться от городской сети, является всё же нерентабельным.
Системы недорогие, экологичные и автономные. На первый взгляд кажется, что про перебои с электричеством и счета можно забыть. Однако в России отопление от солнечных панелей, как и желание отказаться от городской сети, является всё же нерентабельным.
Качественная солнечная электростанция – недешёвое оборудование. Для необходимой мощности потребуется множество панелей и аккумуляторов. В регионах с низкими тарифами на электричество такая установка будет изначально невыгодной. Но в труднодоступных районах, где требуется постоянный подвоз дизельного топлива и техническое обслуживание генераторов, солнечные электростанции получаются более выгодными и имеют срок окупаемости 2-3 года.
С одной стороны, электростанция на фотоэлементах не требует особого обслуживания, но 1-2 раза в год вытирать пыль и счищать снег всё-таки необходимо. К тому же при ежедневной эксплуатации автономной системы у аккумуляторов снижается срок службы до 3-4 лет, т. к. он измеряется количеством циклов заряда-разряда. Это означает, что тратить средства на замену АКБ всё же придётся.
Это означает, что тратить средства на замену АКБ всё же придётся.
Другой вариант возможной установки солнечных панелей для экономии электричества — это сетевая солнечная электростанция без аккумуляторов. Она позволяет замещать электричество из городской сети в дневное время суток. Такая система окупается за 5-10 лет в зависимости от стоимости электроэнергии. Основное преимущество — это модульность (можно ставить параллельно несколько станций) системы, которое даёт возможность дальнейшего расширения без замены уже установленного оборудования. И, конечно, срок эксплуатации 35-40 лет без специального технического обслуживания.
Также если на даче часто отключают электричество, можно использовать гибридную солнечную электростанцию, которая объединяет в себе бесперебойную систему (замена генератора) и сетевую для экономии электричества.
Солнечные батареи: ставить или нет
Безусловно, автономная солнечная электростанция на поликристаллических или монокристаллических батареях незаменима в местах, где электричество вовсе отсутствует.
Пример использования солнечных батарей на даче: всю неделю с понедельника по пятницу солнечные батареи отдают лишнюю электроэнергию в городскую сеть (и вам за это платят), а в выходные вы приезжаете на дачу и отдыхаете бесплатно.
Компания 220-on предлагает оптимальное, проверенное оборудование под текущие задачи клиента без накруток и переплат. В каталоге собраны модели от надёжных и проверенных производителей. Все модели обеспечивают высокую производительность и мощность.
Специалисты 220-on выполнят монтаж и проведут гарантийное и постгарантийное обслуживание. Получить консультацию по подбору оборудования можно по телефону +7 (495) 646-12-20 или по бесплатной горячей линии 8-800-500-20-74.
Гигантская батарея Tesla заработала в Австралии
Подпишитесь на нашу рассылку ”Контекст”: она поможет вам разобраться в событиях.
Автор фото, Reuters
Подпись к фото,Супербатарея установлена в Джеймстауне, Южная Австралия
Самая большая в мире литий-ионная батарея начала подавать электроэнергию в электросети Южной Австралии.
Аккумулятор на 100 мегаватт, построенный компанией Tesla, официально введен в эксплуатацию в пятницу. Фактически же ток пошел по проводам еще в четверг: из-за аномальной жары и беспрерывной работы кондиционеров спрос на электричество чрезвычайно велик.
В последние годы Южная Австралия испытывает серьезные энергетические проблемы.
Глава Tesla Илон Маск в свое время пообещал построить батарею за 100 дней — это обещание он выполнил.
«История творится на наших глазах», — заявил глава местной администрации Джей Везерил в пятницу. Гигантский аккумулятор призван не допустить инцидентов, подобных прошлогоднему, когда целый штат остался без электричества.
По словам Маска, его батарея в три раза мощнее любых аналогов, созданных до сих пор.
- Энергия из воздуха, виски, фекалий и другие удивительные проекты
- Илон Маск показал новый электрокар Tesla Model 3
От спора в «Твиттере» к реальности
Идея родилась на свет, когда Илона Маска спросили в «Твиттере», серьезно ли он настроен помогать Южной Австралии в решении ее энергетических проблем.
Маск ответил утвердительно, добавив, что если батарея не будет построена за 100 дней, штат получит ее бесплатно.
Отсчет времени начался 30 сентября, после того как план был одобрен представителями правительства. Было выбрано место в окрестностях Джеймстауна, примерно в 200 километрах севернее Аделаиды.
Tesla понадобилось для строительства около 60 дней.
Батарея соединяется с ветряной электростанцией французской энергетической компании Neoen.
Автор фото, Getty Images
Подпись к фото,Начало проекту дало пари, заключенное в «Твиттере» главой «Теслы» Илоном Маском
При полной зарядке аккумулятор может обеспечивать электричеством до 30 тыс. домов в течение часа. Однако в основном он будет использоваться для поддержки и стабилизации существующих источников электроэнергии.
домов в течение часа. Однако в основном он будет использоваться для поддержки и стабилизации существующих источников электроэнергии.
В основе конструкции батареи лежит та же технология, что используется в автомобилях Tesla.
В заявлении компании говорится, что ввод в строй супербатареи подтверждает возможность «эффективного и стабильного решения энергетических проблем».
Скачок напряжения
Пропустить Подкаст и продолжить чтение.
Подкаст
Что это было?
Мы быстро, просто и понятно объясняем, что случилось, почему это важно и что будет дальше.
эпизоды
Конец истории Подкаст
Батарея в Южной Австралии — это лишь один из нескольких подобных проектов, в которых участвует Tesla.
Хранилища энергии меньшего размера, призванные обеспечить бесперебойную и стабильную подачу электроэнергии, действуют на юге Калифорнии, в Новой Зеландии, Великобритании, на Гавайях и ряде тихоокеанских островов. Некоторые отели класса люкс, расположенные на островах и в труднодоступных местах, также используют небольшие банки энергии.
Некоторые отели класса люкс, расположенные на островах и в труднодоступных местах, также используют небольшие банки энергии.
Компания также сообщила об отправке большой партии аккумуляторных батарей в Пуэрто-Рико, где энергетическая система была полностью разрушена ураганом «Мария».
Гигант интернет-торговли Amazon также проявляет интерес к технологиям хранения энергии. Компания запустила пилотный проект по использованию батарей в своих центрах обработки данных.
В Tesla говорят, что опыт многолетней разработки автомобильных литий-ионных батарей пригодился при создании больших аккумуляторов для систем хранения энергии. Батареи, используемые в энергохранилищах, предназначенных для электросетей, не совсем такие, как в автомобилях Tesla, но имеют общие с ними элементы и конструктивные решения.
Ранее Tesla сотрудничала с компанией Panasonic в рамках проекта по разработке аккумуляторов Powerpack. Однако для работы в Южной Австралии подрядчиком был выбран Samsung, так как Panasonic не смог предоставить требуемые батареи в условиях жесткого дефицита времени.
Вскоре Tesla предстоит столкнуться с жесткой конкуренцией со стороны крупных энергетических компаний. В следующем году вводится в эксплуатацию батарея в Южной Корее, которая будет на 50% больше, чем австралийский аккумулятор Tesla. Китайские компании и многие другие участники рынка, работающие в области возобновляемой энергии, также строят сейчас энергохранилища по всему миру.
Резервное питание дома от аккумулятора — есть ли жизнь после отключения от электричества?
Владельцы частных домов предпочитают проводить автономные коммуникации – так они становятся независимыми от централизованного снабжения ресурсами и экономят большие суммы на ежемесячных счетах. Но взамен появляется другая проблема: зависимость систем дома от источника электроэнергии. В то же время современная техника чувствительна к даже кратковременным отключениям электричества, на 1-2 секунды, и обнуление настроек устройств — это только малая неприятность. Чтобы уберечь чуткие к параметрам сети приборы от частых отключений, устанавливается резервный источник питания. Для коттеджа наиболее распространенный вариант – это генератор, или источник бесперебойного питания (ИБП).
Для коттеджа наиболее распространенный вариант – это генератор, или источник бесперебойного питания (ИБП).
Устройства аварийного питания рассчитаны на работу в течение короткого времени – 10–15 минут, иногда этот период продлевается до получаса. Предполагается, что за это время питание сети от постоянного источника возобновится. Но чаще используются модели, которые способны поддерживать напряжение в сети часами, и сутками. Для этих целей подходит ИБП с аккумуляторами значительной емкости. Итак, можно ли использовать питание от аккумулятора в качестве резервного источника для дома?
ИБП или генератор?
Резервный источник питания необходим для жизнеобеспечения дома: отопления, роутеры, компьютеры, серверы, системы “умного дома”. Выдать необходимый минимум для поддержания работы устройств могут и генераторы, и ИБП с аккумуляторами. Посмотрим, какой из них будет удобнее в эксплуатации.
В первую очередь, от резервного источника питания требуется мгновенная подача напряжения при отключении постоянного источника. Генератор такой скоростью похвастаться не может: на разгон ему требуется от 10 секунд до 2,5 минут. ИБП переходит в рабочий режим за 4 мс, в результате чувствительная техника сохраняет настройки, не переходя в режим перезапуска. Инверторы двойного преобразования и вовсе не требуют времени для подачи напряжения – они включены постоянно и сразу начинают работу после отключения энергии.
Генератор такой скоростью похвастаться не может: на разгон ему требуется от 10 секунд до 2,5 минут. ИБП переходит в рабочий режим за 4 мс, в результате чувствительная техника сохраняет настройки, не переходя в режим перезапуска. Инверторы двойного преобразования и вовсе не требуют времени для подачи напряжения – они включены постоянно и сразу начинают работу после отключения энергии.
Инверторы не имеют механических частей, подверженных износу. Главные факторы, влияющие на ресурс, – емкость аккумуляторов и потребляемая мощность. Такая система удобна и при коротких промежутках в питании от основной, и при продолжительных отключениях электричества сроком на несколько суток. Аккумуляторы сразу начнут питать охранную сигнализацию или отопление дома.
В отличие от генератора, ИБП работает очень тихо, не выделяя в среду никаких газов. Генератор работает на топливе, и от выхлопных газов вы избавитесь, лишь отдалив установку от дома. Чтобы установить ИБП с аккумуляторами, потребуется маленькое помещение с нормальным уровнем влажности. Для работы рекомендована положительная температура, но некоторые системы работают и при минусовых показателях термометра.
Для работы рекомендована положительная температура, но некоторые системы работают и при минусовых показателях термометра.
Как выбрать аккумулятор?
Важная часть ИБП – аккумуляторы, от которых зависит работа прибора. Благодаря им дома можно устроить собственную мини-электростанцию, которая снабдит бесперебойным потоком энергии устройства в доме. Выбирайте аккумуляторы по нескольким параметрам:
- максимальный уровень тока при разрядке и зарядке — он говорит о предельных значения, при которых работает аккумулятор,
- количество циклов разрядки — это срок работы батареи,
- температура внешней среды, при которой работает аккумулятор,
- время, которое уходит на полную разрядку и зарядку,
- как быстро аккумулятор теряет заряд при циклическом использовании,
- габариты и вес — важно, если аккумулятор будет использоваться как мобильный источник питания.
Если уделить внимание этим параметрам, то возможно выбрать превосходный аккумулятор для аварийного или резервного питания дома. Аккумуляторы собирают в одну группу, стараясь располагать батареи как можно ближе друг к другу — тогда КПД у получившейся системы будет выше. В редких случаях разные элементы одной группы могут иметь разницу зарядов. Это негативно влияет на срок службы аккумуляторов. Проблему решают балансиры, выравнивающие ёмкость АКБ во всей группе.
Аккумуляторы собирают в одну группу, стараясь располагать батареи как можно ближе друг к другу — тогда КПД у получившейся системы будет выше. В редких случаях разные элементы одной группы могут иметь разницу зарядов. Это негативно влияет на срок службы аккумуляторов. Проблему решают балансиры, выравнивающие ёмкость АКБ во всей группе.
При подборе аккумулятора для ИБП важно обратить внимание и на его тип. Самые распространенные – наливные свинцово-кислотные, их отличает доступная стоиомость и легкость эксплуатации. Но для них характерен короткий срок работы — меньше 1 года.
Для ИБП допускается использование литиевых батарей: они функциональны, но в большинстве случае небезопасны. На текщее время их надежность ниже, а цена выше в разы, чем у AMG и GEL. Эффективнее всего AMG – они надёжны, отдавают много тока, герметичность, пожаробезопасность и долгий срок службы.
ИБП с аккумуляторами, выбранными в соответствии с параметрами тока, напряжения и требованиями установленных в доме приборов, станут эффективной системой резервного и аварийного питания для автономного энергоснабжения. Поставщики ИБП должны учитывать персональные параметры домов и техники клиента, предлагая аппаратуру, которая подходит для решения его задач.
Поставщики ИБП должны учитывать персональные параметры домов и техники клиента, предлагая аппаратуру, которая подходит для решения его задач.
Батарея (электричество) — Энциклопедия Нового Света
Четыре гальванических элемента типа АА.
В науке и технике батарея — это устройство, которое накапливает химическую энергию и делает ее доступной в электрической форме. Батареи состоят из электрохимических устройств, таких как один или несколько гальванических элементов, топливных элементов или проточных элементов. Строго говоря, электрическая «батарея» представляет собой взаимосвязанный массив подобных ячеек, но термин «батарея» также обычно применяется к одной ячейке, которая используется сама по себе.
Содержание
- 1 История
- 2 Концепции аккумуляторов
- 2.1 Емкость аккумулятора
- 2.2 Срок службы батареи
- 2.3 Взрыв батареи
- 3 Типа батарей
- 3.
 1 Одноразовый
1 Одноразовый - 3.2 Аккумулятор
- 3.3 Самодельные клетки
- 3.4 Тяговые батареи
- 3.5 Проточные батареи
- 3.6 Необслуживаемая (MF) батарея
- 3.
- 4 Экологические соображения
- 5 Электрический компонент
- 6 См. также
- 7 Примечания
- 8 Каталожные номера
- 9 Внешние ссылки
- 10 кредитов
Схема электрической батареи.
С развитием технологий были разработаны различные типы батарей для различных целей. Область их применения варьируется от портативных электронных устройств до автомобилей и космических зондов.
История
Самыми ранними известными артефактами, которые могли быть батареями, являются так называемые «Багдадские батареи», по-видимому, использовавшиеся в период между 250 9 г.0063 г. до н. э. и 640 CE Термин «батарея» в этом контексте был впервые использован Бенджамином Франклином для описания набора связанных лейденских банок, первого конденсатора и раннего средства хранения заряда до изобретения настоящих электрохимических батарей.
Современное развитие аккумуляторов началось с батареи Вольта, изобретенной итальянским физиком Алессандро Вольта, который анонсировал ее в 1800 году. [1] . Эта батарея состояла из стопки цинковых и медных дисков, разделенных пропитанным солевым раствором картоном.
Британский химик по имени Джон Фредерик Даниэлл искал способ устранить скопление газа в котле Вольта. Его решение состояло в том, чтобы использовать второй электролит для поглощения водорода, произведенного первым. В 1836 году он изобрел ячейку Даниэля, состоявшую из медного горшка, наполненного раствором сульфата меди, в который был погружен неглазурованный глиняный сосуд, наполненный серной кислотой, в которую был погружен цинковый электрод. До этого момента все батареи постоянно разряжались, когда их химические реакции заканчивались.
В 1859 году Гастон Планте изобрел свинцово-кислотный элемент, первую батарею, которую можно было заряжать, пропуская через нее обратный ток. Свинцово-кислотный элемент состоит из свинцового анода и катода из оксида свинца, погруженных в серную кислоту. Оба электрода реагируют с кислотой с образованием сульфата свинца, но реакция на свинцовом аноде высвобождает электроны, а реакция на оксиде свинца поглощает их, создавая ток. Эти химические реакции можно обратить вспять, пропуская обратный ток через батарею, тем самым перезаряжая ее. Первая модель Планте состояла из листа свинца и листа оксида свинца, разделенных резиновыми полосками и скрученных в спираль. [2] Впервые его батареи использовались для питания освещения в вагонах поездов во время остановки на станции.
Оба электрода реагируют с кислотой с образованием сульфата свинца, но реакция на свинцовом аноде высвобождает электроны, а реакция на оксиде свинца поглощает их, создавая ток. Эти химические реакции можно обратить вспять, пропуская обратный ток через батарею, тем самым перезаряжая ее. Первая модель Планте состояла из листа свинца и листа оксида свинца, разделенных резиновыми полосками и скрученных в спираль. [2] Впервые его батареи использовались для питания освещения в вагонах поездов во время остановки на станции.
В 1881 году Камилла Фор изобрела улучшенную версию, которая состояла из решетки из свинцовой сетки, в которую была впрессована паста из оксида свинца, образующая пластину. Несколько пластин могут быть сложены для большей производительности. Эту конструкцию было легче производить серийно. К концу девятнадцатого века Карл Гасснер заменил жидкий электролит пастой, создав гораздо более практичную батарею для массового потребления.
В 1866 году Жорж Лекланше изобрел батарею, состоящую из цинкового анода, обернутого в пористый материал, и катода из диоксида марганца, погруженного в хлорид аммония. В катод из диоксида марганца также было добавлено немного углерода, что улучшало проводимость и абсорбцию электролита. [3]
В катод из диоксида марганца также было добавлено немного углерода, что улучшало проводимость и абсорбцию электролита. [3]
В 1887 году Карл Гасснер запатентовал вариант элемента Лекланше, который стал известен как сухой элемент, поскольку в нем не было свободного жидкого электролита. Вместо этого хлорид аммония был смешан с гипсом для создания пасты с добавлением небольшого количества хлорида цинка для продления срока годности. Катод из диоксида марганца был погружен в эту пасту, и оба были запечатаны в цинковую оболочку, которая также действовала как анод.
На рубеже двадцатого века первые автомобили с бензиновым двигателем были ненадежными, а электромобили были более популярны. Однако их популярность была ограничена очень тяжелыми свинцово-кислотными батареями, на которых они работали. Надеясь создать более коммерчески жизнеспособный электромобиль, Томас Эдисон и его коллеги начали поиск более легкой и прочной перезаряжаемой батареи. В 1903 году в результате их исследований была получена батарея, состоящая из железных и никелевых электродов с гидроксидом калия в качестве электролита (отсюда и название «щелочная», хотя эту батарею чаще называют никель-железной батареей). Однако потребители обнаружили, что эта ранняя версия подвержена утечкам и имеет короткий срок службы; он также не намного превзошел свинцово-кислотную батарею. Эдисон вернулся к чертежной доске и через семь лет выпустил более надежную и мощную модель. К этому времени, однако, недорогая и надежная модель Ford T сделала автомобили с бензиновыми двигателями стандартом. Тем не менее батарея Эдисона добилась больших успехов в других областях применения.
Однако потребители обнаружили, что эта ранняя версия подвержена утечкам и имеет короткий срок службы; он также не намного превзошел свинцово-кислотную батарею. Эдисон вернулся к чертежной доске и через семь лет выпустил более надежную и мощную модель. К этому времени, однако, недорогая и надежная модель Ford T сделала автомобили с бензиновыми двигателями стандартом. Тем не менее батарея Эдисона добилась больших успехов в других областях применения.
Самый распространенный тип продаваемых сегодня батарей — щелочные батареи — был разработан в 1955 году компанией Eveready.
Концепции батарей
Символ цепи для батареи; упрощенная электрическая модель; и более сложная, но все же неполная модель (последовательный конденсатор имеет чрезвычайно большую емкость и при зарядке имитирует разряд батареи).
Батарея представляет собой устройство, в котором химическая энергия непосредственно преобразуется в электрическую энергию. Он состоит из одного или нескольких гальванических элементов, каждый из которых состоит из двух полуэлементов, соединенных последовательно токопроводящим электролитом 9. 0069 [4] . На рисунке справа батарея состоит из одного или нескольких гальванических элементов, соединенных последовательно. Условный символ не обязательно представляет истинное количество гальванических элементов. Каждая ячейка имеет положительный вывод, показанный длинной горизонтальной линией, и отрицательный вывод, показанный более короткой горизонтальной линией. Они не соприкасаются друг с другом, а погружены в твердый или жидкий электролит.
0069 [4] . На рисунке справа батарея состоит из одного или нескольких гальванических элементов, соединенных последовательно. Условный символ не обязательно представляет истинное количество гальванических элементов. Каждая ячейка имеет положительный вывод, показанный длинной горизонтальной линией, и отрицательный вывод, показанный более короткой горизонтальной линией. Они не соприкасаются друг с другом, а погружены в твердый или жидкий электролит.
Электролит представляет собой проводник, соединяющий полуэлементы между собой. Он также содержит ионы, которые могут реагировать с химическими веществами электродов. Химическая энергия преобразуется в электрическую в результате химических реакций, в результате которых происходит перенос заряда между электродом и электролитом на их границе раздела. Такие реакции называются Фарадея, и отвечают за протекание тока через ячейку. Обычные реакции без переноса заряда ( нефарадеевские ) реакции также происходят на границе раздела электрод-электролит. Нефарадеевские реакции являются одной из причин того, что гальванические элементы (особенно свинцово-кислотные элементы обычных автомобильных аккумуляторов) «разряжаются», когда они не используются.
Нефарадеевские реакции являются одной из причин того, что гальванические элементы (особенно свинцово-кислотные элементы обычных автомобильных аккумуляторов) «разряжаются», когда они не используются.
Около 1800 года Алессандро Вольта изучал влияние различных электродов на результирующую электродвижущую силу (ЭДС) различных типов гальванических элементов. (ЭДС эквивалентна тому, что было названо внутренним источником напряжения в предыдущем разделе.) Он показал, что результирующая ЭДС (Е) представляет собой разность ЭДС Ε1 и Ε2, связанных с границами раздела электролит-электрод внутри двух полуячеек. Следовательно, одинаковые электроды дают Е=0 (нулевую ЭДС). Вольта не понимал, что ЭДС возникает из-за химических реакций. Он думал, что его клетки были неисчерпаемым источником энергии и что связанные с ними химические эффекты (например, коррозия) были просто неприятностью, а не неизбежным побочным продуктом их работы, как показал Майкл Фарадей примерно в 1830 году.
Гальванические элементы и батареи гальванических элементов измеряются в вольтах, единицах СИ для электродвижущей силы. Напряжение на клеммах батареи известно как напряжение на клеммах . Напряжение на клеммах батареи, которая не заряжается и не разряжается (напряжение холостого хода), равно ее ЭДС. Напряжение на клеммах разряжающейся батареи меньше ЭДС, а у заряжающейся батареи больше ЭДС.
Напряжение на клеммах батареи известно как напряжение на клеммах . Напряжение на клеммах батареи, которая не заряжается и не разряжается (напряжение холостого хода), равно ее ЭДС. Напряжение на клеммах разряжающейся батареи меньше ЭДС, а у заряжающейся батареи больше ЭДС.
Щелочные и угольно-цинковые элементы рассчитаны примерно на 1,5 вольт каждый из-за характера химических реакций в них. Для сравнения, учитывая высокие электрохимические потенциалы соединений лития, литиевые элементы могут обеспечивать до 3 и более вольт каждый. Однако соединения лития могут быть опасны.
Традиционная модель гальванического элемента, показанная выше, имеет внутреннее сопротивление, выведенное за пределы элемента. Это правильный эквивалент Thevenin для схемных приложений, но он чрезмерно упрощает химию и физику. В более точной (и более сложной) модели гальванический элемент можно представить как два электрических насоса, по одному на каждом выводе (фарадеевские реакции на соответствующих границах раздела электрод-электролит), разделенных внутренним сопротивлением, в значительной степени обусловленным электролитом. . Даже это является чрезмерным упрощением, поскольку оно не может объяснить, почему поведение гальванического элемента сильно зависит от скорости его разряда. Например, хорошо известно, что быстро (но не полностью) разряжаемая ячейка самопроизвольно восстанавливается после некоторого времени ожидания, а медленно (но полностью) разряжаемая ячейка самопроизвольно не восстанавливается.
. Даже это является чрезмерным упрощением, поскольку оно не может объяснить, почему поведение гальванического элемента сильно зависит от скорости его разряда. Например, хорошо известно, что быстро (но не полностью) разряжаемая ячейка самопроизвольно восстанавливается после некоторого времени ожидания, а медленно (но полностью) разряжаемая ячейка самопроизвольно не восстанавливается.
Простейшая характеристика батареи — ее ЭДС (напряжение), внутреннее сопротивление и емкость. В принципе, энергия, запасенная батареей, равна произведению ее ЭДС на емкость.
Емкость батареи
Учитывая, что напряжение батареи относительно постоянно, способность батареи сохранять энергию часто выражается в терминах общего количества заряда, способного пройти через устройство. Это выражается в ампер-часов, , где один А·ч равен 3600 кулонам. Если батарея может качать заряд в течение одного часа со скоростью один кулон/сек или один ампер (1 А), ее емкость составляет 1 А·ч. Если он может обеспечить 1 А в течение 100 часов, его емкость составляет 100 А·ч. Чем больше электролита и электродного материала в ячейке, тем больше емкость ячейки. Таким образом, крошечная ячейка имеет гораздо меньшую емкость, чем ячейка гораздо большего размера, даже если обе они основаны на одних и тех же химических реакциях (например, щелочные элементы), которые производят одинаковое напряжение на клеммах. Из-за химических реакций внутри ячеек емкость батареи зависит от условий разрядки, таких как величина тока, продолжительность тока, допустимое напряжение на клеммах батареи, температура и другие факторы.
Чем больше электролита и электродного материала в ячейке, тем больше емкость ячейки. Таким образом, крошечная ячейка имеет гораздо меньшую емкость, чем ячейка гораздо большего размера, даже если обе они основаны на одних и тех же химических реакциях (например, щелочные элементы), которые производят одинаковое напряжение на клеммах. Из-за химических реакций внутри ячеек емкость батареи зависит от условий разрядки, таких как величина тока, продолжительность тока, допустимое напряжение на клеммах батареи, температура и другие факторы.
Производители аккумуляторов используют стандартный метод определения рейтинга своих аккумуляторов. Батарея разряжается постоянным током в течение фиксированного периода времени, например, 10 или 20 часов, до установленного напряжения на клеммах на элемент. Таким образом, батарея на 100 ампер-часов рассчитана на 5 А в течение 20 часов при комнатной температуре. Эффективность батареи различна при разных скоростях разряда. При низком уровне разряда энергия батареи передается более эффективно, чем при более высоких скоростях разряда. Это известно как закон Пейкерта.
Это известно как закон Пейкерта.
Срок службы батареи
Даже если одноразовые (или «первичные») батареи никогда не вынимались из оригинальной упаковки, они могут терять от двух до двадцати пяти процентов своего первоначального заряда каждый год. Эта скорость существенно зависит от температуры, поскольку обычно химические реакции протекают быстрее при повышении температуры. Это известно как скорость «саморазряда» и связано с нефарадеевскими (не производящими ток) химическими реакциями, которые происходят внутри элемента, даже если к нему не приложена нагрузка. Батареи следует хранить при прохладных или низких температурах, чтобы уменьшить скорость побочных реакций. Например, некоторые люди хранят неиспользованные батареи в своих холодильниках, чтобы продлить срок их службы, хотя следует соблюдать осторожность, чтобы батареи не замерзли. Чрезвычайно высокие или низкие температуры снижают производительность батареи.
Перезаряжаемые батареи саморазряжаются быстрее, чем одноразовые щелочные батареи; до трех процентов в сутки (в зависимости от температуры). Из-за их короткого срока годности их не следует оставлять в ящике стола, а затем полагаться на них для питания фонарика или небольшого радио в чрезвычайной ситуации. По этой причине рекомендуется держать под рукой несколько щелочных батареек. Ni-Cd аккумуляторы почти всегда «разряжены», когда вы их покупаете, и их необходимо зарядить перед первым использованием.
Из-за их короткого срока годности их не следует оставлять в ящике стола, а затем полагаться на них для питания фонарика или небольшого радио в чрезвычайной ситуации. По этой причине рекомендуется держать под рукой несколько щелочных батареек. Ni-Cd аккумуляторы почти всегда «разряжены», когда вы их покупаете, и их необходимо зарядить перед первым использованием.
Большинство NiMH и NiCd аккумуляторов можно заряжать несколько сотен раз. Кроме того, они оба могут быть полностью разряжены, а затем перезаряжены без повреждения или укорочения их емкости.
Автомобильные свинцово-кислотные аккумуляторные батареи имеют гораздо более тяжелый срок службы. Из-за вибрации, ударов, тепла, холода и сульфатации свинцовых пластин немногие автомобильные аккумуляторы служат более шести лет при регулярном использовании. Автомобильные стартерные аккумуляторы имеют множество тонких пластин, чтобы обеспечить как можно больше ампер в достаточно небольшом корпусе, и разряжаются лишь на небольшое количество перед немедленной зарядкой. Следует соблюдать осторожность, чтобы избежать глубокой разрядки стартерной батареи, так как в процессе перезарядки небольшое количество свинца расплавляется с пластин. Когда в пластинах образуются отверстия, это приводит к меньшей площади поверхности для химической реакции, что приводит к меньшему измеренному напряжению. Если оставить свинцово-кислотную батарею в глубоко разряженном состоянии на любой период времени, сульфат лучше прилипнет к пластине, что затруднит удаление сульфата в процессе зарядки. Это может привести к меньшей доступной поверхности пластины и, как следствие, к более низкому напряжению, что сократит срок службы батареи. Свинцово-кислотные батареи «глубокого цикла», такие как те, которые используются в электрических тележках для гольфа, имеют гораздо более толстые пластины, что увеличивает их долговечность. Основным преимуществом свинцово-кислотных является их низкая стоимость, основными недостатками являются их большие габариты и масса при заданной емкости и напряжении.
Следует соблюдать осторожность, чтобы избежать глубокой разрядки стартерной батареи, так как в процессе перезарядки небольшое количество свинца расплавляется с пластин. Когда в пластинах образуются отверстия, это приводит к меньшей площади поверхности для химической реакции, что приводит к меньшему измеренному напряжению. Если оставить свинцово-кислотную батарею в глубоко разряженном состоянии на любой период времени, сульфат лучше прилипнет к пластине, что затруднит удаление сульфата в процессе зарядки. Это может привести к меньшей доступной поверхности пластины и, как следствие, к более низкому напряжению, что сократит срок службы батареи. Свинцово-кислотные батареи «глубокого цикла», такие как те, которые используются в электрических тележках для гольфа, имеют гораздо более толстые пластины, что увеличивает их долговечность. Основным преимуществом свинцово-кислотных является их низкая стоимость, основными недостатками являются их большие габариты и масса при заданной емкости и напряжении. Свинцово-кислотные аккумуляторы никогда не следует разряжать ниже 20% их полной емкости, так как внутреннее сопротивление приведет к нагреву и повреждению при попытке их перезарядки. В свинцово-кислотных системах глубокого цикла часто используется сигнальная лампа низкого заряда или выключатель питания при низком заряде, чтобы предотвратить повреждение, которое сократит срок службы батареи.
Свинцово-кислотные аккумуляторы никогда не следует разряжать ниже 20% их полной емкости, так как внутреннее сопротивление приведет к нагреву и повреждению при попытке их перезарядки. В свинцово-кислотных системах глубокого цикла часто используется сигнальная лампа низкого заряда или выключатель питания при низком заряде, чтобы предотвратить повреждение, которое сократит срок службы батареи.
Специальные «резервные» батареи, предназначенные для длительного хранения в аварийном снаряжении или боеприпасах, удерживают электролит батареи отдельно от пластин до активации батареи, что позволяет заполнить ячейки электролитом. Сроки хранения таких батарей могут составлять годы или десятилетия. Однако их конструкция дороже, чем у более распространенных форм.
Взрыв батареи
Взрыв батареи происходит из-за неправильного использования или неисправности батареи, например, при попытке зарядить основную батарею или коротком замыкании батареи. С автомобильными аккумуляторами взрывы, скорее всего, произойдут, когда короткое замыкание генерирует очень большие токи. Кроме того, автомобильные аккумуляторы выделяют водород при перезарядке (из-за электролиза воды в электролите). Обычно количество перезарядки очень мало, как и количество образовавшегося взрывоопасного газа, и газ быстро рассеивается. Однако при «перепрыгивании» автомобильного аккумулятора большой ток может вызвать быстрое выделение больших объемов водорода, который может воспламениться от близко расположенной искры (например, при снятии соединительных кабелей).
Кроме того, автомобильные аккумуляторы выделяют водород при перезарядке (из-за электролиза воды в электролите). Обычно количество перезарядки очень мало, как и количество образовавшегося взрывоопасного газа, и газ быстро рассеивается. Однако при «перепрыгивании» автомобильного аккумулятора большой ток может вызвать быстрое выделение больших объемов водорода, который может воспламениться от близко расположенной искры (например, при снятии соединительных кабелей).
Когда батарея перезаряжается с чрезмерной скоростью, взрывоопасная газовая смесь водорода и кислорода может образовываться быстрее, чем она может выйти из стен батареи, что приводит к повышению давления и возможности разрыва корпуса батареи. . В экстремальных случаях аккумуляторная кислота может сильно выплеснуться из корпуса аккумулятора и нанести травму.
Кроме того, выброс батареи в огонь может привести к взрыву из-за скопления пара внутри герметичного корпуса батареи.
Перезарядка, то есть попытка зарядить батарею сверх ее электрической емкости, также может привести к взрыву батареи, протечке или необратимому повреждению батареи. Это также может привести к повреждению зарядного устройства или устройства, в котором впоследствии будет использоваться перезаряженная батарея.
Это также может привести к повреждению зарядного устройства или устройства, в котором впоследствии будет использоваться перезаряженная батарея.
Типы батарей
Различные батареи (по часовой стрелке снизу слева): две 9-вольтовые, две «AA», одна «D», аккумулятор для беспроводного телефона, аккумулятор для видеокамеры, двухметровый аккумулятор для портативного радиолюбителя и батарейка-таблетка, одна «C» и две «AAA», плюс четверть доллара США для шкалы 9.0003
Сверху вниз: два таблеточных элемента, 9-вольтовая батарея PP3, батарея AAA , батарея AA , батарея C , батарея D , большая батарея 3R12
9 По крайней мере, с точки зрения пользователя, батареи можно разделить на два основных типа — перезаряжаемые и неперезаряжаемые (одноразовые). Каждый широко используется.
Одноразовые батареи, также называемые первичными элементами , предназначены для однократного использования и утилизации. Чаще всего они используются в портативных устройствах с низким потреблением тока, используются только с перерывами или используются вдали от альтернативного источника питания. Первичные ячейки также обычно использовались для цепей сигнализации и связи, где другая электроэнергия была доступна только с перерывами. Первичные элементы нельзя надежно перезарядить, поскольку химические реакции необратимы. Производители аккумуляторов не рекомендуют пытаться заряжать первичные элементы, хотя некоторые энтузиасты электроники утверждают, что это возможно сделать с помощью зарядного устройства специального типа.
Чаще всего они используются в портативных устройствах с низким потреблением тока, используются только с перерывами или используются вдали от альтернативного источника питания. Первичные ячейки также обычно использовались для цепей сигнализации и связи, где другая электроэнергия была доступна только с перерывами. Первичные элементы нельзя надежно перезарядить, поскольку химические реакции необратимы. Производители аккумуляторов не рекомендуют пытаться заряжать первичные элементы, хотя некоторые энтузиасты электроники утверждают, что это возможно сделать с помощью зарядного устройства специального типа.
В отличие от перезаряжаемых батарей или вторичных элементов , можно перезарядить после того, как они были разряжены. Это делается путем подачи внешнего электрического тока, который обращает вспять химические реакции, происходящие при использовании. Устройства для подачи соответствующего тока называются зарядными устройствами или зарядными устройствами.
Самая старая форма перезаряжаемой батареи, которая до сих пор используется в современном мире, — это свинцово-кислотная батарея с жидкостными элементами. Эта батарея примечательна тем, что она содержит жидкость в незапечатанном контейнере, что требует, чтобы батарея находилась в вертикальном положении, а помещение хорошо вентилировалось, чтобы обеспечить безопасное рассеивание газообразного водорода, который выделяется этими батареями во время перезарядки. Свинцово-кислотная батарея также очень тяжела для количества электроэнергии, которую она может обеспечить. Несмотря на это, его низкая стоимость производства и высокие уровни импульсного тока делают его широко используемым там, где требуется большая емкость (более 10 Ач) или где вес и простота обращения не имеют значения.
Эта батарея примечательна тем, что она содержит жидкость в незапечатанном контейнере, что требует, чтобы батарея находилась в вертикальном положении, а помещение хорошо вентилировалось, чтобы обеспечить безопасное рассеивание газообразного водорода, который выделяется этими батареями во время перезарядки. Свинцово-кислотная батарея также очень тяжела для количества электроэнергии, которую она может обеспечить. Несмотря на это, его низкая стоимость производства и высокие уровни импульсного тока делают его широко используемым там, где требуется большая емкость (более 10 Ач) или где вес и простота обращения не имеют значения.
Распространенной формой свинцово-кислотных аккумуляторов являются современные автомобильные аккумуляторы с жидкостными элементами. Он может обеспечивать мощность около 10 000 Вт в течение короткого периода времени и имеет пиковый выходной ток, который варьируется от 450 до 1100 ампер. Усовершенствованный тип свинцово-кислотного аккумулятора, называемый гелевым аккумулятором (или «гелевым элементом»), стал популярным в автомобильной промышленности в качестве замены свинцово-кислотного жидкостного элемента. Гелевый аккумулятор содержит полутвердый электролит, предотвращающий проливание, испарение электролита и выделение газов, а также значительно повышающий его устойчивость к повреждениям от вибрации и тепла. Другой тип батареи, Absorbed Glass Mat (AGM) суспендирует электролит в специальном мате из стекловолокна для достижения аналогичных результатов. Более портативные перезаряжаемые батареи включают несколько типов «сухих элементов», которые представляют собой герметичные блоки и поэтому используются в таких устройствах, как мобильные телефоны и ноутбуки. Элементы этого типа (в порядке увеличения удельной мощности и стоимости) включают никель-кадмиевые (NiCd), никель-металлогидридные (NiMH) и литий-ионные (Li-Ion) элементы.
Гелевый аккумулятор содержит полутвердый электролит, предотвращающий проливание, испарение электролита и выделение газов, а также значительно повышающий его устойчивость к повреждениям от вибрации и тепла. Другой тип батареи, Absorbed Glass Mat (AGM) суспендирует электролит в специальном мате из стекловолокна для достижения аналогичных результатов. Более портативные перезаряжаемые батареи включают несколько типов «сухих элементов», которые представляют собой герметичные блоки и поэтому используются в таких устройствах, как мобильные телефоны и ноутбуки. Элементы этого типа (в порядке увеличения удельной мощности и стоимости) включают никель-кадмиевые (NiCd), никель-металлогидридные (NiMH) и литий-ионные (Li-Ion) элементы.
Одноразовые
Не предназначены для перезарядки — иногда их называют «первичными элементами».
- Цинк-угольная батарея — средняя стоимость — используется в приложениях с небольшим энергопотреблением.
- Цинк-хлоридная батарея — похожа на угольно-цинковую, но с немного более длительным сроком службы.
- Щелочные батареи — щелочные / марганцевые батареи с длительным сроком службы, широко используемые как в устройствах с низким, так и с большим энергопотреблением.
- Аккумулятор из оксида серебра — обычно используется в слуховых аппаратах. Литиевая батарея
- — обычно используется в цифровых камерах. Иногда используется в часах и компьютерных часах. Очень долгий срок службы (до десяти лет в наручных часах) и способный выдавать большие токи, но дорогой. Батарейка
- Mercury — обычно используется в цифровых часах. Воздушно-цинковая батарейка
- — обычно используется в слуховых аппаратах.
- Термобатарея — высокотемпературный резерв. Почти исключительно военные приложения.
- Активируемая водой батарея — используется для радиозондов и аварийных приложений.
Аккумуляторы
Также известны как вторичные батареи или аккумуляторы.
- Свинцово-кислотный аккумулятор — обычно используется в транспортных средствах, системах сигнализации и источниках бесперебойного питания.
 Используется для использования в качестве «А» или «мокрой» батареи в радиоприемниках с лампами и лампами. Основным преимуществом этой химии является ее низкая стоимость — большая батарея (например, 70 Ач) относительно дешева по сравнению с другими химическими веществами. Однако этот химический состав батареи имеет более низкую плотность энергии, чем другие доступные сегодня химические составы батарей (см. ниже).
Используется для использования в качестве «А» или «мокрой» батареи в радиоприемниках с лампами и лампами. Основным преимуществом этой химии является ее низкая стоимость — большая батарея (например, 70 Ач) относительно дешева по сравнению с другими химическими веществами. Однако этот химический состав батареи имеет более низкую плотность энергии, чем другие доступные сегодня химические составы батарей (см. ниже).- Абсорбированный стеклянный мат — это класс свинцово-кислотных аккумуляторов, в которых электролит абсорбирован стекловолоконным матом. Гелевая батарея
- представляет собой перезаряжаемую свинцово-кислотную батарею с регулируемым клапаном и гелеобразным электролитом.
Литий-ионный аккумулятор - — относительно современный химический аккумулятор, который обеспечивает очень высокую плотность заряда (т. е. легкий аккумулятор будет хранить много энергии) и не страдает от какого-либо эффекта «памяти». Используется в ноутбуках (ноутбуках), современных телефонах с камерами, некоторых перезаряжаемых MP3-плеерах и большинстве других портативных перезаряжаемых цифровых устройств.
 Литий-ионный полимерный аккумулятор
Литий-ионный полимерный аккумулятор - — характеристики аналогичны литий-ионным, но с немного меньшей плотностью заряда. Этот химический состав батареи может быть использован для любой батареи в соответствии с потребностями производителя, например, для ультратонких (толщиной 1 мм) элементов для новейших КПК. Никель-кадмиевая батарея
- — используется во многих бытовых устройствах, но вытесняется литий-ионными и никель-металлогидридными батареями. Этот химический состав обеспечивает самый длительный срок службы (более 1500 циклов), но имеет низкую плотность энергии по сравнению с некоторыми другими химическими составами. Ni-Cd элементы, использующие более старую технологию, страдают от эффекта памяти, но в современных батареях этот эффект резко снижен. Аккумулятор NaS
- — (натрий-серный аккумулятор) представляет собой тип аккумулятора, изготовленного из натрия (Na) и серы (S). Аккумуляторы этого типа отличаются высокой плотностью энергии, высокой эффективностью заряда/разряда (89—92%), длительным сроком службы и изготавливаются из недорогих нетоксичных материалов.

- Никель-железная батарея — аккумуляторная батарея с катодом из оксида-гидроксида никеля(III) и железным анодом, с электролитом из гидроксида калия.
- Никель-металлогидридная батарея, сокращенно NiMH, представляет собой тип перезаряжаемой батареи, аналогичной никель-кадмиевой (NiCd) батарее, но в качестве анода вместо кадмия используется сплав, поглощающий водород.
- Натриево-металлическая хлоридная батарея, новый класс перезаряжаемых натриевых/бета-глиноземных батарей, в которых традиционный катод из жидкой серы заменен катодом из хлорированного железа или никеля в виде пористой металлической матрицы, пропитанной расплавленным хлоридом натрия-алюминия. Никель-цинковая батарея
- (иногда сокращенно NiZn) представляет собой тип перезаряжаемой батареи, обычно используемой в секторе легких электромобилей.
- Батарея с расплавленной солью — это класс высокотемпературных электрических батарей с первичным и вторичным элементами, в которых в качестве электролита используются расплавленные соли.
.jpg)
Самодельные элементы питания
Почти любой жидкий или влажный объект, содержащий достаточное количество ионов для обеспечения электропроводности, может служить электролитом для элемента питания. В качестве новинки или научной демонстрации можно вставить два электрода из разных металлов в лимон, картошку, стакан безалкогольного напитка и т. д. и генерировать небольшое количество электричества. По состоянию на 2005 год «часы с двумя картофелинами» широко доступны в магазинах хобби и игрушек; они состоят из пары ячеек, каждая из которых состоит из картофелины (лимона и т. д.) с двумя вставленными в нее электродами, соединенными последовательно, образуя батарею с достаточным напряжением для питания цифровых часов. Самодельные элементы такого типа не имеют реального практического применения, потому что они производят гораздо меньший ток и стоят гораздо больше на единицу произведенной энергии, чем коммерческие элементы, из-за необходимости частой замены фруктов или овощей. Кроме того, в серии из двух книг «Тайное использование для повседневных вещей» есть инструкции по изготовлению батареи из пятицентовой монеты, монеты и куска бумажного полотенца, смоченного в соленой воде. Каждый из них может выдавать до 0,3 вольта, и при использовании многих из них они могут заменить обычные батареи на короткое время.
Кроме того, в серии из двух книг «Тайное использование для повседневных вещей» есть инструкции по изготовлению батареи из пятицентовой монеты, монеты и куска бумажного полотенца, смоченного в соленой воде. Каждый из них может выдавать до 0,3 вольта, и при использовании многих из них они могут заменить обычные батареи на короткое время.
Свинцово-кислотные элементы можно легко изготовить в домашних условиях, но для «формирования» пластин требуется утомительный цикл зарядки/разрядки. Это процесс, при котором на пластинах образуется сульфат свинца, который во время зарядки превращается в диоксид свинца (положительная пластина) и чистый свинец (отрицательная пластина). Повторение этого процесса приводит к микроскопически шероховатой поверхности с гораздо большей площадью поверхности. Это увеличивает ток, который ячейка может обеспечить.
Тяговые батареи
Тяговые батареи (аккумуляторы или аккумуляторы) предназначены для обеспечения питания транспортных средств, таких как электромобиль или тягач. Основным соображением при проектировании является соотношение мощности и веса, поскольку автомобиль должен нести аккумулятор. В то время как использовались обычные свинцово-кислотные батареи с жидким электролитом, электролит в тяговых батареях часто загущен, чтобы предотвратить проливание. Электролит также может быть заключен в стекловату, которая намотана таким образом, что элементы имеют круглое поперечное сечение (тип AGM).
Основным соображением при проектировании является соотношение мощности и веса, поскольку автомобиль должен нести аккумулятор. В то время как использовались обычные свинцово-кислотные батареи с жидким электролитом, электролит в тяговых батареях часто загущен, чтобы предотвратить проливание. Электролит также может быть заключен в стекловату, которая намотана таким образом, что элементы имеют круглое поперечное сечение (тип AGM).
Типы аккумуляторов, используемых в электромобилях
- Обычная свинцово-кислотная батарея с жидким электролитом.
- Тип AGM (впитывающий стекломат)
- Zebra Na/NiCl 2 батарея, работающая при температуре 270 °C, требующая охлаждения в случае скачков температуры. Аккумулятор
- NiZn (более высокое напряжение элемента 1,6 В и, следовательно, увеличение удельной энергии на 25%, очень короткий срок службы).
Литий-ионные аккумуляторы в настоящее время вытесняют никель-металлгидридные аккумуляторы в этом секторе, в то время как свинцово-кислотные аккумуляторы по-прежнему играют ведущую роль с точки зрения низких инвестиционных затрат [5] .
Проточные батареи
Проточные батареи представляют собой особый класс батарей, в которых дополнительное количество электролита хранится вне основного силового элемента батареи и циркулирует через него с помощью насосов или путем движения. Проточные батареи могут иметь чрезвычайно большую емкость и используются в морских приложениях, а также приобретают все большую популярность в приложениях для хранения энергии в сетях.
Цинк-бромные и ванадиевые окислительно-восстановительные батареи являются типичными примерами коммерчески доступных проточных батарей.
Необслуживаемый аккумулятор (MF)
Аккумулятор MF (необслуживаемый) — это один из многих типов свинцово-кислотных аккумуляторов. Он стал популярным на мотоциклах, потому что его кислота впитывается в среду, разделяющую пластины, поэтому она не может пролиться, и эта среда также поддерживает пластины, что помогает им лучше противостоять вибрации.
Электрические характеристики аккумуляторов MF несколько отличаются от характеристик свинцово-кислотных аккумуляторов с жидкостными элементами, поэтому при их зарядке и разрядке следует соблюдать осторожность. Аккумуляторы MF не следует путать с аккумуляторами AGM (Absorbed Glass Mat), которые также имеют абсорбированный электролит, но опять же имеют другие электрические характеристики.
Аккумуляторы MF не следует путать с аккумуляторами AGM (Absorbed Glass Mat), которые также имеют абсорбированный электролит, но опять же имеют другие электрические характеристики.
Соображения по охране окружающей среды
С момента своего создания более 250 лет назад аккумуляторы остаются одними из самых дорогих источников энергии, а их производство требует много ценных ресурсов и часто использует опасные химические вещества. По этой причине во многих регионах теперь есть услуги по переработке аккумуляторов, которые позволяют восстановить некоторые из наиболее токсичных (а иногда и ценных) материалов из использованных аккумуляторов. Батареи могут быть опасными или смертельными при проглатывании.
Электрический компонент
Элементы батареи могут быть соединены параллельно, последовательно или и тем, и другим. Параллельная комбинация ячеек имеет то же напряжение, что и одиночная ячейка, но может обеспечивать более высокий ток (сумма токов от всех ячеек). Последовательная комбинация имеет тот же номинальный ток, что и одиночная ячейка, но ее напряжение представляет собой сумму напряжений всех ячеек. Наиболее практичные электрохимические батареи, такие как 9-вольтовые аккумуляторы для фонарей и 12-вольтовые автомобильные (автомобильные) аккумуляторы, имеют внутри корпуса несколько последовательно соединенных элементов. Параллельные схемы страдают от проблемы, заключающейся в том, что если одна ячейка разряжается быстрее, чем соседняя, ток будет течь от полной ячейки к пустой, что приведет к потере энергии и, возможно, к перегреву. Хуже того, если в одной ячейке произойдет короткое замыкание из-за внутренней неисправности, ее соседняя ячейка будет вынуждена отдать свой максимальный ток в неисправную ячейку, что приведет к перегреву и, возможно, взрыву. Поэтому параллельно подключенные элементы обычно оснащаются электронной схемой для защиты от этих проблем. Как в последовательном, так и в параллельном типах энергия, запасенная в батарее, равна сумме энергий, запасенных во всех элементах.
Последовательная комбинация имеет тот же номинальный ток, что и одиночная ячейка, но ее напряжение представляет собой сумму напряжений всех ячеек. Наиболее практичные электрохимические батареи, такие как 9-вольтовые аккумуляторы для фонарей и 12-вольтовые автомобильные (автомобильные) аккумуляторы, имеют внутри корпуса несколько последовательно соединенных элементов. Параллельные схемы страдают от проблемы, заключающейся в том, что если одна ячейка разряжается быстрее, чем соседняя, ток будет течь от полной ячейки к пустой, что приведет к потере энергии и, возможно, к перегреву. Хуже того, если в одной ячейке произойдет короткое замыкание из-за внутренней неисправности, ее соседняя ячейка будет вынуждена отдать свой максимальный ток в неисправную ячейку, что приведет к перегреву и, возможно, взрыву. Поэтому параллельно подключенные элементы обычно оснащаются электронной схемой для защиты от этих проблем. Как в последовательном, так и в параллельном типах энергия, запасенная в батарее, равна сумме энергий, запасенных во всех элементах.
Аккумулятор можно просто смоделировать как идеальный источник напряжения (т. е. источник с нулевым внутренним сопротивлением), включенный последовательно с резистором. Источник напряжения зависит главным образом от химического состава батареи, а не от того, разряжена она или полна. Когда батарея разряжается, ее внутреннее сопротивление увеличивается. Когда батарея подключена к нагрузке (например, лампочке), которая имеет собственное сопротивление, результирующее напряжение на нагрузке зависит от отношения внутреннего сопротивления батареи к сопротивлению нагрузки. Когда батарея свежая, ее внутреннее сопротивление низкое, поэтому напряжение на нагрузке почти равно напряжению внутреннего источника напряжения батареи. Когда батарея разряжается, а ее внутреннее сопротивление увеличивается, напряжение на ее внутреннем сопротивлении увеличивается, поэтому напряжение на ее клеммах уменьшается, и способность батареи отдавать мощность в нагрузку уменьшается.
См. также
- Алессандро Вольта
- Электричество
Примечания
- ↑ «Об электричестве, возбуждаемом простым контактом проводящих веществ различных видов».
 Достопочтенный сэр Джозеф Бэнкс, Барт KB PRS Прочитано 26 июня 1800 г.». Философские труды Лондонского королевского общества (1800): 403-431. Проверено 27 декабря 2017 г.
Достопочтенный сэр Джозеф Бэнкс, Барт KB PRS Прочитано 26 июня 1800 г.». Философские труды Лондонского королевского общества (1800): 403-431. Проверено 27 декабря 2017 г. - ↑ Corrosion-doctors.org Гастон Планте (1834–1889) Дата обращения 27 декабря 2017 г.
- ↑ Molecular Expressions Zinc-Carbon Batteries Дата обращения 27 декабря 2017 г.
- ↑ Энн-Мари Хелменстайн, Half-Cell Definition ThoughtCo. , 2017. Проверено 27 декабря 2017.
- ↑ Мэтейс, Дж. и В. Ван Аутенбур. Subat: Устойчивые батареи. Проверено 27 декабря 2017 г.
Ссылки
Ссылки ISBN поддерживают NWE за счет реферальных сборов
- Линден, Дэвид; Редди, Томас Б. Справочник по батареям . Нью-Йорк, штат Нью-Йорк: McGraw-Hill Professional, 2001. ISBN 0071359788 .
- Делл Р.М. и Д. Рэнд. Общие сведения о батареях . Лондон, Англия: Королевское химическое общество, 2001. ISBN 0854046054 .
- Бухманн, Исидор.
 Батареи в портативном мире: Справочник по перезаряжаемым батареям для не инженеров . Ричмонд, Британская Колумбия, Канада: Cadex Electronics, 2001. ISBN 0968211828
Батареи в портативном мире: Справочник по перезаряжаемым батареям для не инженеров . Ричмонд, Британская Колумбия, Канада: Cadex Electronics, 2001. ISBN 0968211828
Внешние ссылки
Все ссылки получены 31 декабря 2021 г.
- Беллис, Мэри. History Timeline of the Battery ThoughtCo , 2017.
Кредиты
New World Encyclopedia Авторы и редакторы переписали и дополнили статью Wikipedia в соответствии со стандартами New World Encyclopedia . Эта статья соответствует условиям лицензии Creative Commons CC-by-sa 3.0 (CC-by-sa), которая может использоваться и распространяться с надлежащим указанием авторства. Кредит должен соответствовать условиям этой лицензии, которая может ссылаться как на Энциклопедия Нового Света участников и самоотверженных добровольных участников Фонда Викимедиа. Чтобы процитировать эту статью, щелкните здесь, чтобы просмотреть список допустимых форматов цитирования. История более ранних вкладов википедистов доступна исследователям здесь:
История более ранних вкладов википедистов доступна исследователям здесь:
- Батарея_(электричество) история
- MF_Battery history
История этой статьи с момента ее импорта в New World Encyclopedia :
- История «Батарея (электричество)»
Примечание. На использование отдельных изображений, лицензированных отдельно, могут распространяться некоторые ограничения.
Батарея (электричество) — Энциклопедия Нового Света
Четыре гальванических элемента типа АА.
В науке и технике батарея — это устройство, которое накапливает химическую энергию и делает ее доступной в электрической форме. Батареи состоят из электрохимических устройств, таких как один или несколько гальванических элементов, топливных элементов или проточных элементов. Строго говоря, электрическая «батарея» представляет собой взаимосвязанный массив подобных ячеек, но термин «батарея» также обычно применяется к одной ячейке, которая используется сама по себе.
Содержание
- 1 История
- 2 Концепции аккумуляторов
- 2.1 Емкость аккумулятора
- 2.2 Срок службы батареи
- 2.3 Взрыв батареи
- 3 Типа батарей
- 3.1 Одноразовый
- 3.2 Аккумулятор
- 3.3 Самодельные клетки
- 3.4 Тяговые батареи
- 3.5 Проточные батареи
- 3.6 Необслуживаемая (MF) батарея
- 4 Экологические соображения
- 5 Электрический компонент
- 6 См. также
- 7 Примечания
- 8 Каталожные номера
- 9 Внешние ссылки
- 10 кредитов
Схема электрической батареи.
С развитием технологий были разработаны различные типы батарей для различных целей. Область их применения варьируется от портативных электронных устройств до автомобилей и космических зондов.
История
Самыми ранними известными артефактами, которые могли быть батареями, являются так называемые «Багдадские батареи», по-видимому, использовавшиеся в период между 250 9 г. 0063 г. до н. э. и 640 CE Термин «батарея» в этом контексте был впервые использован Бенджамином Франклином для описания набора связанных лейденских банок, первого конденсатора и раннего средства хранения заряда до изобретения настоящих электрохимических батарей.
0063 г. до н. э. и 640 CE Термин «батарея» в этом контексте был впервые использован Бенджамином Франклином для описания набора связанных лейденских банок, первого конденсатора и раннего средства хранения заряда до изобретения настоящих электрохимических батарей.
Современное развитие аккумуляторов началось с батареи Вольта, изобретенной итальянским физиком Алессандро Вольта, который анонсировал ее в 1800 году. [1] . Эта батарея состояла из стопки цинковых и медных дисков, разделенных пропитанным солевым раствором картоном.
Британский химик по имени Джон Фредерик Даниэлл искал способ устранить скопление газа в котле Вольта. Его решение состояло в том, чтобы использовать второй электролит для поглощения водорода, произведенного первым. В 1836 году он изобрел ячейку Даниэля, состоявшую из медного горшка, наполненного раствором сульфата меди, в который был погружен неглазурованный глиняный сосуд, наполненный серной кислотой, в которую был погружен цинковый электрод. До этого момента все батареи постоянно разряжались, когда их химические реакции заканчивались.
До этого момента все батареи постоянно разряжались, когда их химические реакции заканчивались.
В 1859 году Гастон Планте изобрел свинцово-кислотный элемент, первую батарею, которую можно было заряжать, пропуская через нее обратный ток. Свинцово-кислотный элемент состоит из свинцового анода и катода из оксида свинца, погруженных в серную кислоту. Оба электрода реагируют с кислотой с образованием сульфата свинца, но реакция на свинцовом аноде высвобождает электроны, а реакция на оксиде свинца поглощает их, создавая ток. Эти химические реакции можно обратить вспять, пропуская обратный ток через батарею, тем самым перезаряжая ее. Первая модель Планте состояла из листа свинца и листа оксида свинца, разделенных резиновыми полосками и скрученных в спираль. [2] Впервые его батареи использовались для питания освещения в вагонах поездов во время остановки на станции.
В 1881 году Камилла Фор изобрела улучшенную версию, которая состояла из решетки из свинцовой сетки, в которую была впрессована паста из оксида свинца, образующая пластину. Несколько пластин могут быть сложены для большей производительности. Эту конструкцию было легче производить серийно. К концу девятнадцатого века Карл Гасснер заменил жидкий электролит пастой, создав гораздо более практичную батарею для массового потребления.
Несколько пластин могут быть сложены для большей производительности. Эту конструкцию было легче производить серийно. К концу девятнадцатого века Карл Гасснер заменил жидкий электролит пастой, создав гораздо более практичную батарею для массового потребления.
В 1866 году Жорж Лекланше изобрел батарею, состоящую из цинкового анода, обернутого в пористый материал, и катода из диоксида марганца, погруженного в хлорид аммония. В катод из диоксида марганца также было добавлено немного углерода, что улучшало проводимость и абсорбцию электролита. [3]
В 1887 году Карл Гасснер запатентовал вариант элемента Лекланше, который стал известен как сухой элемент, поскольку в нем не было свободного жидкого электролита. Вместо этого хлорид аммония был смешан с гипсом для создания пасты с добавлением небольшого количества хлорида цинка для продления срока годности. Катод из диоксида марганца был погружен в эту пасту, и оба были запечатаны в цинковую оболочку, которая также действовала как анод.
На рубеже двадцатого века первые автомобили с бензиновым двигателем были ненадежными, а электромобили были более популярны. Однако их популярность была ограничена очень тяжелыми свинцово-кислотными батареями, на которых они работали. Надеясь создать более коммерчески жизнеспособный электромобиль, Томас Эдисон и его коллеги начали поиск более легкой и прочной перезаряжаемой батареи. В 1903 году в результате их исследований была получена батарея, состоящая из железных и никелевых электродов с гидроксидом калия в качестве электролита (отсюда и название «щелочная», хотя эту батарею чаще называют никель-железной батареей). Однако потребители обнаружили, что эта ранняя версия подвержена утечкам и имеет короткий срок службы; он также не намного превзошел свинцово-кислотную батарею. Эдисон вернулся к чертежной доске и через семь лет выпустил более надежную и мощную модель. К этому времени, однако, недорогая и надежная модель Ford T сделала автомобили с бензиновыми двигателями стандартом. Тем не менее батарея Эдисона добилась больших успехов в других областях применения.
Тем не менее батарея Эдисона добилась больших успехов в других областях применения.
Самый распространенный тип продаваемых сегодня батарей — щелочные батареи — был разработан в 1955 году компанией Eveready.
Концепции батарей
Символ цепи для батареи; упрощенная электрическая модель; и более сложная, но все же неполная модель (последовательный конденсатор имеет чрезвычайно большую емкость и при зарядке имитирует разряд батареи).
Батарея представляет собой устройство, в котором химическая энергия непосредственно преобразуется в электрическую энергию. Он состоит из одного или нескольких гальванических элементов, каждый из которых состоит из двух полуэлементов, соединенных последовательно токопроводящим электролитом 9.0069 [4] . На рисунке справа батарея состоит из одного или нескольких гальванических элементов, соединенных последовательно. Условный символ не обязательно представляет истинное количество гальванических элементов. Каждая ячейка имеет положительный вывод, показанный длинной горизонтальной линией, и отрицательный вывод, показанный более короткой горизонтальной линией. Они не соприкасаются друг с другом, а погружены в твердый или жидкий электролит.
Каждая ячейка имеет положительный вывод, показанный длинной горизонтальной линией, и отрицательный вывод, показанный более короткой горизонтальной линией. Они не соприкасаются друг с другом, а погружены в твердый или жидкий электролит.
Электролит представляет собой проводник, соединяющий полуэлементы между собой. Он также содержит ионы, которые могут реагировать с химическими веществами электродов. Химическая энергия преобразуется в электрическую в результате химических реакций, в результате которых происходит перенос заряда между электродом и электролитом на их границе раздела. Такие реакции называются Фарадея, и отвечают за протекание тока через ячейку. Обычные реакции без переноса заряда ( нефарадеевские ) реакции также происходят на границе раздела электрод-электролит. Нефарадеевские реакции являются одной из причин того, что гальванические элементы (особенно свинцово-кислотные элементы обычных автомобильных аккумуляторов) «разряжаются», когда они не используются.
Около 1800 года Алессандро Вольта изучал влияние различных электродов на результирующую электродвижущую силу (ЭДС) различных типов гальванических элементов. (ЭДС эквивалентна тому, что было названо внутренним источником напряжения в предыдущем разделе.) Он показал, что результирующая ЭДС (Е) представляет собой разность ЭДС Ε1 и Ε2, связанных с границами раздела электролит-электрод внутри двух полуячеек. Следовательно, одинаковые электроды дают Е=0 (нулевую ЭДС). Вольта не понимал, что ЭДС возникает из-за химических реакций. Он думал, что его клетки были неисчерпаемым источником энергии и что связанные с ними химические эффекты (например, коррозия) были просто неприятностью, а не неизбежным побочным продуктом их работы, как показал Майкл Фарадей примерно в 1830 году.
Гальванические элементы и батареи гальванических элементов измеряются в вольтах, единицах СИ для электродвижущей силы. Напряжение на клеммах батареи известно как напряжение на клеммах . Напряжение на клеммах батареи, которая не заряжается и не разряжается (напряжение холостого хода), равно ее ЭДС. Напряжение на клеммах разряжающейся батареи меньше ЭДС, а у заряжающейся батареи больше ЭДС.
Напряжение на клеммах разряжающейся батареи меньше ЭДС, а у заряжающейся батареи больше ЭДС.
Щелочные и угольно-цинковые элементы рассчитаны примерно на 1,5 вольт каждый из-за характера химических реакций в них. Для сравнения, учитывая высокие электрохимические потенциалы соединений лития, литиевые элементы могут обеспечивать до 3 и более вольт каждый. Однако соединения лития могут быть опасны.
Традиционная модель гальванического элемента, показанная выше, имеет внутреннее сопротивление, выведенное за пределы элемента. Это правильный эквивалент Thevenin для схемных приложений, но он чрезмерно упрощает химию и физику. В более точной (и более сложной) модели гальванический элемент можно представить как два электрических насоса, по одному на каждом выводе (фарадеевские реакции на соответствующих границах раздела электрод-электролит), разделенных внутренним сопротивлением, в значительной степени обусловленным электролитом. . Даже это является чрезмерным упрощением, поскольку оно не может объяснить, почему поведение гальванического элемента сильно зависит от скорости его разряда. Например, хорошо известно, что быстро (но не полностью) разряжаемая ячейка самопроизвольно восстанавливается после некоторого времени ожидания, а медленно (но полностью) разряжаемая ячейка самопроизвольно не восстанавливается.
Например, хорошо известно, что быстро (но не полностью) разряжаемая ячейка самопроизвольно восстанавливается после некоторого времени ожидания, а медленно (но полностью) разряжаемая ячейка самопроизвольно не восстанавливается.
Простейшая характеристика батареи — ее ЭДС (напряжение), внутреннее сопротивление и емкость. В принципе, энергия, запасенная батареей, равна произведению ее ЭДС на емкость.
Емкость батареи
Учитывая, что напряжение батареи относительно постоянно, способность батареи сохранять энергию часто выражается в терминах общего количества заряда, способного пройти через устройство. Это выражается в ампер-часов, , где один А·ч равен 3600 кулонам. Если батарея может качать заряд в течение одного часа со скоростью один кулон/сек или один ампер (1 А), ее емкость составляет 1 А·ч. Если он может обеспечить 1 А в течение 100 часов, его емкость составляет 100 А·ч. Чем больше электролита и электродного материала в ячейке, тем больше емкость ячейки. Таким образом, крошечная ячейка имеет гораздо меньшую емкость, чем ячейка гораздо большего размера, даже если обе они основаны на одних и тех же химических реакциях (например, щелочные элементы), которые производят одинаковое напряжение на клеммах. Из-за химических реакций внутри ячеек емкость батареи зависит от условий разрядки, таких как величина тока, продолжительность тока, допустимое напряжение на клеммах батареи, температура и другие факторы.
Таким образом, крошечная ячейка имеет гораздо меньшую емкость, чем ячейка гораздо большего размера, даже если обе они основаны на одних и тех же химических реакциях (например, щелочные элементы), которые производят одинаковое напряжение на клеммах. Из-за химических реакций внутри ячеек емкость батареи зависит от условий разрядки, таких как величина тока, продолжительность тока, допустимое напряжение на клеммах батареи, температура и другие факторы.
Производители аккумуляторов используют стандартный метод определения рейтинга своих аккумуляторов. Батарея разряжается постоянным током в течение фиксированного периода времени, например, 10 или 20 часов, до установленного напряжения на клеммах на элемент. Таким образом, батарея на 100 ампер-часов рассчитана на 5 А в течение 20 часов при комнатной температуре. Эффективность батареи различна при разных скоростях разряда. При низком уровне разряда энергия батареи передается более эффективно, чем при более высоких скоростях разряда. Это известно как закон Пейкерта.
Срок службы батареи
Даже если одноразовые (или «первичные») батареи никогда не вынимались из оригинальной упаковки, они могут терять от двух до двадцати пяти процентов своего первоначального заряда каждый год. Эта скорость существенно зависит от температуры, поскольку обычно химические реакции протекают быстрее при повышении температуры. Это известно как скорость «саморазряда» и связано с нефарадеевскими (не производящими ток) химическими реакциями, которые происходят внутри элемента, даже если к нему не приложена нагрузка. Батареи следует хранить при прохладных или низких температурах, чтобы уменьшить скорость побочных реакций. Например, некоторые люди хранят неиспользованные батареи в своих холодильниках, чтобы продлить срок их службы, хотя следует соблюдать осторожность, чтобы батареи не замерзли. Чрезвычайно высокие или низкие температуры снижают производительность батареи.
Перезаряжаемые батареи саморазряжаются быстрее, чем одноразовые щелочные батареи; до трех процентов в сутки (в зависимости от температуры). Из-за их короткого срока годности их не следует оставлять в ящике стола, а затем полагаться на них для питания фонарика или небольшого радио в чрезвычайной ситуации. По этой причине рекомендуется держать под рукой несколько щелочных батареек. Ni-Cd аккумуляторы почти всегда «разряжены», когда вы их покупаете, и их необходимо зарядить перед первым использованием.
Из-за их короткого срока годности их не следует оставлять в ящике стола, а затем полагаться на них для питания фонарика или небольшого радио в чрезвычайной ситуации. По этой причине рекомендуется держать под рукой несколько щелочных батареек. Ni-Cd аккумуляторы почти всегда «разряжены», когда вы их покупаете, и их необходимо зарядить перед первым использованием.
Большинство NiMH и NiCd аккумуляторов можно заряжать несколько сотен раз. Кроме того, они оба могут быть полностью разряжены, а затем перезаряжены без повреждения или укорочения их емкости.
Автомобильные свинцово-кислотные аккумуляторные батареи имеют гораздо более тяжелый срок службы. Из-за вибрации, ударов, тепла, холода и сульфатации свинцовых пластин немногие автомобильные аккумуляторы служат более шести лет при регулярном использовании. Автомобильные стартерные аккумуляторы имеют множество тонких пластин, чтобы обеспечить как можно больше ампер в достаточно небольшом корпусе, и разряжаются лишь на небольшое количество перед немедленной зарядкой. Следует соблюдать осторожность, чтобы избежать глубокой разрядки стартерной батареи, так как в процессе перезарядки небольшое количество свинца расплавляется с пластин. Когда в пластинах образуются отверстия, это приводит к меньшей площади поверхности для химической реакции, что приводит к меньшему измеренному напряжению. Если оставить свинцово-кислотную батарею в глубоко разряженном состоянии на любой период времени, сульфат лучше прилипнет к пластине, что затруднит удаление сульфата в процессе зарядки. Это может привести к меньшей доступной поверхности пластины и, как следствие, к более низкому напряжению, что сократит срок службы батареи. Свинцово-кислотные батареи «глубокого цикла», такие как те, которые используются в электрических тележках для гольфа, имеют гораздо более толстые пластины, что увеличивает их долговечность. Основным преимуществом свинцово-кислотных является их низкая стоимость, основными недостатками являются их большие габариты и масса при заданной емкости и напряжении.
Следует соблюдать осторожность, чтобы избежать глубокой разрядки стартерной батареи, так как в процессе перезарядки небольшое количество свинца расплавляется с пластин. Когда в пластинах образуются отверстия, это приводит к меньшей площади поверхности для химической реакции, что приводит к меньшему измеренному напряжению. Если оставить свинцово-кислотную батарею в глубоко разряженном состоянии на любой период времени, сульфат лучше прилипнет к пластине, что затруднит удаление сульфата в процессе зарядки. Это может привести к меньшей доступной поверхности пластины и, как следствие, к более низкому напряжению, что сократит срок службы батареи. Свинцово-кислотные батареи «глубокого цикла», такие как те, которые используются в электрических тележках для гольфа, имеют гораздо более толстые пластины, что увеличивает их долговечность. Основным преимуществом свинцово-кислотных является их низкая стоимость, основными недостатками являются их большие габариты и масса при заданной емкости и напряжении. Свинцово-кислотные аккумуляторы никогда не следует разряжать ниже 20% их полной емкости, так как внутреннее сопротивление приведет к нагреву и повреждению при попытке их перезарядки. В свинцово-кислотных системах глубокого цикла часто используется сигнальная лампа низкого заряда или выключатель питания при низком заряде, чтобы предотвратить повреждение, которое сократит срок службы батареи.
Свинцово-кислотные аккумуляторы никогда не следует разряжать ниже 20% их полной емкости, так как внутреннее сопротивление приведет к нагреву и повреждению при попытке их перезарядки. В свинцово-кислотных системах глубокого цикла часто используется сигнальная лампа низкого заряда или выключатель питания при низком заряде, чтобы предотвратить повреждение, которое сократит срок службы батареи.
Специальные «резервные» батареи, предназначенные для длительного хранения в аварийном снаряжении или боеприпасах, удерживают электролит батареи отдельно от пластин до активации батареи, что позволяет заполнить ячейки электролитом. Сроки хранения таких батарей могут составлять годы или десятилетия. Однако их конструкция дороже, чем у более распространенных форм.
Взрыв батареи
Взрыв батареи происходит из-за неправильного использования или неисправности батареи, например, при попытке зарядить основную батарею или коротком замыкании батареи. С автомобильными аккумуляторами взрывы, скорее всего, произойдут, когда короткое замыкание генерирует очень большие токи. Кроме того, автомобильные аккумуляторы выделяют водород при перезарядке (из-за электролиза воды в электролите). Обычно количество перезарядки очень мало, как и количество образовавшегося взрывоопасного газа, и газ быстро рассеивается. Однако при «перепрыгивании» автомобильного аккумулятора большой ток может вызвать быстрое выделение больших объемов водорода, который может воспламениться от близко расположенной искры (например, при снятии соединительных кабелей).
Кроме того, автомобильные аккумуляторы выделяют водород при перезарядке (из-за электролиза воды в электролите). Обычно количество перезарядки очень мало, как и количество образовавшегося взрывоопасного газа, и газ быстро рассеивается. Однако при «перепрыгивании» автомобильного аккумулятора большой ток может вызвать быстрое выделение больших объемов водорода, который может воспламениться от близко расположенной искры (например, при снятии соединительных кабелей).
Когда батарея перезаряжается с чрезмерной скоростью, взрывоопасная газовая смесь водорода и кислорода может образовываться быстрее, чем она может выйти из стен батареи, что приводит к повышению давления и возможности разрыва корпуса батареи. . В экстремальных случаях аккумуляторная кислота может сильно выплеснуться из корпуса аккумулятора и нанести травму.
Кроме того, выброс батареи в огонь может привести к взрыву из-за скопления пара внутри герметичного корпуса батареи.
Перезарядка, то есть попытка зарядить батарею сверх ее электрической емкости, также может привести к взрыву батареи, протечке или необратимому повреждению батареи. Это также может привести к повреждению зарядного устройства или устройства, в котором впоследствии будет использоваться перезаряженная батарея.
Это также может привести к повреждению зарядного устройства или устройства, в котором впоследствии будет использоваться перезаряженная батарея.
Типы батарей
Различные батареи (по часовой стрелке снизу слева): две 9-вольтовые, две «AA», одна «D», аккумулятор для беспроводного телефона, аккумулятор для видеокамеры, двухметровый аккумулятор для портативного радиолюбителя и батарейка-таблетка, одна «C» и две «AAA», плюс четверть доллара США для шкалы 9.0003
Сверху вниз: два таблеточных элемента, 9-вольтовая батарея PP3, батарея AAA , батарея AA , батарея C , батарея D , большая батарея 3R12
9 По крайней мере, с точки зрения пользователя, батареи можно разделить на два основных типа — перезаряжаемые и неперезаряжаемые (одноразовые). Каждый широко используется.
Одноразовые батареи, также называемые первичными элементами , предназначены для однократного использования и утилизации. Чаще всего они используются в портативных устройствах с низким потреблением тока, используются только с перерывами или используются вдали от альтернативного источника питания. Первичные ячейки также обычно использовались для цепей сигнализации и связи, где другая электроэнергия была доступна только с перерывами. Первичные элементы нельзя надежно перезарядить, поскольку химические реакции необратимы. Производители аккумуляторов не рекомендуют пытаться заряжать первичные элементы, хотя некоторые энтузиасты электроники утверждают, что это возможно сделать с помощью зарядного устройства специального типа.
Чаще всего они используются в портативных устройствах с низким потреблением тока, используются только с перерывами или используются вдали от альтернативного источника питания. Первичные ячейки также обычно использовались для цепей сигнализации и связи, где другая электроэнергия была доступна только с перерывами. Первичные элементы нельзя надежно перезарядить, поскольку химические реакции необратимы. Производители аккумуляторов не рекомендуют пытаться заряжать первичные элементы, хотя некоторые энтузиасты электроники утверждают, что это возможно сделать с помощью зарядного устройства специального типа.
В отличие от перезаряжаемых батарей или вторичных элементов , можно перезарядить после того, как они были разряжены. Это делается путем подачи внешнего электрического тока, который обращает вспять химические реакции, происходящие при использовании. Устройства для подачи соответствующего тока называются зарядными устройствами или зарядными устройствами.
Самая старая форма перезаряжаемой батареи, которая до сих пор используется в современном мире, — это свинцово-кислотная батарея с жидкостными элементами. Эта батарея примечательна тем, что она содержит жидкость в незапечатанном контейнере, что требует, чтобы батарея находилась в вертикальном положении, а помещение хорошо вентилировалось, чтобы обеспечить безопасное рассеивание газообразного водорода, который выделяется этими батареями во время перезарядки. Свинцово-кислотная батарея также очень тяжела для количества электроэнергии, которую она может обеспечить. Несмотря на это, его низкая стоимость производства и высокие уровни импульсного тока делают его широко используемым там, где требуется большая емкость (более 10 Ач) или где вес и простота обращения не имеют значения.
Эта батарея примечательна тем, что она содержит жидкость в незапечатанном контейнере, что требует, чтобы батарея находилась в вертикальном положении, а помещение хорошо вентилировалось, чтобы обеспечить безопасное рассеивание газообразного водорода, который выделяется этими батареями во время перезарядки. Свинцово-кислотная батарея также очень тяжела для количества электроэнергии, которую она может обеспечить. Несмотря на это, его низкая стоимость производства и высокие уровни импульсного тока делают его широко используемым там, где требуется большая емкость (более 10 Ач) или где вес и простота обращения не имеют значения.
Распространенной формой свинцово-кислотных аккумуляторов являются современные автомобильные аккумуляторы с жидкостными элементами. Он может обеспечивать мощность около 10 000 Вт в течение короткого периода времени и имеет пиковый выходной ток, который варьируется от 450 до 1100 ампер. Усовершенствованный тип свинцово-кислотного аккумулятора, называемый гелевым аккумулятором (или «гелевым элементом»), стал популярным в автомобильной промышленности в качестве замены свинцово-кислотного жидкостного элемента. Гелевый аккумулятор содержит полутвердый электролит, предотвращающий проливание, испарение электролита и выделение газов, а также значительно повышающий его устойчивость к повреждениям от вибрации и тепла. Другой тип батареи, Absorbed Glass Mat (AGM) суспендирует электролит в специальном мате из стекловолокна для достижения аналогичных результатов. Более портативные перезаряжаемые батареи включают несколько типов «сухих элементов», которые представляют собой герметичные блоки и поэтому используются в таких устройствах, как мобильные телефоны и ноутбуки. Элементы этого типа (в порядке увеличения удельной мощности и стоимости) включают никель-кадмиевые (NiCd), никель-металлогидридные (NiMH) и литий-ионные (Li-Ion) элементы.
Гелевый аккумулятор содержит полутвердый электролит, предотвращающий проливание, испарение электролита и выделение газов, а также значительно повышающий его устойчивость к повреждениям от вибрации и тепла. Другой тип батареи, Absorbed Glass Mat (AGM) суспендирует электролит в специальном мате из стекловолокна для достижения аналогичных результатов. Более портативные перезаряжаемые батареи включают несколько типов «сухих элементов», которые представляют собой герметичные блоки и поэтому используются в таких устройствах, как мобильные телефоны и ноутбуки. Элементы этого типа (в порядке увеличения удельной мощности и стоимости) включают никель-кадмиевые (NiCd), никель-металлогидридные (NiMH) и литий-ионные (Li-Ion) элементы.
Одноразовые
Не предназначены для перезарядки — иногда их называют «первичными элементами».
- Цинк-угольная батарея — средняя стоимость — используется в приложениях с небольшим энергопотреблением.
- Цинк-хлоридная батарея — похожа на угольно-цинковую, но с немного более длительным сроком службы.

- Щелочные батареи — щелочные / марганцевые батареи с длительным сроком службы, широко используемые как в устройствах с низким, так и с большим энергопотреблением.
- Аккумулятор из оксида серебра — обычно используется в слуховых аппаратах. Литиевая батарея
- — обычно используется в цифровых камерах. Иногда используется в часах и компьютерных часах. Очень долгий срок службы (до десяти лет в наручных часах) и способный выдавать большие токи, но дорогой. Батарейка
- Mercury — обычно используется в цифровых часах. Воздушно-цинковая батарейка
- — обычно используется в слуховых аппаратах.
- Термобатарея — высокотемпературный резерв. Почти исключительно военные приложения.
- Активируемая водой батарея — используется для радиозондов и аварийных приложений.
Аккумуляторы
Также известны как вторичные батареи или аккумуляторы.
- Свинцово-кислотный аккумулятор — обычно используется в транспортных средствах, системах сигнализации и источниках бесперебойного питания.
 Используется для использования в качестве «А» или «мокрой» батареи в радиоприемниках с лампами и лампами. Основным преимуществом этой химии является ее низкая стоимость — большая батарея (например, 70 Ач) относительно дешева по сравнению с другими химическими веществами. Однако этот химический состав батареи имеет более низкую плотность энергии, чем другие доступные сегодня химические составы батарей (см. ниже).
Используется для использования в качестве «А» или «мокрой» батареи в радиоприемниках с лампами и лампами. Основным преимуществом этой химии является ее низкая стоимость — большая батарея (например, 70 Ач) относительно дешева по сравнению с другими химическими веществами. Однако этот химический состав батареи имеет более низкую плотность энергии, чем другие доступные сегодня химические составы батарей (см. ниже).- Абсорбированный стеклянный мат — это класс свинцово-кислотных аккумуляторов, в которых электролит абсорбирован стекловолоконным матом. Гелевая батарея
- представляет собой перезаряжаемую свинцово-кислотную батарею с регулируемым клапаном и гелеобразным электролитом.
Литий-ионный аккумулятор - — относительно современный химический аккумулятор, который обеспечивает очень высокую плотность заряда (т. е. легкий аккумулятор будет хранить много энергии) и не страдает от какого-либо эффекта «памяти». Используется в ноутбуках (ноутбуках), современных телефонах с камерами, некоторых перезаряжаемых MP3-плеерах и большинстве других портативных перезаряжаемых цифровых устройств.
 Литий-ионный полимерный аккумулятор
Литий-ионный полимерный аккумулятор - — характеристики аналогичны литий-ионным, но с немного меньшей плотностью заряда. Этот химический состав батареи может быть использован для любой батареи в соответствии с потребностями производителя, например, для ультратонких (толщиной 1 мм) элементов для новейших КПК. Никель-кадмиевая батарея
- — используется во многих бытовых устройствах, но вытесняется литий-ионными и никель-металлогидридными батареями. Этот химический состав обеспечивает самый длительный срок службы (более 1500 циклов), но имеет низкую плотность энергии по сравнению с некоторыми другими химическими составами. Ni-Cd элементы, использующие более старую технологию, страдают от эффекта памяти, но в современных батареях этот эффект резко снижен. Аккумулятор NaS
- — (натрий-серный аккумулятор) представляет собой тип аккумулятора, изготовленного из натрия (Na) и серы (S). Аккумуляторы этого типа отличаются высокой плотностью энергии, высокой эффективностью заряда/разряда (89—92%), длительным сроком службы и изготавливаются из недорогих нетоксичных материалов.

- Никель-железная батарея — аккумуляторная батарея с катодом из оксида-гидроксида никеля(III) и железным анодом, с электролитом из гидроксида калия.
- Никель-металлогидридная батарея, сокращенно NiMH, представляет собой тип перезаряжаемой батареи, аналогичной никель-кадмиевой (NiCd) батарее, но в качестве анода вместо кадмия используется сплав, поглощающий водород.
- Натриево-металлическая хлоридная батарея, новый класс перезаряжаемых натриевых/бета-глиноземных батарей, в которых традиционный катод из жидкой серы заменен катодом из хлорированного железа или никеля в виде пористой металлической матрицы, пропитанной расплавленным хлоридом натрия-алюминия. Никель-цинковая батарея
- (иногда сокращенно NiZn) представляет собой тип перезаряжаемой батареи, обычно используемой в секторе легких электромобилей.
- Батарея с расплавленной солью — это класс высокотемпературных электрических батарей с первичным и вторичным элементами, в которых в качестве электролита используются расплавленные соли.

Самодельные элементы питания
Почти любой жидкий или влажный объект, содержащий достаточное количество ионов для обеспечения электропроводности, может служить электролитом для элемента питания. В качестве новинки или научной демонстрации можно вставить два электрода из разных металлов в лимон, картошку, стакан безалкогольного напитка и т. д. и генерировать небольшое количество электричества. По состоянию на 2005 год «часы с двумя картофелинами» широко доступны в магазинах хобби и игрушек; они состоят из пары ячеек, каждая из которых состоит из картофелины (лимона и т. д.) с двумя вставленными в нее электродами, соединенными последовательно, образуя батарею с достаточным напряжением для питания цифровых часов. Самодельные элементы такого типа не имеют реального практического применения, потому что они производят гораздо меньший ток и стоят гораздо больше на единицу произведенной энергии, чем коммерческие элементы, из-за необходимости частой замены фруктов или овощей. Кроме того, в серии из двух книг «Тайное использование для повседневных вещей» есть инструкции по изготовлению батареи из пятицентовой монеты, монеты и куска бумажного полотенца, смоченного в соленой воде. Каждый из них может выдавать до 0,3 вольта, и при использовании многих из них они могут заменить обычные батареи на короткое время.
Кроме того, в серии из двух книг «Тайное использование для повседневных вещей» есть инструкции по изготовлению батареи из пятицентовой монеты, монеты и куска бумажного полотенца, смоченного в соленой воде. Каждый из них может выдавать до 0,3 вольта, и при использовании многих из них они могут заменить обычные батареи на короткое время.
Свинцово-кислотные элементы можно легко изготовить в домашних условиях, но для «формирования» пластин требуется утомительный цикл зарядки/разрядки. Это процесс, при котором на пластинах образуется сульфат свинца, который во время зарядки превращается в диоксид свинца (положительная пластина) и чистый свинец (отрицательная пластина). Повторение этого процесса приводит к микроскопически шероховатой поверхности с гораздо большей площадью поверхности. Это увеличивает ток, который ячейка может обеспечить.
Тяговые батареи
Тяговые батареи (аккумуляторы или аккумуляторы) предназначены для обеспечения питания транспортных средств, таких как электромобиль или тягач. Основным соображением при проектировании является соотношение мощности и веса, поскольку автомобиль должен нести аккумулятор. В то время как использовались обычные свинцово-кислотные батареи с жидким электролитом, электролит в тяговых батареях часто загущен, чтобы предотвратить проливание. Электролит также может быть заключен в стекловату, которая намотана таким образом, что элементы имеют круглое поперечное сечение (тип AGM).
Основным соображением при проектировании является соотношение мощности и веса, поскольку автомобиль должен нести аккумулятор. В то время как использовались обычные свинцово-кислотные батареи с жидким электролитом, электролит в тяговых батареях часто загущен, чтобы предотвратить проливание. Электролит также может быть заключен в стекловату, которая намотана таким образом, что элементы имеют круглое поперечное сечение (тип AGM).
Типы аккумуляторов, используемых в электромобилях
- Обычная свинцово-кислотная батарея с жидким электролитом.
- Тип AGM (впитывающий стекломат)
- Zebra Na/NiCl 2 батарея, работающая при температуре 270 °C, требующая охлаждения в случае скачков температуры. Аккумулятор
- NiZn (более высокое напряжение элемента 1,6 В и, следовательно, увеличение удельной энергии на 25%, очень короткий срок службы).
Литий-ионные аккумуляторы в настоящее время вытесняют никель-металлгидридные аккумуляторы в этом секторе, в то время как свинцово-кислотные аккумуляторы по-прежнему играют ведущую роль с точки зрения низких инвестиционных затрат [5] .
Проточные батареи
Проточные батареи представляют собой особый класс батарей, в которых дополнительное количество электролита хранится вне основного силового элемента батареи и циркулирует через него с помощью насосов или путем движения. Проточные батареи могут иметь чрезвычайно большую емкость и используются в морских приложениях, а также приобретают все большую популярность в приложениях для хранения энергии в сетях.
Цинк-бромные и ванадиевые окислительно-восстановительные батареи являются типичными примерами коммерчески доступных проточных батарей.
Необслуживаемый аккумулятор (MF)
Аккумулятор MF (необслуживаемый) — это один из многих типов свинцово-кислотных аккумуляторов. Он стал популярным на мотоциклах, потому что его кислота впитывается в среду, разделяющую пластины, поэтому она не может пролиться, и эта среда также поддерживает пластины, что помогает им лучше противостоять вибрации.
Электрические характеристики аккумуляторов MF несколько отличаются от характеристик свинцово-кислотных аккумуляторов с жидкостными элементами, поэтому при их зарядке и разрядке следует соблюдать осторожность. Аккумуляторы MF не следует путать с аккумуляторами AGM (Absorbed Glass Mat), которые также имеют абсорбированный электролит, но опять же имеют другие электрические характеристики.
Аккумуляторы MF не следует путать с аккумуляторами AGM (Absorbed Glass Mat), которые также имеют абсорбированный электролит, но опять же имеют другие электрические характеристики.
Соображения по охране окружающей среды
С момента своего создания более 250 лет назад аккумуляторы остаются одними из самых дорогих источников энергии, а их производство требует много ценных ресурсов и часто использует опасные химические вещества. По этой причине во многих регионах теперь есть услуги по переработке аккумуляторов, которые позволяют восстановить некоторые из наиболее токсичных (а иногда и ценных) материалов из использованных аккумуляторов. Батареи могут быть опасными или смертельными при проглатывании.
Электрический компонент
Элементы батареи могут быть соединены параллельно, последовательно или и тем, и другим. Параллельная комбинация ячеек имеет то же напряжение, что и одиночная ячейка, но может обеспечивать более высокий ток (сумма токов от всех ячеек). Последовательная комбинация имеет тот же номинальный ток, что и одиночная ячейка, но ее напряжение представляет собой сумму напряжений всех ячеек. Наиболее практичные электрохимические батареи, такие как 9-вольтовые аккумуляторы для фонарей и 12-вольтовые автомобильные (автомобильные) аккумуляторы, имеют внутри корпуса несколько последовательно соединенных элементов. Параллельные схемы страдают от проблемы, заключающейся в том, что если одна ячейка разряжается быстрее, чем соседняя, ток будет течь от полной ячейки к пустой, что приведет к потере энергии и, возможно, к перегреву. Хуже того, если в одной ячейке произойдет короткое замыкание из-за внутренней неисправности, ее соседняя ячейка будет вынуждена отдать свой максимальный ток в неисправную ячейку, что приведет к перегреву и, возможно, взрыву. Поэтому параллельно подключенные элементы обычно оснащаются электронной схемой для защиты от этих проблем. Как в последовательном, так и в параллельном типах энергия, запасенная в батарее, равна сумме энергий, запасенных во всех элементах.
Последовательная комбинация имеет тот же номинальный ток, что и одиночная ячейка, но ее напряжение представляет собой сумму напряжений всех ячеек. Наиболее практичные электрохимические батареи, такие как 9-вольтовые аккумуляторы для фонарей и 12-вольтовые автомобильные (автомобильные) аккумуляторы, имеют внутри корпуса несколько последовательно соединенных элементов. Параллельные схемы страдают от проблемы, заключающейся в том, что если одна ячейка разряжается быстрее, чем соседняя, ток будет течь от полной ячейки к пустой, что приведет к потере энергии и, возможно, к перегреву. Хуже того, если в одной ячейке произойдет короткое замыкание из-за внутренней неисправности, ее соседняя ячейка будет вынуждена отдать свой максимальный ток в неисправную ячейку, что приведет к перегреву и, возможно, взрыву. Поэтому параллельно подключенные элементы обычно оснащаются электронной схемой для защиты от этих проблем. Как в последовательном, так и в параллельном типах энергия, запасенная в батарее, равна сумме энергий, запасенных во всех элементах.
Аккумулятор можно просто смоделировать как идеальный источник напряжения (т. е. источник с нулевым внутренним сопротивлением), включенный последовательно с резистором. Источник напряжения зависит главным образом от химического состава батареи, а не от того, разряжена она или полна. Когда батарея разряжается, ее внутреннее сопротивление увеличивается. Когда батарея подключена к нагрузке (например, лампочке), которая имеет собственное сопротивление, результирующее напряжение на нагрузке зависит от отношения внутреннего сопротивления батареи к сопротивлению нагрузки. Когда батарея свежая, ее внутреннее сопротивление низкое, поэтому напряжение на нагрузке почти равно напряжению внутреннего источника напряжения батареи. Когда батарея разряжается, а ее внутреннее сопротивление увеличивается, напряжение на ее внутреннем сопротивлении увеличивается, поэтому напряжение на ее клеммах уменьшается, и способность батареи отдавать мощность в нагрузку уменьшается.
См. также
- Алессандро Вольта
- Электричество
Примечания
- ↑ «Об электричестве, возбуждаемом простым контактом проводящих веществ различных видов».
 Достопочтенный сэр Джозеф Бэнкс, Барт KB PRS Прочитано 26 июня 1800 г.». Философские труды Лондонского королевского общества (1800): 403-431. Проверено 27 декабря 2017 г.
Достопочтенный сэр Джозеф Бэнкс, Барт KB PRS Прочитано 26 июня 1800 г.». Философские труды Лондонского королевского общества (1800): 403-431. Проверено 27 декабря 2017 г. - ↑ Corrosion-doctors.org Гастон Планте (1834–1889) Дата обращения 27 декабря 2017 г.
- ↑ Molecular Expressions Zinc-Carbon Batteries Дата обращения 27 декабря 2017 г.
- ↑ Энн-Мари Хелменстайн, Half-Cell Definition ThoughtCo. , 2017. Проверено 27 декабря 2017.
- ↑ Мэтейс, Дж. и В. Ван Аутенбур. Subat: Устойчивые батареи. Проверено 27 декабря 2017 г.
Ссылки
Ссылки ISBN поддерживают NWE за счет реферальных сборов
- Линден, Дэвид; Редди, Томас Б. Справочник по батареям . Нью-Йорк, штат Нью-Йорк: McGraw-Hill Professional, 2001. ISBN 0071359788 .
- Делл Р.М. и Д. Рэнд. Общие сведения о батареях . Лондон, Англия: Королевское химическое общество, 2001. ISBN 0854046054 .
- Бухманн, Исидор.
 Батареи в портативном мире: Справочник по перезаряжаемым батареям для не инженеров . Ричмонд, Британская Колумбия, Канада: Cadex Electronics, 2001. ISBN 0968211828
Батареи в портативном мире: Справочник по перезаряжаемым батареям для не инженеров . Ричмонд, Британская Колумбия, Канада: Cadex Electronics, 2001. ISBN 0968211828
Внешние ссылки
Все ссылки получены 31 декабря 2021 г.
- Беллис, Мэри. History Timeline of the Battery ThoughtCo , 2017.
Кредиты
New World Encyclopedia Авторы и редакторы переписали и дополнили статью Wikipedia в соответствии со стандартами New World Encyclopedia . Эта статья соответствует условиям лицензии Creative Commons CC-by-sa 3.0 (CC-by-sa), которая может использоваться и распространяться с надлежащим указанием авторства. Кредит должен соответствовать условиям этой лицензии, которая может ссылаться как на Энциклопедия Нового Света участников и самоотверженных добровольных участников Фонда Викимедиа. Чтобы процитировать эту статью, щелкните здесь, чтобы просмотреть список допустимых форматов цитирования. История более ранних вкладов википедистов доступна исследователям здесь:
История более ранних вкладов википедистов доступна исследователям здесь:
- Батарея_(электричество) история
- MF_Battery history
История этой статьи с момента ее импорта в New World Encyclopedia :
- История «Батарея (электричество)»
Примечание. На использование отдельных изображений, лицензированных отдельно, могут распространяться некоторые ограничения.
Батарея (электричество) — Энциклопедия Нового Света
Четыре гальванических элемента типа АА.
В науке и технике батарея — это устройство, которое накапливает химическую энергию и делает ее доступной в электрической форме. Батареи состоят из электрохимических устройств, таких как один или несколько гальванических элементов, топливных элементов или проточных элементов. Строго говоря, электрическая «батарея» представляет собой взаимосвязанный массив подобных ячеек, но термин «батарея» также обычно применяется к одной ячейке, которая используется сама по себе.
Содержание
- 1 История
- 2 Концепции аккумуляторов
- 2.1 Емкость аккумулятора
- 2.2 Срок службы батареи
- 2.3 Взрыв батареи
- 3 Типа батарей
- 3.1 Одноразовый
- 3.2 Аккумулятор
- 3.3 Самодельные клетки
- 3.4 Тяговые батареи
- 3.5 Проточные батареи
- 3.6 Необслуживаемая (MF) батарея
- 4 Экологические соображения
- 5 Электрический компонент
- 6 См. также
- 7 Примечания
- 8 Каталожные номера
- 9 Внешние ссылки
- 10 кредитов
Схема электрической батареи.
С развитием технологий были разработаны различные типы батарей для различных целей. Область их применения варьируется от портативных электронных устройств до автомобилей и космических зондов.
История
Самыми ранними известными артефактами, которые могли быть батареями, являются так называемые «Багдадские батареи», по-видимому, использовавшиеся в период между 250 9 г. 0063 г. до н. э. и 640 CE Термин «батарея» в этом контексте был впервые использован Бенджамином Франклином для описания набора связанных лейденских банок, первого конденсатора и раннего средства хранения заряда до изобретения настоящих электрохимических батарей.
0063 г. до н. э. и 640 CE Термин «батарея» в этом контексте был впервые использован Бенджамином Франклином для описания набора связанных лейденских банок, первого конденсатора и раннего средства хранения заряда до изобретения настоящих электрохимических батарей.
Современное развитие аккумуляторов началось с батареи Вольта, изобретенной итальянским физиком Алессандро Вольта, который анонсировал ее в 1800 году. [1] . Эта батарея состояла из стопки цинковых и медных дисков, разделенных пропитанным солевым раствором картоном.
Британский химик по имени Джон Фредерик Даниэлл искал способ устранить скопление газа в котле Вольта. Его решение состояло в том, чтобы использовать второй электролит для поглощения водорода, произведенного первым. В 1836 году он изобрел ячейку Даниэля, состоявшую из медного горшка, наполненного раствором сульфата меди, в который был погружен неглазурованный глиняный сосуд, наполненный серной кислотой, в которую был погружен цинковый электрод. До этого момента все батареи постоянно разряжались, когда их химические реакции заканчивались.
До этого момента все батареи постоянно разряжались, когда их химические реакции заканчивались.
В 1859 году Гастон Планте изобрел свинцово-кислотный элемент, первую батарею, которую можно было заряжать, пропуская через нее обратный ток. Свинцово-кислотный элемент состоит из свинцового анода и катода из оксида свинца, погруженных в серную кислоту. Оба электрода реагируют с кислотой с образованием сульфата свинца, но реакция на свинцовом аноде высвобождает электроны, а реакция на оксиде свинца поглощает их, создавая ток. Эти химические реакции можно обратить вспять, пропуская обратный ток через батарею, тем самым перезаряжая ее. Первая модель Планте состояла из листа свинца и листа оксида свинца, разделенных резиновыми полосками и скрученных в спираль. [2] Впервые его батареи использовались для питания освещения в вагонах поездов во время остановки на станции.
В 1881 году Камилла Фор изобрела улучшенную версию, которая состояла из решетки из свинцовой сетки, в которую была впрессована паста из оксида свинца, образующая пластину. Несколько пластин могут быть сложены для большей производительности. Эту конструкцию было легче производить серийно. К концу девятнадцатого века Карл Гасснер заменил жидкий электролит пастой, создав гораздо более практичную батарею для массового потребления.
Несколько пластин могут быть сложены для большей производительности. Эту конструкцию было легче производить серийно. К концу девятнадцатого века Карл Гасснер заменил жидкий электролит пастой, создав гораздо более практичную батарею для массового потребления.
В 1866 году Жорж Лекланше изобрел батарею, состоящую из цинкового анода, обернутого в пористый материал, и катода из диоксида марганца, погруженного в хлорид аммония. В катод из диоксида марганца также было добавлено немного углерода, что улучшало проводимость и абсорбцию электролита. [3]
В 1887 году Карл Гасснер запатентовал вариант элемента Лекланше, который стал известен как сухой элемент, поскольку в нем не было свободного жидкого электролита. Вместо этого хлорид аммония был смешан с гипсом для создания пасты с добавлением небольшого количества хлорида цинка для продления срока годности. Катод из диоксида марганца был погружен в эту пасту, и оба были запечатаны в цинковую оболочку, которая также действовала как анод.
На рубеже двадцатого века первые автомобили с бензиновым двигателем были ненадежными, а электромобили были более популярны. Однако их популярность была ограничена очень тяжелыми свинцово-кислотными батареями, на которых они работали. Надеясь создать более коммерчески жизнеспособный электромобиль, Томас Эдисон и его коллеги начали поиск более легкой и прочной перезаряжаемой батареи. В 1903 году в результате их исследований была получена батарея, состоящая из железных и никелевых электродов с гидроксидом калия в качестве электролита (отсюда и название «щелочная», хотя эту батарею чаще называют никель-железной батареей). Однако потребители обнаружили, что эта ранняя версия подвержена утечкам и имеет короткий срок службы; он также не намного превзошел свинцово-кислотную батарею. Эдисон вернулся к чертежной доске и через семь лет выпустил более надежную и мощную модель. К этому времени, однако, недорогая и надежная модель Ford T сделала автомобили с бензиновыми двигателями стандартом. Тем не менее батарея Эдисона добилась больших успехов в других областях применения.
Тем не менее батарея Эдисона добилась больших успехов в других областях применения.
Самый распространенный тип продаваемых сегодня батарей — щелочные батареи — был разработан в 1955 году компанией Eveready.
Концепции батарей
Символ цепи для батареи; упрощенная электрическая модель; и более сложная, но все же неполная модель (последовательный конденсатор имеет чрезвычайно большую емкость и при зарядке имитирует разряд батареи).
Батарея представляет собой устройство, в котором химическая энергия непосредственно преобразуется в электрическую энергию. Он состоит из одного или нескольких гальванических элементов, каждый из которых состоит из двух полуэлементов, соединенных последовательно токопроводящим электролитом 9.0069 [4] . На рисунке справа батарея состоит из одного или нескольких гальванических элементов, соединенных последовательно. Условный символ не обязательно представляет истинное количество гальванических элементов. Каждая ячейка имеет положительный вывод, показанный длинной горизонтальной линией, и отрицательный вывод, показанный более короткой горизонтальной линией. Они не соприкасаются друг с другом, а погружены в твердый или жидкий электролит.
Каждая ячейка имеет положительный вывод, показанный длинной горизонтальной линией, и отрицательный вывод, показанный более короткой горизонтальной линией. Они не соприкасаются друг с другом, а погружены в твердый или жидкий электролит.
Электролит представляет собой проводник, соединяющий полуэлементы между собой. Он также содержит ионы, которые могут реагировать с химическими веществами электродов. Химическая энергия преобразуется в электрическую в результате химических реакций, в результате которых происходит перенос заряда между электродом и электролитом на их границе раздела. Такие реакции называются Фарадея, и отвечают за протекание тока через ячейку. Обычные реакции без переноса заряда ( нефарадеевские ) реакции также происходят на границе раздела электрод-электролит. Нефарадеевские реакции являются одной из причин того, что гальванические элементы (особенно свинцово-кислотные элементы обычных автомобильных аккумуляторов) «разряжаются», когда они не используются.
Около 1800 года Алессандро Вольта изучал влияние различных электродов на результирующую электродвижущую силу (ЭДС) различных типов гальванических элементов. (ЭДС эквивалентна тому, что было названо внутренним источником напряжения в предыдущем разделе.) Он показал, что результирующая ЭДС (Е) представляет собой разность ЭДС Ε1 и Ε2, связанных с границами раздела электролит-электрод внутри двух полуячеек. Следовательно, одинаковые электроды дают Е=0 (нулевую ЭДС). Вольта не понимал, что ЭДС возникает из-за химических реакций. Он думал, что его клетки были неисчерпаемым источником энергии и что связанные с ними химические эффекты (например, коррозия) были просто неприятностью, а не неизбежным побочным продуктом их работы, как показал Майкл Фарадей примерно в 1830 году.
Гальванические элементы и батареи гальванических элементов измеряются в вольтах, единицах СИ для электродвижущей силы. Напряжение на клеммах батареи известно как напряжение на клеммах . Напряжение на клеммах батареи, которая не заряжается и не разряжается (напряжение холостого хода), равно ее ЭДС. Напряжение на клеммах разряжающейся батареи меньше ЭДС, а у заряжающейся батареи больше ЭДС.
Напряжение на клеммах разряжающейся батареи меньше ЭДС, а у заряжающейся батареи больше ЭДС.
Щелочные и угольно-цинковые элементы рассчитаны примерно на 1,5 вольт каждый из-за характера химических реакций в них. Для сравнения, учитывая высокие электрохимические потенциалы соединений лития, литиевые элементы могут обеспечивать до 3 и более вольт каждый. Однако соединения лития могут быть опасны.
Традиционная модель гальванического элемента, показанная выше, имеет внутреннее сопротивление, выведенное за пределы элемента. Это правильный эквивалент Thevenin для схемных приложений, но он чрезмерно упрощает химию и физику. В более точной (и более сложной) модели гальванический элемент можно представить как два электрических насоса, по одному на каждом выводе (фарадеевские реакции на соответствующих границах раздела электрод-электролит), разделенных внутренним сопротивлением, в значительной степени обусловленным электролитом. . Даже это является чрезмерным упрощением, поскольку оно не может объяснить, почему поведение гальванического элемента сильно зависит от скорости его разряда. Например, хорошо известно, что быстро (но не полностью) разряжаемая ячейка самопроизвольно восстанавливается после некоторого времени ожидания, а медленно (но полностью) разряжаемая ячейка самопроизвольно не восстанавливается.
Например, хорошо известно, что быстро (но не полностью) разряжаемая ячейка самопроизвольно восстанавливается после некоторого времени ожидания, а медленно (но полностью) разряжаемая ячейка самопроизвольно не восстанавливается.
Простейшая характеристика батареи — ее ЭДС (напряжение), внутреннее сопротивление и емкость. В принципе, энергия, запасенная батареей, равна произведению ее ЭДС на емкость.
Емкость батареи
Учитывая, что напряжение батареи относительно постоянно, способность батареи сохранять энергию часто выражается в терминах общего количества заряда, способного пройти через устройство. Это выражается в ампер-часов, , где один А·ч равен 3600 кулонам. Если батарея может качать заряд в течение одного часа со скоростью один кулон/сек или один ампер (1 А), ее емкость составляет 1 А·ч. Если он может обеспечить 1 А в течение 100 часов, его емкость составляет 100 А·ч. Чем больше электролита и электродного материала в ячейке, тем больше емкость ячейки. Таким образом, крошечная ячейка имеет гораздо меньшую емкость, чем ячейка гораздо большего размера, даже если обе они основаны на одних и тех же химических реакциях (например, щелочные элементы), которые производят одинаковое напряжение на клеммах. Из-за химических реакций внутри ячеек емкость батареи зависит от условий разрядки, таких как величина тока, продолжительность тока, допустимое напряжение на клеммах батареи, температура и другие факторы.
Таким образом, крошечная ячейка имеет гораздо меньшую емкость, чем ячейка гораздо большего размера, даже если обе они основаны на одних и тех же химических реакциях (например, щелочные элементы), которые производят одинаковое напряжение на клеммах. Из-за химических реакций внутри ячеек емкость батареи зависит от условий разрядки, таких как величина тока, продолжительность тока, допустимое напряжение на клеммах батареи, температура и другие факторы.
Производители аккумуляторов используют стандартный метод определения рейтинга своих аккумуляторов. Батарея разряжается постоянным током в течение фиксированного периода времени, например, 10 или 20 часов, до установленного напряжения на клеммах на элемент. Таким образом, батарея на 100 ампер-часов рассчитана на 5 А в течение 20 часов при комнатной температуре. Эффективность батареи различна при разных скоростях разряда. При низком уровне разряда энергия батареи передается более эффективно, чем при более высоких скоростях разряда. Это известно как закон Пейкерта.
Срок службы батареи
Даже если одноразовые (или «первичные») батареи никогда не вынимались из оригинальной упаковки, они могут терять от двух до двадцати пяти процентов своего первоначального заряда каждый год. Эта скорость существенно зависит от температуры, поскольку обычно химические реакции протекают быстрее при повышении температуры. Это известно как скорость «саморазряда» и связано с нефарадеевскими (не производящими ток) химическими реакциями, которые происходят внутри элемента, даже если к нему не приложена нагрузка. Батареи следует хранить при прохладных или низких температурах, чтобы уменьшить скорость побочных реакций. Например, некоторые люди хранят неиспользованные батареи в своих холодильниках, чтобы продлить срок их службы, хотя следует соблюдать осторожность, чтобы батареи не замерзли. Чрезвычайно высокие или низкие температуры снижают производительность батареи.
Перезаряжаемые батареи саморазряжаются быстрее, чем одноразовые щелочные батареи; до трех процентов в сутки (в зависимости от температуры). Из-за их короткого срока годности их не следует оставлять в ящике стола, а затем полагаться на них для питания фонарика или небольшого радио в чрезвычайной ситуации. По этой причине рекомендуется держать под рукой несколько щелочных батареек. Ni-Cd аккумуляторы почти всегда «разряжены», когда вы их покупаете, и их необходимо зарядить перед первым использованием.
Из-за их короткого срока годности их не следует оставлять в ящике стола, а затем полагаться на них для питания фонарика или небольшого радио в чрезвычайной ситуации. По этой причине рекомендуется держать под рукой несколько щелочных батареек. Ni-Cd аккумуляторы почти всегда «разряжены», когда вы их покупаете, и их необходимо зарядить перед первым использованием.
Большинство NiMH и NiCd аккумуляторов можно заряжать несколько сотен раз. Кроме того, они оба могут быть полностью разряжены, а затем перезаряжены без повреждения или укорочения их емкости.
Автомобильные свинцово-кислотные аккумуляторные батареи имеют гораздо более тяжелый срок службы. Из-за вибрации, ударов, тепла, холода и сульфатации свинцовых пластин немногие автомобильные аккумуляторы служат более шести лет при регулярном использовании. Автомобильные стартерные аккумуляторы имеют множество тонких пластин, чтобы обеспечить как можно больше ампер в достаточно небольшом корпусе, и разряжаются лишь на небольшое количество перед немедленной зарядкой. Следует соблюдать осторожность, чтобы избежать глубокой разрядки стартерной батареи, так как в процессе перезарядки небольшое количество свинца расплавляется с пластин. Когда в пластинах образуются отверстия, это приводит к меньшей площади поверхности для химической реакции, что приводит к меньшему измеренному напряжению. Если оставить свинцово-кислотную батарею в глубоко разряженном состоянии на любой период времени, сульфат лучше прилипнет к пластине, что затруднит удаление сульфата в процессе зарядки. Это может привести к меньшей доступной поверхности пластины и, как следствие, к более низкому напряжению, что сократит срок службы батареи. Свинцово-кислотные батареи «глубокого цикла», такие как те, которые используются в электрических тележках для гольфа, имеют гораздо более толстые пластины, что увеличивает их долговечность. Основным преимуществом свинцово-кислотных является их низкая стоимость, основными недостатками являются их большие габариты и масса при заданной емкости и напряжении.
Следует соблюдать осторожность, чтобы избежать глубокой разрядки стартерной батареи, так как в процессе перезарядки небольшое количество свинца расплавляется с пластин. Когда в пластинах образуются отверстия, это приводит к меньшей площади поверхности для химической реакции, что приводит к меньшему измеренному напряжению. Если оставить свинцово-кислотную батарею в глубоко разряженном состоянии на любой период времени, сульфат лучше прилипнет к пластине, что затруднит удаление сульфата в процессе зарядки. Это может привести к меньшей доступной поверхности пластины и, как следствие, к более низкому напряжению, что сократит срок службы батареи. Свинцово-кислотные батареи «глубокого цикла», такие как те, которые используются в электрических тележках для гольфа, имеют гораздо более толстые пластины, что увеличивает их долговечность. Основным преимуществом свинцово-кислотных является их низкая стоимость, основными недостатками являются их большие габариты и масса при заданной емкости и напряжении. Свинцово-кислотные аккумуляторы никогда не следует разряжать ниже 20% их полной емкости, так как внутреннее сопротивление приведет к нагреву и повреждению при попытке их перезарядки. В свинцово-кислотных системах глубокого цикла часто используется сигнальная лампа низкого заряда или выключатель питания при низком заряде, чтобы предотвратить повреждение, которое сократит срок службы батареи.
Свинцово-кислотные аккумуляторы никогда не следует разряжать ниже 20% их полной емкости, так как внутреннее сопротивление приведет к нагреву и повреждению при попытке их перезарядки. В свинцово-кислотных системах глубокого цикла часто используется сигнальная лампа низкого заряда или выключатель питания при низком заряде, чтобы предотвратить повреждение, которое сократит срок службы батареи.
Специальные «резервные» батареи, предназначенные для длительного хранения в аварийном снаряжении или боеприпасах, удерживают электролит батареи отдельно от пластин до активации батареи, что позволяет заполнить ячейки электролитом. Сроки хранения таких батарей могут составлять годы или десятилетия. Однако их конструкция дороже, чем у более распространенных форм.
Взрыв батареи
Взрыв батареи происходит из-за неправильного использования или неисправности батареи, например, при попытке зарядить основную батарею или коротком замыкании батареи. С автомобильными аккумуляторами взрывы, скорее всего, произойдут, когда короткое замыкание генерирует очень большие токи. Кроме того, автомобильные аккумуляторы выделяют водород при перезарядке (из-за электролиза воды в электролите). Обычно количество перезарядки очень мало, как и количество образовавшегося взрывоопасного газа, и газ быстро рассеивается. Однако при «перепрыгивании» автомобильного аккумулятора большой ток может вызвать быстрое выделение больших объемов водорода, который может воспламениться от близко расположенной искры (например, при снятии соединительных кабелей).
Кроме того, автомобильные аккумуляторы выделяют водород при перезарядке (из-за электролиза воды в электролите). Обычно количество перезарядки очень мало, как и количество образовавшегося взрывоопасного газа, и газ быстро рассеивается. Однако при «перепрыгивании» автомобильного аккумулятора большой ток может вызвать быстрое выделение больших объемов водорода, который может воспламениться от близко расположенной искры (например, при снятии соединительных кабелей).
Когда батарея перезаряжается с чрезмерной скоростью, взрывоопасная газовая смесь водорода и кислорода может образовываться быстрее, чем она может выйти из стен батареи, что приводит к повышению давления и возможности разрыва корпуса батареи. . В экстремальных случаях аккумуляторная кислота может сильно выплеснуться из корпуса аккумулятора и нанести травму.
Кроме того, выброс батареи в огонь может привести к взрыву из-за скопления пара внутри герметичного корпуса батареи.
Перезарядка, то есть попытка зарядить батарею сверх ее электрической емкости, также может привести к взрыву батареи, протечке или необратимому повреждению батареи. Это также может привести к повреждению зарядного устройства или устройства, в котором впоследствии будет использоваться перезаряженная батарея.
Это также может привести к повреждению зарядного устройства или устройства, в котором впоследствии будет использоваться перезаряженная батарея.
Типы батарей
Различные батареи (по часовой стрелке снизу слева): две 9-вольтовые, две «AA», одна «D», аккумулятор для беспроводного телефона, аккумулятор для видеокамеры, двухметровый аккумулятор для портативного радиолюбителя и батарейка-таблетка, одна «C» и две «AAA», плюс четверть доллара США для шкалы 9.0003
Сверху вниз: два таблеточных элемента, 9-вольтовая батарея PP3, батарея AAA , батарея AA , батарея C , батарея D , большая батарея 3R12
9 По крайней мере, с точки зрения пользователя, батареи можно разделить на два основных типа — перезаряжаемые и неперезаряжаемые (одноразовые). Каждый широко используется.
Одноразовые батареи, также называемые первичными элементами , предназначены для однократного использования и утилизации. Чаще всего они используются в портативных устройствах с низким потреблением тока, используются только с перерывами или используются вдали от альтернативного источника питания. Первичные ячейки также обычно использовались для цепей сигнализации и связи, где другая электроэнергия была доступна только с перерывами. Первичные элементы нельзя надежно перезарядить, поскольку химические реакции необратимы. Производители аккумуляторов не рекомендуют пытаться заряжать первичные элементы, хотя некоторые энтузиасты электроники утверждают, что это возможно сделать с помощью зарядного устройства специального типа.
Чаще всего они используются в портативных устройствах с низким потреблением тока, используются только с перерывами или используются вдали от альтернативного источника питания. Первичные ячейки также обычно использовались для цепей сигнализации и связи, где другая электроэнергия была доступна только с перерывами. Первичные элементы нельзя надежно перезарядить, поскольку химические реакции необратимы. Производители аккумуляторов не рекомендуют пытаться заряжать первичные элементы, хотя некоторые энтузиасты электроники утверждают, что это возможно сделать с помощью зарядного устройства специального типа.
В отличие от перезаряжаемых батарей или вторичных элементов , можно перезарядить после того, как они были разряжены. Это делается путем подачи внешнего электрического тока, который обращает вспять химические реакции, происходящие при использовании. Устройства для подачи соответствующего тока называются зарядными устройствами или зарядными устройствами.
Самая старая форма перезаряжаемой батареи, которая до сих пор используется в современном мире, — это свинцово-кислотная батарея с жидкостными элементами. Эта батарея примечательна тем, что она содержит жидкость в незапечатанном контейнере, что требует, чтобы батарея находилась в вертикальном положении, а помещение хорошо вентилировалось, чтобы обеспечить безопасное рассеивание газообразного водорода, который выделяется этими батареями во время перезарядки. Свинцово-кислотная батарея также очень тяжела для количества электроэнергии, которую она может обеспечить. Несмотря на это, его низкая стоимость производства и высокие уровни импульсного тока делают его широко используемым там, где требуется большая емкость (более 10 Ач) или где вес и простота обращения не имеют значения.
Эта батарея примечательна тем, что она содержит жидкость в незапечатанном контейнере, что требует, чтобы батарея находилась в вертикальном положении, а помещение хорошо вентилировалось, чтобы обеспечить безопасное рассеивание газообразного водорода, который выделяется этими батареями во время перезарядки. Свинцово-кислотная батарея также очень тяжела для количества электроэнергии, которую она может обеспечить. Несмотря на это, его низкая стоимость производства и высокие уровни импульсного тока делают его широко используемым там, где требуется большая емкость (более 10 Ач) или где вес и простота обращения не имеют значения.
Распространенной формой свинцово-кислотных аккумуляторов являются современные автомобильные аккумуляторы с жидкостными элементами. Он может обеспечивать мощность около 10 000 Вт в течение короткого периода времени и имеет пиковый выходной ток, который варьируется от 450 до 1100 ампер. Усовершенствованный тип свинцово-кислотного аккумулятора, называемый гелевым аккумулятором (или «гелевым элементом»), стал популярным в автомобильной промышленности в качестве замены свинцово-кислотного жидкостного элемента. Гелевый аккумулятор содержит полутвердый электролит, предотвращающий проливание, испарение электролита и выделение газов, а также значительно повышающий его устойчивость к повреждениям от вибрации и тепла. Другой тип батареи, Absorbed Glass Mat (AGM) суспендирует электролит в специальном мате из стекловолокна для достижения аналогичных результатов. Более портативные перезаряжаемые батареи включают несколько типов «сухих элементов», которые представляют собой герметичные блоки и поэтому используются в таких устройствах, как мобильные телефоны и ноутбуки. Элементы этого типа (в порядке увеличения удельной мощности и стоимости) включают никель-кадмиевые (NiCd), никель-металлогидридные (NiMH) и литий-ионные (Li-Ion) элементы.
Гелевый аккумулятор содержит полутвердый электролит, предотвращающий проливание, испарение электролита и выделение газов, а также значительно повышающий его устойчивость к повреждениям от вибрации и тепла. Другой тип батареи, Absorbed Glass Mat (AGM) суспендирует электролит в специальном мате из стекловолокна для достижения аналогичных результатов. Более портативные перезаряжаемые батареи включают несколько типов «сухих элементов», которые представляют собой герметичные блоки и поэтому используются в таких устройствах, как мобильные телефоны и ноутбуки. Элементы этого типа (в порядке увеличения удельной мощности и стоимости) включают никель-кадмиевые (NiCd), никель-металлогидридные (NiMH) и литий-ионные (Li-Ion) элементы.
Одноразовые
Не предназначены для перезарядки — иногда их называют «первичными элементами».
- Цинк-угольная батарея — средняя стоимость — используется в приложениях с небольшим энергопотреблением.
- Цинк-хлоридная батарея — похожа на угольно-цинковую, но с немного более длительным сроком службы.

- Щелочные батареи — щелочные / марганцевые батареи с длительным сроком службы, широко используемые как в устройствах с низким, так и с большим энергопотреблением.
- Аккумулятор из оксида серебра — обычно используется в слуховых аппаратах. Литиевая батарея
- — обычно используется в цифровых камерах. Иногда используется в часах и компьютерных часах. Очень долгий срок службы (до десяти лет в наручных часах) и способный выдавать большие токи, но дорогой. Батарейка
- Mercury — обычно используется в цифровых часах. Воздушно-цинковая батарейка
- — обычно используется в слуховых аппаратах.
- Термобатарея — высокотемпературный резерв. Почти исключительно военные приложения.
- Активируемая водой батарея — используется для радиозондов и аварийных приложений.
Аккумуляторы
Также известны как вторичные батареи или аккумуляторы.
- Свинцово-кислотный аккумулятор — обычно используется в транспортных средствах, системах сигнализации и источниках бесперебойного питания.
 Используется для использования в качестве «А» или «мокрой» батареи в радиоприемниках с лампами и лампами. Основным преимуществом этой химии является ее низкая стоимость — большая батарея (например, 70 Ач) относительно дешева по сравнению с другими химическими веществами. Однако этот химический состав батареи имеет более низкую плотность энергии, чем другие доступные сегодня химические составы батарей (см. ниже).
Используется для использования в качестве «А» или «мокрой» батареи в радиоприемниках с лампами и лампами. Основным преимуществом этой химии является ее низкая стоимость — большая батарея (например, 70 Ач) относительно дешева по сравнению с другими химическими веществами. Однако этот химический состав батареи имеет более низкую плотность энергии, чем другие доступные сегодня химические составы батарей (см. ниже).- Абсорбированный стеклянный мат — это класс свинцово-кислотных аккумуляторов, в которых электролит абсорбирован стекловолоконным матом. Гелевая батарея
- представляет собой перезаряжаемую свинцово-кислотную батарею с регулируемым клапаном и гелеобразным электролитом.
Литий-ионный аккумулятор - — относительно современный химический аккумулятор, который обеспечивает очень высокую плотность заряда (т. е. легкий аккумулятор будет хранить много энергии) и не страдает от какого-либо эффекта «памяти». Используется в ноутбуках (ноутбуках), современных телефонах с камерами, некоторых перезаряжаемых MP3-плеерах и большинстве других портативных перезаряжаемых цифровых устройств.
 Литий-ионный полимерный аккумулятор
Литий-ионный полимерный аккумулятор - — характеристики аналогичны литий-ионным, но с немного меньшей плотностью заряда. Этот химический состав батареи может быть использован для любой батареи в соответствии с потребностями производителя, например, для ультратонких (толщиной 1 мм) элементов для новейших КПК. Никель-кадмиевая батарея
- — используется во многих бытовых устройствах, но вытесняется литий-ионными и никель-металлогидридными батареями. Этот химический состав обеспечивает самый длительный срок службы (более 1500 циклов), но имеет низкую плотность энергии по сравнению с некоторыми другими химическими составами. Ni-Cd элементы, использующие более старую технологию, страдают от эффекта памяти, но в современных батареях этот эффект резко снижен. Аккумулятор NaS
- — (натрий-серный аккумулятор) представляет собой тип аккумулятора, изготовленного из натрия (Na) и серы (S). Аккумуляторы этого типа отличаются высокой плотностью энергии, высокой эффективностью заряда/разряда (89—92%), длительным сроком службы и изготавливаются из недорогих нетоксичных материалов.

- Никель-железная батарея — аккумуляторная батарея с катодом из оксида-гидроксида никеля(III) и железным анодом, с электролитом из гидроксида калия.
- Никель-металлогидридная батарея, сокращенно NiMH, представляет собой тип перезаряжаемой батареи, аналогичной никель-кадмиевой (NiCd) батарее, но в качестве анода вместо кадмия используется сплав, поглощающий водород.
- Натриево-металлическая хлоридная батарея, новый класс перезаряжаемых натриевых/бета-глиноземных батарей, в которых традиционный катод из жидкой серы заменен катодом из хлорированного железа или никеля в виде пористой металлической матрицы, пропитанной расплавленным хлоридом натрия-алюминия. Никель-цинковая батарея
- (иногда сокращенно NiZn) представляет собой тип перезаряжаемой батареи, обычно используемой в секторе легких электромобилей.
- Батарея с расплавленной солью — это класс высокотемпературных электрических батарей с первичным и вторичным элементами, в которых в качестве электролита используются расплавленные соли.

Самодельные элементы питания
Почти любой жидкий или влажный объект, содержащий достаточное количество ионов для обеспечения электропроводности, может служить электролитом для элемента питания. В качестве новинки или научной демонстрации можно вставить два электрода из разных металлов в лимон, картошку, стакан безалкогольного напитка и т. д. и генерировать небольшое количество электричества. По состоянию на 2005 год «часы с двумя картофелинами» широко доступны в магазинах хобби и игрушек; они состоят из пары ячеек, каждая из которых состоит из картофелины (лимона и т. д.) с двумя вставленными в нее электродами, соединенными последовательно, образуя батарею с достаточным напряжением для питания цифровых часов. Самодельные элементы такого типа не имеют реального практического применения, потому что они производят гораздо меньший ток и стоят гораздо больше на единицу произведенной энергии, чем коммерческие элементы, из-за необходимости частой замены фруктов или овощей. Кроме того, в серии из двух книг «Тайное использование для повседневных вещей» есть инструкции по изготовлению батареи из пятицентовой монеты, монеты и куска бумажного полотенца, смоченного в соленой воде. Каждый из них может выдавать до 0,3 вольта, и при использовании многих из них они могут заменить обычные батареи на короткое время.
Кроме того, в серии из двух книг «Тайное использование для повседневных вещей» есть инструкции по изготовлению батареи из пятицентовой монеты, монеты и куска бумажного полотенца, смоченного в соленой воде. Каждый из них может выдавать до 0,3 вольта, и при использовании многих из них они могут заменить обычные батареи на короткое время.
Свинцово-кислотные элементы можно легко изготовить в домашних условиях, но для «формирования» пластин требуется утомительный цикл зарядки/разрядки. Это процесс, при котором на пластинах образуется сульфат свинца, который во время зарядки превращается в диоксид свинца (положительная пластина) и чистый свинец (отрицательная пластина). Повторение этого процесса приводит к микроскопически шероховатой поверхности с гораздо большей площадью поверхности. Это увеличивает ток, который ячейка может обеспечить.
Тяговые батареи
Тяговые батареи (аккумуляторы или аккумуляторы) предназначены для обеспечения питания транспортных средств, таких как электромобиль или тягач. Основным соображением при проектировании является соотношение мощности и веса, поскольку автомобиль должен нести аккумулятор. В то время как использовались обычные свинцово-кислотные батареи с жидким электролитом, электролит в тяговых батареях часто загущен, чтобы предотвратить проливание. Электролит также может быть заключен в стекловату, которая намотана таким образом, что элементы имеют круглое поперечное сечение (тип AGM).
Основным соображением при проектировании является соотношение мощности и веса, поскольку автомобиль должен нести аккумулятор. В то время как использовались обычные свинцово-кислотные батареи с жидким электролитом, электролит в тяговых батареях часто загущен, чтобы предотвратить проливание. Электролит также может быть заключен в стекловату, которая намотана таким образом, что элементы имеют круглое поперечное сечение (тип AGM).
Типы аккумуляторов, используемых в электромобилях
- Обычная свинцово-кислотная батарея с жидким электролитом.
- Тип AGM (впитывающий стекломат)
- Zebra Na/NiCl 2 батарея, работающая при температуре 270 °C, требующая охлаждения в случае скачков температуры. Аккумулятор
- NiZn (более высокое напряжение элемента 1,6 В и, следовательно, увеличение удельной энергии на 25%, очень короткий срок службы).
Литий-ионные аккумуляторы в настоящее время вытесняют никель-металлгидридные аккумуляторы в этом секторе, в то время как свинцово-кислотные аккумуляторы по-прежнему играют ведущую роль с точки зрения низких инвестиционных затрат [5] .
Проточные батареи
Проточные батареи представляют собой особый класс батарей, в которых дополнительное количество электролита хранится вне основного силового элемента батареи и циркулирует через него с помощью насосов или путем движения. Проточные батареи могут иметь чрезвычайно большую емкость и используются в морских приложениях, а также приобретают все большую популярность в приложениях для хранения энергии в сетях.
Цинк-бромные и ванадиевые окислительно-восстановительные батареи являются типичными примерами коммерчески доступных проточных батарей.
Необслуживаемый аккумулятор (MF)
Аккумулятор MF (необслуживаемый) — это один из многих типов свинцово-кислотных аккумуляторов. Он стал популярным на мотоциклах, потому что его кислота впитывается в среду, разделяющую пластины, поэтому она не может пролиться, и эта среда также поддерживает пластины, что помогает им лучше противостоять вибрации.
Электрические характеристики аккумуляторов MF несколько отличаются от характеристик свинцово-кислотных аккумуляторов с жидкостными элементами, поэтому при их зарядке и разрядке следует соблюдать осторожность. Аккумуляторы MF не следует путать с аккумуляторами AGM (Absorbed Glass Mat), которые также имеют абсорбированный электролит, но опять же имеют другие электрические характеристики.
Аккумуляторы MF не следует путать с аккумуляторами AGM (Absorbed Glass Mat), которые также имеют абсорбированный электролит, но опять же имеют другие электрические характеристики.
Соображения по охране окружающей среды
С момента своего создания более 250 лет назад аккумуляторы остаются одними из самых дорогих источников энергии, а их производство требует много ценных ресурсов и часто использует опасные химические вещества. По этой причине во многих регионах теперь есть услуги по переработке аккумуляторов, которые позволяют восстановить некоторые из наиболее токсичных (а иногда и ценных) материалов из использованных аккумуляторов. Батареи могут быть опасными или смертельными при проглатывании.
Электрический компонент
Элементы батареи могут быть соединены параллельно, последовательно или и тем, и другим. Параллельная комбинация ячеек имеет то же напряжение, что и одиночная ячейка, но может обеспечивать более высокий ток (сумма токов от всех ячеек). Последовательная комбинация имеет тот же номинальный ток, что и одиночная ячейка, но ее напряжение представляет собой сумму напряжений всех ячеек. Наиболее практичные электрохимические батареи, такие как 9-вольтовые аккумуляторы для фонарей и 12-вольтовые автомобильные (автомобильные) аккумуляторы, имеют внутри корпуса несколько последовательно соединенных элементов. Параллельные схемы страдают от проблемы, заключающейся в том, что если одна ячейка разряжается быстрее, чем соседняя, ток будет течь от полной ячейки к пустой, что приведет к потере энергии и, возможно, к перегреву. Хуже того, если в одной ячейке произойдет короткое замыкание из-за внутренней неисправности, ее соседняя ячейка будет вынуждена отдать свой максимальный ток в неисправную ячейку, что приведет к перегреву и, возможно, взрыву. Поэтому параллельно подключенные элементы обычно оснащаются электронной схемой для защиты от этих проблем. Как в последовательном, так и в параллельном типах энергия, запасенная в батарее, равна сумме энергий, запасенных во всех элементах.
Последовательная комбинация имеет тот же номинальный ток, что и одиночная ячейка, но ее напряжение представляет собой сумму напряжений всех ячеек. Наиболее практичные электрохимические батареи, такие как 9-вольтовые аккумуляторы для фонарей и 12-вольтовые автомобильные (автомобильные) аккумуляторы, имеют внутри корпуса несколько последовательно соединенных элементов. Параллельные схемы страдают от проблемы, заключающейся в том, что если одна ячейка разряжается быстрее, чем соседняя, ток будет течь от полной ячейки к пустой, что приведет к потере энергии и, возможно, к перегреву. Хуже того, если в одной ячейке произойдет короткое замыкание из-за внутренней неисправности, ее соседняя ячейка будет вынуждена отдать свой максимальный ток в неисправную ячейку, что приведет к перегреву и, возможно, взрыву. Поэтому параллельно подключенные элементы обычно оснащаются электронной схемой для защиты от этих проблем. Как в последовательном, так и в параллельном типах энергия, запасенная в батарее, равна сумме энергий, запасенных во всех элементах.
Аккумулятор можно просто смоделировать как идеальный источник напряжения (т. е. источник с нулевым внутренним сопротивлением), включенный последовательно с резистором. Источник напряжения зависит главным образом от химического состава батареи, а не от того, разряжена она или полна. Когда батарея разряжается, ее внутреннее сопротивление увеличивается. Когда батарея подключена к нагрузке (например, лампочке), которая имеет собственное сопротивление, результирующее напряжение на нагрузке зависит от отношения внутреннего сопротивления батареи к сопротивлению нагрузки. Когда батарея свежая, ее внутреннее сопротивление низкое, поэтому напряжение на нагрузке почти равно напряжению внутреннего источника напряжения батареи. Когда батарея разряжается, а ее внутреннее сопротивление увеличивается, напряжение на ее внутреннем сопротивлении увеличивается, поэтому напряжение на ее клеммах уменьшается, и способность батареи отдавать мощность в нагрузку уменьшается.
См. также
- Алессандро Вольта
- Электричество
Примечания
- ↑ «Об электричестве, возбуждаемом простым контактом проводящих веществ различных видов».
 Достопочтенный сэр Джозеф Бэнкс, Барт KB PRS Прочитано 26 июня 1800 г.». Философские труды Лондонского королевского общества (1800): 403-431. Проверено 27 декабря 2017 г.
Достопочтенный сэр Джозеф Бэнкс, Барт KB PRS Прочитано 26 июня 1800 г.». Философские труды Лондонского королевского общества (1800): 403-431. Проверено 27 декабря 2017 г. - ↑ Corrosion-doctors.org Гастон Планте (1834–1889) Дата обращения 27 декабря 2017 г.
- ↑ Molecular Expressions Zinc-Carbon Batteries Дата обращения 27 декабря 2017 г.
- ↑ Энн-Мари Хелменстайн, Half-Cell Definition ThoughtCo. , 2017. Проверено 27 декабря 2017.
- ↑ Мэтейс, Дж. и В. Ван Аутенбур. Subat: Устойчивые батареи. Проверено 27 декабря 2017 г.
Ссылки
Ссылки ISBN поддерживают NWE за счет реферальных сборов
- Линден, Дэвид; Редди, Томас Б. Справочник по батареям . Нью-Йорк, штат Нью-Йорк: McGraw-Hill Professional, 2001. ISBN 0071359788 .
- Делл Р.М. и Д. Рэнд. Общие сведения о батареях . Лондон, Англия: Королевское химическое общество, 2001. ISBN 0854046054 .
- Бухманн, Исидор.
 Батареи в портативном мире: Справочник по перезаряжаемым батареям для не инженеров . Ричмонд, Британская Колумбия, Канада: Cadex Electronics, 2001. ISBN 0968211828
Батареи в портативном мире: Справочник по перезаряжаемым батареям для не инженеров . Ричмонд, Британская Колумбия, Канада: Cadex Electronics, 2001. ISBN 0968211828
Внешние ссылки
Все ссылки получены 31 декабря 2021 г.
- Беллис, Мэри. History Timeline of the Battery ThoughtCo , 2017.
Кредиты
New World Encyclopedia Авторы и редакторы переписали и дополнили статью Wikipedia в соответствии со стандартами New World Encyclopedia . Эта статья соответствует условиям лицензии Creative Commons CC-by-sa 3.0 (CC-by-sa), которая может использоваться и распространяться с надлежащим указанием авторства. Кредит должен соответствовать условиям этой лицензии, которая может ссылаться как на Энциклопедия Нового Света участников и самоотверженных добровольных участников Фонда Викимедиа. Чтобы процитировать эту статью, щелкните здесь, чтобы просмотреть список допустимых форматов цитирования.
