способ получения кислорода №1
Самым хороший способ получения кислорода в домашней лаборатории: нам послужит перманганат калия и перекись водорода (низкопроцентный водный раствор перекиси водорода есть то преимущество, что процесс выделения кислорода протекает бурно при доведении ее до температуры около 70°С.
способ получения кислорода №2
Кислород можно получать из перекиси водорода и без ее нагревания. Для этого воспользуемся катализатором, то есть веществом, ускоряющим химическую реакцию. В качестве катализатора возьмем разведенный раствор хлорного железа. Мы уже применяли этот реактив при проявлении симпатических чернил. Напомню, что это соединение можно получить, растворив небольшое количество железных опилок в соляной кислоте и прокипятив раствор с небольшим количеством пер-гидрола, то есть 30-процентного раствора перекиси водорода.
В две пробирки или два аптечных пузырька, влей несколько миллилитров перекиси водорода, которую можно купить в аптеке. В одну из пробирок добавь 3 мл раствора хлорного железа. Сравни обе пробирки. Без труда можно заметить, что в той пробирке, где, кроме перекиси водорода есть еще хлорное железо, происходит бурное выделение пузырьков газа. С помощью тлеющей лучинки или спички можно легко убедиться, что это кислород.
Для того чтобы опыт прошел удачно, надо взять свежую перекись водорода. Под действием света перекись водорода быстро разлагается, а также теряет бактерицидные свойства (способность убивать бактерии). Советую вам хранить перекись водорода в темных пузырьках с тщательно подогнанной пробкой и не оставлять их на свету. При случае еще один совет: во всех опытах применяйте проверенные и, по возможности, свежие реактивы. Это позволит вам избежать многих разочарований и неудач.
Интересен метод получения кислорода путем электролиза воды. Впервые получили кислород путем электролиза воды два голландских химика, которые в 1789 году разложили воду на кислород и водород с помощью электростатической машины.
способ получения кислорода №3
В 1800 году два английских экспериментатора взяли в качестве источника электрического тока батарею. В нашем опыте мы будем применять обычную электрическую батарейку 4,5 В. Кроме батарейки потребуются: плоский химический стакан или еще лучше — кристаллизатор (можно взять обычную глубокую тарелку), две пробирки, немного проволоки и небольшое количество нитрата калия, сульфата натрия N33804 или сульфата калия К28О4, гидроокиси натрия, серной или азотной кислоты.
В химический стакан влей около 200 мл воды и опусти в него две пробирки, наполненные доверху водой. В них мы будем собирать выделяющийся газ. Поскольку чистая вода слабо проводит электрический ток, процесс электролиза будет протекать очень медленно. В связи с этим нужно растворить в воде небольшое количество сульфата натрия, нитрата калия или несколько капель соляной либо азотной кислоты. Сильные кислоты, щелочи и образовавшиеся из них соли, растворенные в воде, повышают ее проводимость и тем самым ускоряют процесс электролиза
К концам плоской батарейки прикрепи (лучше всего — припаяй) два куска изолированной трубкой проволоки длиной примерно по пятнадцать сантиметров Концы проволоки длиной около одного сантиметра очисть от изоляции. Опусти их в пробирки, наполненные водой. Вскоре на концах проволоки появятся пузырьки газа, а через несколько минут выделяющихся газ частично вытеснит воду из пробирок.
Вода разлагается на водород и кислород.
Легко убедиться, что в результате реакции образуется в два раза больше водорода, чем кислорода. Поскольку объем газа пропорционален количеству его молекул, объем полученного нами водорода должен быть в два раза боль ше объема кислорода.
Взглянем еще раз на пробирки, наполненные газом. В пробирке, к которой была подведена проволока, соединенная с отрицательным полюсом батарейки (длинная пластинка), соберется больше газа, чем в пробирке, куда опущена проволока, соединенная с положительным полюсом. На катоде (отрицательном электроде) выделяется водород, а на аноде (положительном электроде) — кислород.
Как определить присутствие кислорода ?
Присутствие кислорода можно легко определить с помощью тлеющей лучинки. Когда вторая пробирка будет наполнена водородом, вынь ее, держа вверх дном, и поднеси к горящей спиртовке. Газ сразу воспламенится и будет гореть голубым пламенем. Если газ смешан с воздухом, то горение будет сопровождаться небольшим взрывом. В связи с этим опыт надо проводить в защитных очках.
Предостерегаю вас также перед тем, чтобы собирать оба газа в одной пробирке При воспламенение такой смеси происходит сильный взрыв, от этого может лопнуть пробирка, и хорошо, если незадачливый экспериментатор отделается только легким испугом.
Мы познакомились уже со многими методами получения кислорода в лаборатории и убедились, что этот газ не имеет запаха. Если вы не обратили на это внимание, то получите немного кислорода, нагревая перекись водорода, и убедитесь, что кислород — газ без запаха.
Существует, однако, разновидность кислорода — озон. Это газ с сильным, резким запахом. Характерный запах озона можно почувствовать при концентрации 1 : 500 ООО. Озон образуется при атмосферных электрических разрядах в верхних слоях атмосферы. Озоном часто пахнет в лесу после грозы. Эта разновидность кислорода образуется также из воздуха при включении кварцевой лампы.
Попытаемся получить озон в домашней лаборатории
Это совсем не сложно: небольшое количество этого газа образуется при электролизе воды. Понюхай воздух, окружающий анод, на котором выделяется кислород. Ты сразу почувствуешь специфический, резкий запах озона. Этот газ впервые был обнаружен в 1785 году голландским физиком М. ван-Марумом, который заметил, что воздух после прохождения через не то электрических искр приобретает сильный запах и способность окислять ртуть при комнатной температуре.
В 1840 году швейцарский химик X. Ф. Шенбейн подробно изучил свойства этого газа и назвал его озоном от греческого слова — окисляю.
точного горлышка. После такой подготовки можно браться за модель парусника. Корпус изготовьте из коры или древесины, а подставку из картона.
Главная
Урок 17. Получение кислорода – HIMI4KA
В уроке 17 «Получение кислорода» из курса «Химия для чайников» выясним, как получают кислород в лабораторных условиях; узнаем, что такое катализатор, и как растения влияют на производство кислорода на нашей планете.


Наиболее важным для человека и других живых организмов веществом, входящим в состав воздуха, является кислород. Большие количества кислорода используются в промышленности, поэтому важно знать, как можно его получать.
Получение кислорода в лабораторных условиях
В химической лаборатории кислород можно получать нагреванием некоторых сложных веществ, в состав которых входят атомы кислорода. К числу таких веществ относится вещество KMnO4, которое имеется в вашей домашней аптечке под названием «марганцовка».
Вы знакомы с простейшими приборами для получения газов. Если в один из таких приборов поместить немного порошка KMnO4 и нагреть, то будет выделяться кислород (рис. 76):

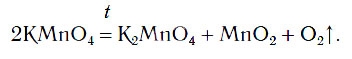
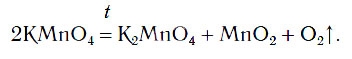
Кислород можно также получить разложением пероксида водорода H2O2. Для этого в пробирку с H2O2 следует добавить очень небольшое количество особого вещества — катализатора — и закрыть пробирку пробкой с газоотводной трубкой (рис. 77).
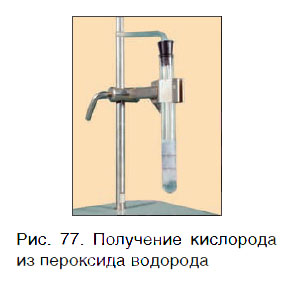
Для данной реакции катализатором является вещество, формула которого MnO2. При этом протекает следующая химическая реакция:
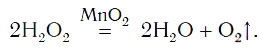
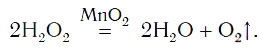
Обратите внимание на то, что ни в левой, ни в правой частях уравнения формулы катализатора нет. Его формулу принято записывать в уравнении реакции над знаком равенства. Для чего же добавляется катализатор? Процесс разложения H2O2 при комнатных условиях протекает очень медленно. Поэтому для получения заметных количеств кислорода необходимо много времени. Однако эту реакцию можно резко ускорить путем прибавления катализатора.
Катализатор — это вещество, которое ускоряет химическую реакцию, но само в ней не расходуется.
Именно потому, что катализатор не расходуется в реакции, мы не записываем его формулу ни в одной из частей уравнения реакции.
Еще один способ получения кислорода — разложение воды под действием постоянного электрического тока. Этот процесс называется электролизом воды. Получить кислород можно в приборе, схематично изображенном на рисунке 78.

При этом протекает следующая химическая реакция:
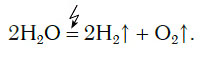
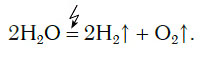
Кислород в природе
Огромное количество газообразного кислорода содержится в атмосфере, растворено в водах морей и океанов. Кислород необходим всем живым организмам для дыхания. Без кислорода невозможно было бы получать энергию за счет сжигания различных видов топлива. На эти нужды ежегодно расходуется примерно 2% атмосферного кислорода.
Откуда берется кислород на Земле и почему его количество остается примерно постоянным, несмотря на такой расход? Единственным источником кислорода на нашей планете являются зеленые растения, производящие его под действием солнечного света в процессе фотосинтеза. Это очень сложный процесс, включающий много стадий. В результате фотосинтеза в зеленых частях растений углекислый газ и вода превращаются в глюкозу C6H12O6 и кислород. Суммарное
уравнение реакций, протекающих в процессе фотосинтеза, можно представить следующим образом:
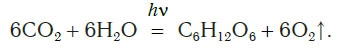
Установлено, что примерно одну десятую часть (11%) производимого зелеными растениями кислорода дают наземные растения, а остальные девять десятых (89%) — водные растения.
Получение кислорода и азота из воздуха
Огромные запасы кислорода в атмосфере позволяют получать и использовать его в различных производствах. В промышленных условиях кислород, азот и некоторые другие газы (аргон, неон) получают из воздуха.
Для этого воздух сначала превращают в жидкость (рис. 79) путем охлаждения до такой низкой температуры, при которой все его компоненты переходят в жидкое агрегатное состояние.

Затем эту жидкость медленно нагревают, в результате чего при разных температурах происходит последовательное выкипание (т. е. переход в газообразное состояние) веществ, которые содержатся в воздухе. Собирая выкипающие при разных температурах газы, по отдельности получают азот, кислород и другие вещества.
Краткие выводы урока:
- В лабораторных условиях кислород получают разложением некоторых сложных веществ, в состав которых входят атомы кислорода.
- Катализатор — вещество, которое ускоряет протекание химической реакции, но само при этом не расходуется.
- Источником кислорода на нашей планете являются зеленые растения, в которых протекает процесс фотосинтеза.
- В промышленности кислород получают из воздуха.
Надеюсь урок 17 «Получение кислорода» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии.
Электролиз
это окислительно-восстановительная реакция, которая протекает только под действием электричества. В промышленных генераторах водорода для получения водорода и кислорода проводят электролиз воды. Для протекания реакции необходимо поместить в электролит два электрода, подключенных к источнику питания постоянного тока:- Анод — электрод к которому подключен положительный проводник;
- Катод — электрод к которому подключен отрицательный проводник.

Электролиз воды
Под действием электрического тока вода разделяется на составляющие ее молекулы: водород и кислород. Отрицательно заряженный катод притягивает катионы водорода а положительно заряженный анод — анионы ОНДеминерализованная вода, используемая в промышленных электролизных установках сама по себе является слабым электролитом, поэтому в нее добавляют сильные электролиты для увеличения проводимости электрического тока. Зачастую выбирают электролиты с меньшим катионным потенциалом, чтобы исключить конкуренцию с катионами водорода : KOH или NaOH. Электрохимическая реакция протекающая на электродах выглядит следующим образом:
- Реакция на аноде: 2H2O → O2 + 4H+ + 4e− — выделение кислорода;
- Реакция на катоде: 2H2O + 2e− → H2 + 2OH− — выделение водорода.
Данный метод является наиболее применяемым методом в промышленности и позволяет получать газообразный водород с КПД от 50 до 70% производительностью до 500 м3/час при удельных энергозатратах 4,5-5,5 Н2м3/кВт-ч.
ЭЛЕКТРОЛИЗ НА ТПЭ
В настоящий момент к наиболее эффективным методом разделения можно отнести электролиз с применением твердо-полимерных электролитов на основе перфторированной ионно обменной мембраны.
Кислород электролизом воды — Справочник химика 21
Производство водорода и кислорода электролизом воды характеризуется достаточно высоким уровнем автоматизации. Отделение электролиза оснащено приборами для автоматического контроля и регулирования процесса, а также целым рядом систем блокировки. Токовая нагрузка регулируется в зависимости от заданной производительности. Подача охлаждающей воды осуществляется автоматически, при этом параметром, по которому производится регулирование, является [c.29]ПОЛУЧЕНИЕ ВОДОРОДА, КИСЛОРОДА ЭЛЕКТРОЛИЗОМ ВОДЫ. ПОЛУЧЕНИЕ ТЯЖЕЛОЙ ВОДЫ [I, 2] [c.8]
Значительное количество водорода полз ается при каталити ческом риформинге нефтяных фракций (около 40 % от общего er мирового потребления). Известны также и другие методы получек ния водорода в промышленности высокотемпературная (1350 1450 °С) конверсия углеводородов при их неполном окислении кислородом до СО и Н2 с последующим превращением оксида углерода паровым способом газификация твердых горючих ископаемых с использованием водяного пара и кислорода электролиз воды и др. [c.790]
На рис. 2.1 приведена технологическая схема получения водорода и кислорода электролизом воды. [c.28]
Сокращение числа устанавливаемых электролизеров облегчает автоматизацию контроля и управления процессами, приводит к уменьшению затрат рабочей силы на обслуживание производства. Применение современных конструкций биполярных электролизеров фильтрпрессного типа позволяет практически полностью автоматизировать процесс обслуживания и контроля работы установок для получения водорода и кислорода электролизом воды.
Технологическая схема производства водорода и кислорода электролизом воды сравнительно проста. Кроме основной стадии разложения воды она включает несколько вспомогательных стадий, необходимых для обеспечения питания электролизеров постоянным током, для очистки питающей воды и приготовления электролита. При повышенных требованиях к чистоте газов электролиза схема дополняется стадиями очистки водорода и кислорода от щелочного тумана и взаимных примесей и осушки газов для удаления паров воды, унесенных из электролизеров и образовавшихся при каталитической очистке. Ниже описаны два наиболее характерных варианта технологической схемы электролиза воды примерная промышленная схема производства большой мощности с использованием крупных фильтрпрессных электролизеров ФВ-500 (на 500—650 м ]ч водорода), работающих при небольшом избыточном давлении, и схема средних и малых установок электролиза воды, обычно работающих под давлением 10 ат и, как правило, снабженных оборудованием для каталитической очистки и осушки газов. Однако первый вариант схемы не исключает возможности каталитической очистки и осушки газов. И наоборот, во втором варианте схемы эти стадии могут отсутствовать, если в них нет необходимости. [c.191]
Промышленные установки для получения водорода и кислорода электролизом воды являются источником повышенной опасности. Различные нарушения технологического режима могут привести к проникновению водорода из аппаратуры в производственное помещение и к созданию взрывоопасных концентраций водорода с воздухом. Нарушение правил эксплуатации электролитических установок может привести к поражению обслуживающего персонала электрическим током и к химическим ожогам щелочью. [c.40]
Азотоводородную смесь получают разложением аммиака и подвергают тщательной очистке, причем особое внимание обращено на удаление кислорода и водяных паров. Дозировку водяного пара производят в виде кислорода электролизом воды. Количество кислорода варьируют силой тока. Перед поступлением на катализатор газовая смесь проходит через слой мелкобитого фарфора с нанесенной на него металлической медью, нагретой до 350°, что обеспечивает связывание кислорода с водородом. Таким образом, на катализатор поступает азотоводородная смесь с определенной концентрацией паров воды.
В последние годы наблюдается достаточно определенная тенденция более широкого распространения электролизеров, оснащенных биполярными электродами, ранее применявшихся лишь для получения некоторых химических продуктов, например, водорода и кислорода электролизом воды. Биполярное включение электродов дает возможность обеспечить равномерное распределение тока но поверхности и решить проблему токоподвода, Обычно биполярное включение электродов сочетается с фильтр-прессной конструкцией электролизера. [c.153]
Под это общее определение подходят все случаи электролиза, однако электрохимические процессы, связанные с получением простых веществ (получение водорода и кислорода электролизом воды, производство хлора, электроосаждение металлов и т. п.), принято рассматривать отдельно. [c.3]
Получение водорода электролизом воды. Метод получения водорода и кислорода электролизом воды применяется в промышленности очень давно. По этому методу при прохождении электрического тока через дистиллированную воду, содержащую небольшое количество гидроокисей калия или натрия, вода разлагается на катоде выделяется водород, а на аноде — кислород. Согласно закону Фарадея, для получения 1 водорода и 0,5 кислорода теорет1гчески требуется затратить 2390 а-ч. При температуре электролита 17° С и атмосферном давлении напряжение на ванне теоретически должно быть 1,23 е, фактическое же напряжение в современных промышленных электролизерах составляет 1,7— 2,6 в. Расход электроэнергии на 1000 получаемого водорода равен 5000— 6000 квш ч Чистота водорода 99,7—99,8%. Остаточный кислород в случае необходимости может быть удален сжиганием на катализаторе.
Расходные нормы на производство 1000 нм водорода (и 500 нм кислорода) электролизом воды составляют 6500— 7000 кВт-ч электроэнергии, 0,9 м дистиллированной воды, 60— 65 м3 воды для охлаждения температурой 26—27° С (после градирни), 1 кг едкого кали, 0,05 кг бихромата калия. [c.145]
Следовательно, при электролизе воды одновременно с водородом происходит выделение кислорода. В лаборатории электролиз воды можно осуществить в приборе, изображенном на рисунке 59. Русский ученый Д. А. Лачи-нов впервые (1888 г.) предложил получать в промышленности водород и кислород электролизом воды и сконструировал для этой цели аппарат. В настоящее время электролиз воды в промышленности осуществляют под давлением. [c.165]
Получение водорода и кислорода электролизом воды осуществляется по сравнительно простой технологической схеме. Подготовка сырья — чистой воды — и первичная переработка получающихся при электролизе водорода и кислорода (охлаждение, очистка от щелочного тумана, осушка) не требуют сложного оборудования. [c.52]
Промышленный способ получения водорода и кислорода электролизом воды приобрел значительное распространение в странах с богатыми ресурсами дешевой гидроэлектроэнергии. Преимущество этого способа заключается в том, ч
ЭЛЕКТРОЛИЗ ВОДЫ — КАК ОН ЕСТЬ: hajoh — LiveJournal
 По материалам книги Позднякова Э.А. http://predmet.ru/zagadki-nauki.pdf
По материалам книги Позднякова Э.А. http://predmet.ru/zagadki-nauki.pdfЕще раз про Н2О
Как уже говорилось, впервые химический состав воды был определен французским химиком Лавуазье в 1784 году. Лавуазье вместе с военным инженером Мёнье, прогоняя пары воды над раскаленным листом железа, обнаружил, что вода разлагается, выделяя при этом водород и кислород. Да, конечно, для своего времени, для эпохи «упорядочения вещей», эти выводы имели большое значение. В самом деле, ведь до этого открытия вода считалась совершенно однородным веществом. Нельзя, однако, не отметить и другого: открытие это сыграло и свою вполне очевидную отрицательную роль, так как надолго отвлекло внимание других ученых от поисков в этой области и утвердило в умах многих поколений непогрешимость данного вывода, освященного к тому же авторитетом ученого.
Но, что условия, при которых он проводился, были настолько несовершенны, были «грязны».
Чего стоит одно только наличие железа, над которым пропускались пары воды. Оно способно внести такие моменты в опыт, которые даже трудно учесть наперед. Лавуазье с партнером зафиксировали в своем опыте то, что было наиболее очевидным: выделение двух газов — водорода и кислорода, а что было сверх того, на это они и вовсе не обратили внимание, скорее всего по той причине, что это «сверх того» не было столь очевидным, как выделение двух газов.
Поскольку до этого открытия общим мнением, господствовавшим в науке, было мнение, что вода является однородным веществом, факт открытия ее неоднородного состава можно назвать революционным. Чего еще можно было требовать от первооткрывателей! К тому же очевидность результатов опыта была слишком подкупающей.
Старый взгляд на воду был отброшен и заменен новым представлением о воде как соединении двух элементов — водорода и кислорода, которое быстро утвердилось в науке. Этому способствовало в значительной мере развитие электрохимии.
ЭЛЕКТРОЛИЗ по Дэви
Рядом ученых (Никольсон, Кавендиш и др.) был проведен опыт по электрохимическому разложению воды (подобное определение данного процесса совершенно ошибочно). Под словом «разложение» надо понимать электролиз воды как сложный окислительно-восстановительный процесс, но отнюдь не как простое разложение воды на составляющие элементы.
Итак, при разложении, т.е. электролизе воды выделялись водород и кислород, что, казалось бы, внешним образом подтверждало вывод Лавуазье. Однако при этом «черный ящик» стал неожиданно выдавать дополнительную информацию, которой прежде не было. В процессе электролиза обнаружилось два странных явления: во-первых, обе составные части воды выделялись не вместе, а отдельно друг от друга — кислород у одного электрода, водород — у другого; во-вторых, наблюдалось образование кислоты у кислородного полюса и щелочи у водородного. Это «странное» разложение воды озадачило ученых; притом их больше беспокоила вторая «странность», т.е. появление кислоты и щелочи.
То обстоятельство, что при пропускании через воду электрического тока выделялись водород и кислород, вполне устраивало ученых, ибо как бы подтверждало ставшее уже господствующим мнение о составе воды. Вопрос же о том, каким образом эти составные части выделялись, при каких сопутствующих обстоятельствах, хотя и занимал ученых того времени, но все же не в такой степени: их внимание было направлено главным образом на вторую «странность», ибо она наводила тень сомнения на открытую формулу воды. Неизбежно встал вопрос о том, что является причиной образования кислоты и щелочи при электролизе воды.
За решение этой загадки взялся выдающийся английский химик Гемфри Дэви (1778—1829). Дэви рядом опытов, казалось бы, подтвердил предполагаемый всеми учеными того времени факт, что образование кислоты и щелочи при электролизе воды — явление случайное, не связанное с самой водой, состоящей, как это и было определено Лавуазье, из водорода и кислорода. Но, каким образом Дэви удалось это «доказать».
Дэви проделал многочисленные опыты по «разложению» электричеством тщательно очищенной воды в различных сосудах: агатовых, стеклянных, сделанных из плавикового шпата, сернокислого барита и т.п., чтобы максимально уменьшить влияние материала сосудов на результаты опытов. Во всех без исключения опытах при электролизе воды он получал у анода сильную кислоту, у катода щелочь. Он связывал это с тем, что чистая вода отчасти все же разлагала материал сосудов, что и явилось причиной образования кислоты и щелочи. Важным, однако, следствием опытов было то, что количество образующихся у электродов кислоты и щелочи стояло в прямой зависимости от продолжительности опытов, а именно: чем продолжительнее они были, тем больше образовывалось кислоты и щелочи и тем сильнее была их концентрация.
В опытах Дэви по электролизу различных растворов солей получалась аналогичная картина: у анода шло образование кислоты с выделением кислорода, у катода — образование щелочи с выделением водорода или чистого аммиака. Сами эти процессы должны были бы подтолкнуть по аналогии к выводам относительно общих закономерностей, относящихся к процессу электролиза.
Ведь хорошо известно, что при электролизе различных веществ у электродов происходят окислительно-восстановительные процессы, но отнюдь не простое разложение веществ. Более того, только при наличии окислительно-восстановительного процесса может идти и сам электролиз.
При этом реакция окисления происходит у одного электрода, а реакция восстановления у другого. Поэтому было бы самой грубой ошибкой рассматривать электролиз как простой процесс разложения веществ на составляющие их элементы, будь то вода, соль или кислота. Окисление у одного полюса происходит при одновременном восстановлении у другого, и наоборот. Эти положения суть святая святых электрохимических процессов, полностью согласующихся со вторым началом термодинамики. Действительно, если мы возьмем примеры с электролизом солей, то легко видеть, что у анода происходила реакция восстановления с выделением кислорода (продуктом этой реакции, скапливающимся у анода, во всех случаях выступала какая-нибудь кислота). У катода происходила реакция окисления с выделением водорода или металла (продуктом этой реакции, скапливающимся у катода, всегда была какая-нибудь щелочь).
Но именно эта совершенно очевидная вещь отвергалась. Мысль о ней не допускалась или ею попроступренебрегали. Притом делали это не какие-то дилетанты, а профессионалы высокого класса. Для них, сдается, каким-то символом веры, своего рода «священной коровой» стал факт, что вода состоит из двух элементов — водорода и кислорода, и они направляли все свои недюжинные способности именно на подтверждение данного факта, но отнюдь не на проверку его истинности. То, что оба газа выделялись при электролизе, хотя и у разных электродов, как бы подтверждало эту веру, даже вопреки всем законам электролиза и термодинамики. При этом никого нисколько не смущало, что вода вот так легко может разделяться на составные части, будто два склеенных куска дерева, опущенных в воду.
Для того чтобы избежать всяких побочных влияний, Дэви провел ряд опытов в золотых сосудах с хорошо очищенной водой. На протяжении четырнадцати часов, в течение которых продолжался опыт, количество кислоты в анодном сосуде постоянно возрастало. Дэви обнаружил, что она по своим свойствам ничем не отличалась от азотной кислоты, которая точно таким же образом образовывалась в опытах, проводимых им прежде в стеклянных сосудах. В катодном же сосуде образовывалась летучая щелочь, количество которой скоро доходило до определенного предела. Она обнаруживала свойство аммиака (Nh4).
Дэви повторил свой опыт и продолжал его без перерыва трое суток. К концу этого времени, как он сам свидетельствует, вода в сосудах была разложена и выпарилась больше чем на половину своего первоначального объема. В результате, в анодном сосуде образовалась сильная азотная кислота, количество же щелочи оставалось примерно на том же уровне, как и в предыдущем опыте. Дэви посчитал, что последнее было связано с ее постоянным испарением.
Вода «под пыткой» у Дэви
А действительно ли в опытах Дэви все было так безукоризненно чисто и хорошо? Рассмотрим опыт Дэви по электролизу воды под колоколом воздушного насоса. Почему в этом опыте образовалось лишь небольшое количество кислоты в анодном сосуде и не было вовсе обнаружено щелочи в сосуде катодном? Действительно ли, как думал Дэви, это было связано с отсутствием воздуха, выкачанного из-под колокола? Отчасти да, но совершенно в другом смысле, нежели он предполагал. Начать с того, что Дэви допустил серьезную ошибку в своем первоначальном предположении, что причиной образования кислоты и щелочи являлся азот воздуха. Образование кислоты и щелочи к азоту воздуха никакого отношения иметь не могло по той простой причине, что азот в обычных условиях химически не активен, не растворяется в воде и не вступает в реакции ни с кислородом, ни с водородом. Один этот факт должен был бы натолкнуть на поиски иных источников образования кислоты и щелочи. Позже, правда, высказывалось предположение, что образование кислоты и щелочи в опытах было, возможно, вызвано присутствием в воздухе некоторого количества аммонийных солей. Этим объяснением и удовлетворились. Однако вряд ли можно всерьез принимать данное объяснение, так как, во-первых, оно было сделано постфактум и, во- вторых, даже если бы какое-то количество таких солей и впрямь присутствовало, то оно настолько должно было быть мало, что не могло оказывать постоянного и закономерного образования кислоты и щелочи в каждом опыте, количество которых стояло, как говорилось, лишь в прямой зависимости от продолжительности проводимых опытов.
Иллюстрация восстановительного действия водорода.
Если, взять два электрода, один из которых представляет полированную серебряную пластинку, а другой — обычную швейную иглу, поместить их под колокол, и в сильно разреженном воздухе пропускать электрический ток так, чтобы электрический разряд переходил с кончика иглы на полированную пластинку, то напротив кончика иглы пластинка заметно изменится — она окислится и потускнеет, и тем больше, чем дольше будет пропускаться электрический ток. Если же после этого воздух заменить разреженным водородом, то при всех прочих равных и неизменных условиях, дальнейшее пропускание тока приведет к тому, что окись на пластинке будет постепенно сходить, и полировка по большей части восстановится, что хорошо иллюстрирует восстанавливающие свойства водорода.
Второй пример из области живой природы. Клод Бернар приводит такой опыт: он смешивал один объем воздуха с двумя объемами водорода и помещал в эту атмосферу семена. При всех прочих благоприятных условиях (влага, тепло и проч.) прорастания семян не происходило, хотя напряжение кислорода при этом было вполне достаточным для жизнедеятельности. Очевидно, что негативный результат был обязан опять-таки действию водорода, оказывавшего сильное восстанавливающее действие, препятствуя течению окислительно-восстановительного процесса, а вместе с ним и образованию его необходимых продуктов — кислоты и щелочи.
Третье: из физической химии хорошо известно, что азотная кислота является легко восстанавливающимся веществом. Она, например, восстанавливается водородом до свободного азота:
2N03 + 12Н + 10е—> N2 + 6Н20
Это свойство азотной кислоты специально используется в некоторых гальванических элементах для предотвращения поляризации. В этих случаях азотную кислоту добавляют в катодное отделение, где выделяется водород.
Аналогичные процессы происходили и под колоколом в опытах Дэви. Когда он во втором опыте заменил воздух водородом, то тем самым создал там мощную восстановительную среду, действие которой не преминуло сказаться на результатах: в анодном сосуде естественно не было (и не могло быть) обнаружено кислоты, в катодном — щелочи. Все было естественно и закономерно. Но факт остается фактом: опыты Дэви убедили всех окончательно, что вода состоит из двух простых элементов — водорода и кислорода.
Однако предположим, что вода действительно состоит из водорода и кислорода. Тогда естественно было бы предполагать, что, коль скоро вода с такой легкостью разлагается на свои составные части, она должна столь же легко образовываться в результате их синтеза. Ничего подобного, однако, не происходит. Как известно, смесь двух газов в пропорции один к двум (один объем кислорода и два объема водорода) дает так называемый гремучий газ, но отнюдь не воду. Попытки образования воды из водорода и кислорода имели успех только в присутствии катализатора (кстати, в роли катализатора может при этом выступать и железо, то самое железо, над которым Лавуазье пропускал пары воды и извлекал свои исторические выводы).
Можно сказать, что большинство опытов по определению химического состава воды было направлено не столько на объективные поиски, сколько на подгонку их результатов к уже имеющемуся выводу, который стал поистине символом веры. «Черный ящик» давал в основном ту информацию, которую от него ожидали и которую часто заведомо предопределяли направленным действием на его входы.
Схема электролиза без мембраны: два параллельных электрода располагаются на расстоянии в несколько сотен микрометров
Не секрет, что чистый водород — один из наиболее перспективных видов альтернативного топлива. Водород добывают из любого водного раствора, а при сгорании он превращается обратно в воду, что может быть прекраснее?
Проблема только в стоимости добычи водорода. Электролиз воды предполагает, что электроды погружаются в воду, а между ними находится полимерная мембрана. Ток идёт от катода к аноду, а на своём пути он (при помощи катализатора) расщепляет воду на кислород и водород. Полимерная мембрана выполняет важную функцию, разделяя получившиеся газы.
На сегодняшний в качестве мембраны с ионной проводимостью практически повсеместно используется нафион или другой тип мембраны. Но все они отличаются дороговизной и ограниченным сроком службы. К тому, мембраны требуют особых условий проведения электролиза. Например, нафион работает в жидкости только с низкой кислотностью и только с определёнными катализаторами.
Изобретение химиков из EPFL под руководством Деметри Псалтиса (Demetri Psaltis) позволяет избавиться от этих ограничений и намного удешевить электролиз воды.
Они провели ряд экспериментов с микроустройством, размещая электроды на разном расстоянии друг от друга и прогоняя между ними воду на разной скорости. Оказалось, что при определённом расстоянии между электродами H2 и O2 сами разлетаются в разные стороны, без всякой мембраны!
Причина такого поведения ионов — эффект Сегре-Зильберберга, когда при движении жидкости находящиеся в ней частицы поток уносит в стороны.
Учёные надеются, что им удастся приспособить прибор для работы с любыми видами жидких электролитов и любыми катализаторами, поскольку больше нет риска повреждения хрупкой мембраны. Исчезнут обязательные требования использовать только благородные металлы вроде платины из-за ограничений на кислотность (pH) жидкости.
Если получится масштабировать микроустройство до промышленного образца, то это кардинально снизит стоимость водорода, получаемого при электролизе воды.
Научная работа “A membrane-less electrolyzer for hydrogen production across the pH scale” опубликована в журнале “Energy & Environmental Science”, DOI: 10.1039/C5EE00083A (зеркало).
При сильном нагревании железной проволоки в атмосфере кислорода она сгорает. При нагревании в парах воды электролитическое железо начинает тускнеть при температуре 330°, а при 400° уже можно измерить количество водорода, выделяю — щегося в результате окисления железа парами воды (железо- паровой способ получения водорода). [c.581]
Так как фтор имеется в продаже, то в лабораторных условиях электролитический метод синтеза применяют лишь для получения соединений фтора. В сущности эти методики представляют собой синтезы при контролируемых условиях электролиза в присутствии реагента, который может представлять собой электролит, компонент электролита или же вещество, которое по крайней мере частично растворимо в электролите. Наиболее важными электролитическими методами синтеза являются получение трифторида азота и дифторида кислорода. Это единственные удовлетворительные способы получения этих двух соединений в лабораторных условиях. [c.365]
Медный купорос для получения оксида меди (II) по химическому способу, как известно, приготавливают растворением металлической меди в серной кислоте в присутствии кислорода воздуха. Электролитический оксид меди (II) также получается из металлической меди. Предложенный новый метод сводится к следующему. Медные стружки или опилки и окисленная природная марганцевая руда обрабатываются серной кислотой, при этом марганец и медь переходят в раствор в виде сульфатов [c.187]
Электролитический способ получения кислорода заключается в пропускании постоянного тока через подщелоченную едким натром воду. При этом происхо- [c.66]
Все известные способы получения кислорода могут быть разделены на следующие группы а) химический, б) электролитический, в) сорбционный, г) диализ и д) ректификационный. [c.13]
Долгое время в промышленности был распространен электролитический метод получения железо-кадмиевой губки. В настоящее время активную массу получают более простым, термическим, способом. Кадмий расплавляют в реторте при 700—800 °С, образующиеся пары металла направляют в окислительно-осадительные камеры. Здесь кадмий окисляется кислородом воздуха, и охлажденный высокодисперсный порошок окиси кадмия собирается в бункере. Частицы окиси, увлеченные воздухом из камеры, улавливаются в рукавном матерчатом фильтре. [c.98]
Водородное и кислородное перенапряжения имеют большое прикладное значение и должны учитываться при электролизе водных растворов. Их роль в процессах очень различна. Она негативна, например, при промышленном получении водорода и кислорода электролитическим способом, так как перенапряжение связано с дополнительным расходом электроэнергии в этом случае, и позитивна при электролитическом получении некоторых металлических покрытий, при зарядке кислотных аккумуляторов и т. д. [c.260]
Электрохимический способ получения водорода основан на электролитическом разложении воды. Кислород является при электролизе попутным продуктом самостоятельного значения этот процесс не имеет, поскольку получать кислород из воздуха экономичнее. [c.362]
Электролитическим способом можно получить порошки редких тугоплавких металлов более чистые, чем при получении их термическими методами, однако в процессе электролиза выделяющиеся на катоде продукты необходимо защищать от воздействия кислорода воздуха. Таким же путем (электролизом расплавленных солей) можно получать тонкие плотные покрытия из тугоплавких металлов на поверхности других, основных металлов. [c.339]
Существует также электрохимический способ получения газов, заключающийся в электролитическом разложении воды на ее составные части водород и кислород. Этот метод не является основным и используется в производстве продуктов разделения воздуха только дял получения водорода, который необходим для очистки сырого аргона от кислорода. [c.6]
Высокотемпературное электролитическое разложение водяного нара представляет интерес не только для регенерации кислорода в целях космонавтики, но имеет более общее значение, как экономически выгодный способ получения водорода. [c.145]
В настоящее время основным сырьем в производстве аммиака являются природный газ, попутные газы нефтедобычи, жидкие углеводороды и коксовый газ. Доля аммиака, получаемого из твердого топлива и электролитического водорода, все более снижается. При современных методах получения аммиака все большее значение приобретают процессы очистки газа. Из технологических газов на разных стадиях получения аммиака удаляют такие примеси, как сернистые соединения, двуокись и окись углерода, ацетилен, окислы азота, кислород и др. Эти примеси, содержащиеся в газе в различных концентрациях, по-разному влияют на процесс. Например, сернистые соединения оказывают сильное влияние на все катализаторы, применяемые в синтезе аммиака серосодержащие соединения, присутствующие в исходном углеводородном сырье, ухудшают работу катализаторов конверсии метана, что приводит к повышению температуры процесса и увеличению расхода кислорода. При использовании наиболее экономичного способа производства аммиака, который основан на методе бескислородной каталитической конверсии метана в трубчатых печах, содержание сернистых соединений в природном газе не должно превышать 1 мг/м . [c.7]
Очевидный способ понижения
Как это работает?
Подобно топливным элементам, электролизеры состоят из анода и катода, разделенных электролитом. Различные электролизеры функционируют немного по-разному, главным образом из-за различного типа материала электролита.
Мембранные электролизеры с полимерным электролитом
В электролизере с полимерной электролитной мембраной (PEM) электролит представляет собой твердый специальный пластичный материал.
- Вода реагирует на аноде с образованием кислорода и положительно заряженных ионов водорода (протонов).
- Электроны протекают через внешнюю цепь, и ионы водорода избирательно перемещаются через PEM к катоду.
- На катоде ионы водорода соединяются с электронами из внешнего контура с образованием газообразного водорода. Реакция анода: 2H 2 O → O 2 + 4H + + 4e — Реакция катода: 4H + + 4e — → 2H 2
Щелочные электролизеры
Щелочные электролизеры работают через транспорт гидроксид-ионов (ОН — ) через электролит от катода к аноду с образованием водорода на катодной стороне.Электролизеры с использованием жидкого щелочного раствора гидроксида натрия или калия в качестве электролита были коммерчески доступны в течение многих лет. Более новые подходы, использующие твердые щелочные обменные мембраны в качестве электролита, показывают многообещающие результаты в лабораторных условиях.
Твердооксидные электролизеры
Твердооксидные электролизеры, в которых в качестве электролита используется твердый керамический материал, который избирательно проводит отрицательно заряженные ионы кислорода (O 2 9009) при повышенных температурах, генерируют водород несколько иным способом.
- Вода на катоде соединяется с электронами из внешнего контура, образуя газообразный водород и отрицательно заряженные ионы кислорода.
- Ионы кислорода проходят через твердую керамическую мембрану и реагируют на аноде с образованием газообразного кислорода и генерируют электроны для внешней цепи.
Твердооксидные электролизеры должны работать при достаточно высоких температурах, чтобы твердооксидные мембраны функционировали должным образом (около 700–800 ° C, по сравнению с PEM-электролизерами, которые работают при 70–90 ° C, и коммерческими щелочными электролизерами, которые работать при 100–150 ° C).Твердооксидные электролизеры могут эффективно использовать тепло, доступное при этих повышенных температурах (из различных источников, включая ядерную энергию), чтобы уменьшить количество электрической энергии, необходимой для производства водорода из воды.
Почему этот путь рассматривается?
Водород, полученный в результате электролиза, может привести к нулевым выбросам парниковых газов, в зависимости от источника используемого электричества. Источник необходимой электроэнергии, включая ее стоимость и эффективность, а также выбросы, возникающие в результате производства электроэнергии, должен учитываться при оценке преимуществ и экономической жизнеспособности производства водорода с помощью электролиза.Во многих регионах страны сегодняшняя электрическая сеть не идеальна для обеспечения электроэнергией, необходимой для электролиза из-за выделяемых парниковых газов и количества топлива, необходимого из-за низкой эффективности процесса выработки электроэнергии. Производство водорода с помощью электролиза осуществляется для использования возобновляемых источников энергии (ветра) и ядерной энергии. Эти пути приводят практически к нулевым выбросам парниковых газов и выбросам загрязняющих веществ.
Потенциал для синергии с производством энергии из возобновляемых источников
Производство водорода посредством электролиза может предложить возможности для синергии с производством переменной мощности, что характерно для некоторых технологий использования возобновляемых источников энергии.Например, хотя стоимость энергии ветра продолжает падать, внутренняя изменчивость ветра является препятствием для эффективного использования энергии ветра. Водородное топливо и производство электроэнергии могут быть интегрированы в ветряную электростанцию, что позволяет гибко перемещать производство, чтобы наилучшим образом соответствовать доступности ресурсов с эксплуатационными потребностями системы и рыночными факторами. Кроме того, во времена избыточного производства электроэнергии из ветряных электростанций, вместо того, чтобы сократить потребление электроэнергии, как это обычно делается, можно использовать это избыточное электричество для производства водорода путем электролиза.
Важно отметить …
- Сегодня сетевое электричество не является идеальным источником электричества для электролиза, потому что большая часть электричества генерируется с использованием технологий, которые приводят к выбросам парниковых газов и являются энергоемкими. Выработка электроэнергии с использованием технологий использования возобновляемых источников энергии или ядерных технологий, либо отдельно от энергосистемы, либо в виде растущей части энергосети, является возможным вариантом преодоления этих ограничений для производства водорода посредством электролиза.
- Министерство энергетики США и другие продолжают предпринимать усилия по снижению затрат на производство электроэнергии на основе возобновляемых источников энергии и развивать более эффективное производство электроэнергии на основе угля с улавливанием, использованием и хранением углерода. Например, производство электроэнергии на основе ветра быстро растет в Соединенных Штатах и во всем мире.
Исследования направлены на преодоление трудностей
- Снижение капитальных затрат на блок электролизера и баланса системы, а также повышение энергоэффективности для преобразования электричества в водород.
- Интегрирование компрессии в электролизер, чтобы избежать затрат на отдельный компрессор водорода, необходимый для повышения давления для хранения водорода.
Расщепление воды на водород и кислород путем электролиза с использованием электричества от непостоянного тепла, ветра или солнечной энергии — один из самых простых и чистых методов производства водорода высокой чистоты и эффективный способ накопления избыточной электроэнергии. Ключевой дилеммой для эффективного крупномасштабного производства водорода путем расщепления воды через реакции выделения водорода и кислорода (соответственно, HER и OER) является необходимый высокий перенапряжение, особенно для OER.Мы сообщаем об исключительно активном и долговечном катализаторе OER, дающем плотности тока 500 и 1000 мА см -2 при перенапряжениях только 259 мВ и 289 мВ в щелочном электролите, соответственно, что соответствует коммерческим критериям процесса OER. Вместе с хорошим катализатором HER мы достигли коммерчески требуемых плотностей тока 500 и 1000 мА / см -2 при 1,586 и 1,665 В, соответственно, с очень хорошей стабильностью, значительно ниже, чем любое ранее зарегистрированное напряжение.Это открытие создает основу для крупномасштабного производства водорода путем расщепления воды с использованием избыточной электрической энергии, когда и где это возможно.
У вас есть доступ к этой статье
 Пожалуйста, подождите, пока мы загрузим ваш контент…
Что-то пошло не так. Попробуй еще раз?
,
Пожалуйста, подождите, пока мы загрузим ваш контент…
Что-то пошло не так. Попробуй еще раз?
,23,9: электролиз воды — химия LibreTexts
- Последнее обновление
- Сохранить как PDF
- Электролиз воды
- Резюме
- Участники
В связи с тем, что ископаемое топливо становится все более дорогим и менее доступным, ученые ищут другие источники энергии.Водород долгое время считался идеальным источником, поскольку он не загрязняет окружающую среду при сжигании. Проблема заключалась в поиске путей получения водорода экономически. Одним из новых подходов, который изучается, является фотоэлектролиз — производство электроэнергии с использованием фотоэлектрических элементов для расщепления молекул воды. Этот метод все еще находится в стадии исследования, но, как представляется, является очень многообещающим источником энергии в будущем.
Электролиз Воды
При электролизе воды образуются газы водорода и кислорода.Электролизер состоит из пары платиновых электродов, погруженных в воду, к которым добавлено небольшое количество электролита, такого как \ (\ ce {H_2SO_4} \). Электролит необходим, потому что чистая вода не будет нести достаточный заряд из-за недостатка ионов. На аноде вода окисляется до газообразного кислорода и ионов водорода. На катоде вода восстанавливается до газообразного водорода и гидроксид-ионов.
\ [\ begin {array} {lll} \ text {окисление (анод):} & 2 \ ce {H_2O} \ left (l \ right) \ rightarrow \ ce {O_2} \ left (g \ right) + 4 \ ce {H ^ +} \ left (aq \ right) + 4 \ ce {e ^ -} & E ^ 0 = -1.0_ \ text {cell} = -2.06 \: \ text {V} \ end {array} \]
Чтобы получить общую реакцию, полуреакция восстановления была умножена на два, чтобы выровнять электроны. Ионы водорода и гидроксид-ионы, образующиеся в каждой реакции, объединяются в воду. \ (\ Ce {H_2SO_4} \) не используется в реакции.
Рис. 23.9.1. Аппарат для производства газов водорода и кислорода электролизом воды.Резюме
- Описан электролиз воды.
участников
CK-12 Фонд Шэрон Бьюик, Ричарда Парсонса, Терезы Форсайт, Шонны Робинсон и Джин Дюпон.
Минутку …
Пожалуйста, включите Cookies и перезагрузите страницу.
Этот процесс автоматический. Ваш браузер будет перенаправлен на запрошенный контент в ближайшее время.
Пожалуйста, подождите до 5 секунд …
+ ((! + [] + (!! []) + !! [] + !! [] + !! [] + !! [] + !! [] + !! [] + []) + (+ !! []) + (! + [] + (!! []) + !! [] + !! [] + !! [] + !! [] + !! []) + (! + [] + (!! []) + !! [] + !! [] + !! []) + (+ [] — (!! []!)) + (+ [] + (!! [ ]) + !! [] + !! []) + (+ [] + (!! []) — []) + (+ [] + (!! []) + !! [] +! ! [] + !! []) + (! + [] + (!! []) + !! [])) / + ((+ !! [] + []) + (+ !! []) + (! + [] + (!! []) + !! [] + !! [] + !! [] + !! [] + !! [] + !! [] + !! []) + (! + [] + (!! []) + !! [] + !! [] + !! [] + !! [] + !! []) + (+ [] — (!! [] )) + (! + [] + (!! []) + !! [] + !! [] + !! [] + !! [] + !! []) + (! + [] + (! ! []) + !! [] + !! [] + !! [] + !! [] + !! []) + (! + [] + (!! []) + !! [] +! ! [] + !! [] + !! [] + !! []) + (! + [] + (!! []) + !! [] + !! [] + !! [] + !! [] + !! [] + !! []))
+ ((! + [] + (!! []) + !! [] + !! [] + !! [] + !! [] + !! [] + !! [] + !! [] + []) + (+ [] + (!! [!]) — []) + (+ [] — (!! [])) + (! + [] + (!! []) + !! [] + !! []) + (+ !! []) + (! + [] + (!! []) + !! [] + !! [] + !! [] + !! [] + !! [] + !! [] + !! []) + (! + [] + (!! []) + !! [] + !! [] + !! [] + !! [] + !! [] + !! []) + (+ [] + (!! [!]) — []) + (+ [] + ( !! []) + !! [])) / + ((! + [] + (!! []) + !! [] + []) + (+ !! []) + (! + [] — (!! [])) + (! + [] + (!! []) — []) + (! + [] + (!! []) + !! [] + !! [] +! ! [] + !! [] + !! []) + (! + [] + (!! []) + !! [] + !! [] + !! [] + !! [] + !! [] + !! []) + (+ [] — (!! [])) + (! + [] + (!! []) + !! [] + !! [] + !! [] + !! [] + !! [] + !! [] + !! []) + (! + [] + (!! [] ) + !! [] + !! [] + !! [] + !! [] + !! [] + !! []))
+ ((! + [] + (!! []) + !! [] + !! [] + !! [] + !! [] + !! [] + !! [] + []) + (+ !! []) + (! + [] + (! ! []) + !! [] + !! [] + !! [] + !! [] + !! []) + (! + [] + (!! []) + !! [] +! ! [] + !! []) + (+ [] — (!! [])) + + !! [] + !! []) + ((+ [] + (!! []!)! + [] + (!! []) — []) + (! + [] + (!! []) + !! [] + !! [] + !! []) + (+ [] + (!! []) + !! [])) / + ((! + [] + (!! []) + !! [] + !! [] + !! [] + []) + (! + [] + (!! []) + !! []) + (! + [] + (!! []) + !! [] + !! [] + !! [] + !! [] + !! []) + (! + [] + (!! []) + !! [] + !! [] + !! [] + !! []) + (! + [] + (!! [ ]) + !! [] + !! [] + !! [] + !! [] + !! []) + (! + [] + (!! []) + !! [] + !! [ ] + !! [] + !! [] + !! [] + !! [] + !! []) + (+ [] + (!! [!]) — []) + (+ [] + (!! []) + !! [] + !! []) + (! + [] + (!! []) + !! [] + !! [] + !! [] + !! [ ] + !! [] + !! [] + !! []))
+ ((! + [] + (!! []) + !! [] + !! [] + !! [] + !! [] + !! [] + !! [] + []) + (! + [] + (!! []) + !! [] + !! [] + !! []) + (! + [] + (!! []) + !! [] + !! [] + !! [] + !! [] + !! [] + !! []) + (! + [] + (! ! []) + !! [] + !! [] + !! []) + (! + [] + (!! []) + !! [] + !! [] + !! [] +! ! [] + !! [] + !! [] + !! []) + (! + [] + (!! []) + !! [] + !! [] + !! [] + !! [] + !! [] + !! [] + !! []) + (! + [] + (!! []) + !! [] + !! [] + !! []) + (! + [] — (! + [] + (!! []) (!! [])) + + !! [])) / + (! (+ [] + (!! []) + !! [ ] + !! [] + !! [] + !! [] + !! [] + []) + (! + [] + (!! []) + !! []) + (! + [] + (!! []) + !! [] + !! []) + (! + [] + ( !! []) + !! [] + !! [] + !! [] + !! [] + !! []) + (! + []
.