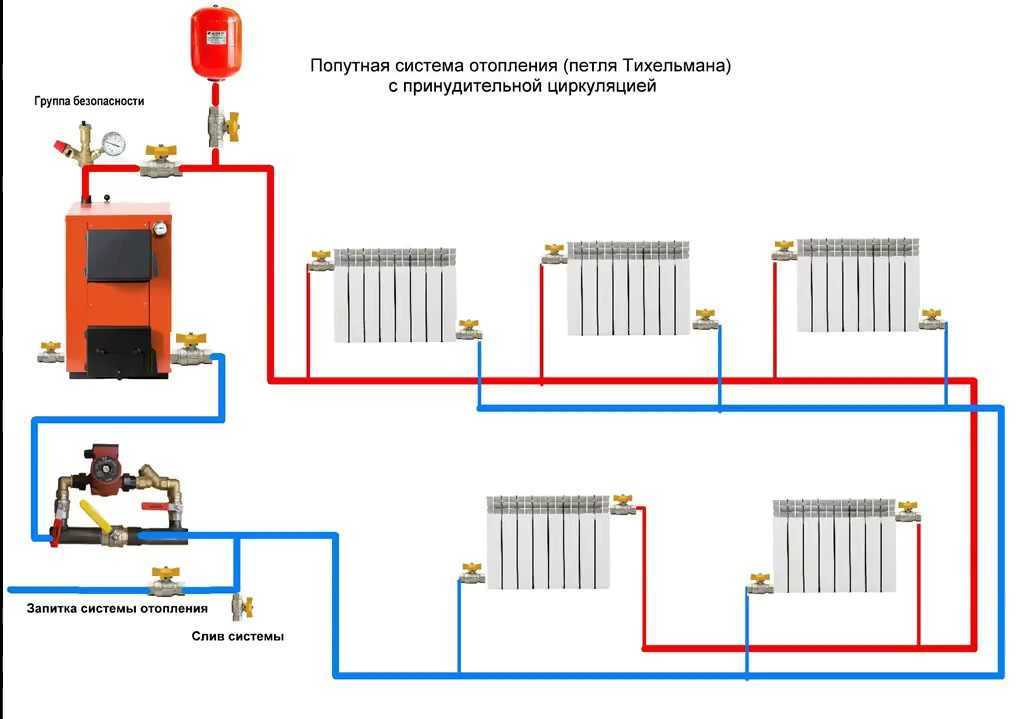
8.1: Кривые нагрева и фазовые переходы
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 119748
Навыки развития
- Описать процессы, представленные типичными кривыми нагрева и охлаждения, и рассчитать тепловые потоки и изменения энтальпии, сопровождающие эти процессы
- Объясните построение и использование типичной фазовой диаграммы
- Использование фазовых диаграмм для идентификации стабильных фаз при заданных температурах и давлениях, а также для описания фазовых переходов, происходящих в результате изменения этих свойств
- Описать сверхкритическую флюидную фазу вещества
Кривые нагревания и охлаждения
На кафедре термохимии было введено соотношение между количеством теплоты, поглощенной или отнесенной веществом, q, и сопутствующим ему изменением температуры, ΔT:
\[q=mcΔT\]
где m — масса вещества, а c — его удельная теплоемкость. Это отношение применимо к материи, которая нагревается или охлаждается, но не претерпевает изменения в состоянии. Когда нагреваемое или охлаждаемое вещество достигает температуры, соответствующей одному из его фазовых переходов, дальнейший прирост или потеря тепла является результатом уменьшения или усиления межмолекулярного притяжения, а не увеличения или уменьшения кинетической энергии молекул. Пока вещество претерпевает изменение состояния, его температура остается постоянной. На рисунке \(\PageIndex{1}\) показана типичная кривая нагрева.
Это отношение применимо к материи, которая нагревается или охлаждается, но не претерпевает изменения в состоянии. Когда нагреваемое или охлаждаемое вещество достигает температуры, соответствующей одному из его фазовых переходов, дальнейший прирост или потеря тепла является результатом уменьшения или усиления межмолекулярного притяжения, а не увеличения или уменьшения кинетической энергии молекул. Пока вещество претерпевает изменение состояния, его температура остается постоянной. На рисунке \(\PageIndex{1}\) показана типичная кривая нагрева.
Рисунок \(\PageIndex{1}\) : Типичная кривая нагревания вещества показывает изменения температуры, происходящие по мере того, как вещество поглощает все больше тепла. Плато на кривой (области постоянной температуры) проявляются при фазовых переходах вещества.
Рассмотрим пример нагревания кастрюли с водой до кипения. Горелка плиты будет подавать тепло примерно с постоянной скоростью; первоначально это тепло служит для повышения температуры воды. Когда вода достигает точки кипения, температура остается постоянной, несмотря на постоянный ввод тепла от горелки печи. Эта же температура поддерживается водой до тех пор, пока она кипит. Если увеличить мощность горелки, чтобы обеспечить более высокую скорость нагрева, температура воды не повышается, а вместо этого кипение становится более энергичным (быстрым). Такое поведение наблюдается и для других фазовых переходов: например, температура остается постоянной, пока происходит изменение состояния.
Когда вода достигает точки кипения, температура остается постоянной, несмотря на постоянный ввод тепла от горелки печи. Эта же температура поддерживается водой до тех пор, пока она кипит. Если увеличить мощность горелки, чтобы обеспечить более высокую скорость нагрева, температура воды не повышается, а вместо этого кипение становится более энергичным (быстрым). Такое поведение наблюдается и для других фазовых переходов: например, температура остается постоянной, пока происходит изменение состояния.
Пример \(\PageIndex{1}\): Общее количество тепла, необходимое для изменения температуры и фазы вещества
Сколько тепла требуется для превращения 135 г льда при -15 °C в водяной пар при 120 °C?
Решение
Описанный переход включает следующие этапы:
- Нагрев льда от −15 °C до 0 °C
- Растаявший лед
- Нагрев воды от 0 °C до 100 °C
- Кипятить воду
- Нагрев пара от 100 °С до 120 °С
Теплота, необходимая для изменения температуры данного вещества (без фазового перехода): q = m × c × Δ T (см. предыдущую главу о термохимии). Количество тепла, необходимое для того, чтобы вызвать заданное изменение фазы, определяется как q = n × Δ H .
предыдущую главу о термохимии). Количество тепла, необходимое для того, чтобы вызвать заданное изменение фазы, определяется как q = n × Δ H .
Используя эти уравнения с соответствующими значениями удельной теплоемкости льда, воды и пара, а также энтальпий плавления и испарения, мы имеем:
\[\begin{align*}
q_\ce{total}&=(m⋅c⋅ΔT)_\ce{лед}+n⋅ΔH_\ce{fus}+(m⋅c⋅ΔT)_ \ce{вода}+n⋅ΔH_\ce{пар}+(м⋅c⋅ΔT)_\ce{пар}\\[7pt]
&=\mathrm{(135\: г⋅2,09\: Дж/ г⋅°C⋅15°C)+\left(135⋅\dfrac{1\: моль}{18,02\:g}⋅6,01\: кДж/моль
\right)}\\[7pt]
&\mathrm {+(135\: г⋅4,18\: Дж/г⋅°C⋅100°C)+\left(135\: г⋅\dfrac{1\: моль}{18,02\:г}⋅40,67\: кДж /моль\справа)}\\[7pt]
&\mathrm{+(135\: г⋅1,84\: Дж/г⋅°C⋅20°C)}\\[7pt]
&=\mathrm{4230 \: Дж+45,0\: кДж+56 500\: Дж+305\: кДж+4970\: Дж}
\end{align*}\]
Преобразование величин в Дж в кДж позволяет суммировать их и получить общее требуемое количество тепла:
\[\mathrm{=4,23\:кДж+45,0\ : кДж+56,5\: кДж+305\: кДж+4,97\: кДж=416\: кДж} \номер\]
Упражнение \(\PageIndex{1}\)
Какое общее количество тепла выделится при 94,0 г воды при 80,0 °C охлаждается с образованием льда при −30,0 °C?
- Ответить
40,5 кДж
В предыдущем разделе было описано изменение равновесного давления паров жидкости в зависимости от температуры. Принимая во внимание определение точки кипения, графики зависимости давления пара от температуры показывают, как точка кипения жидкости зависит от давления. Описано также использование кривых нагрева и охлаждения для определения температуры плавления (или замерзания) вещества. Выполнение таких измерений в широком диапазоне давлений дает данные, которые можно представить графически в виде фазовой диаграммы. Фазовая диаграмма объединяет графики зависимости давления от температуры для равновесий фазовых переходов жидкость-газ, твердое тело-жидкость и твердое тело-газ. На этих диаграммах показаны физические состояния, существующие при определенных условиях давления и температуры, а также приведена зависимость от давления температур фазовых переходов (температуры плавления, сублимации, кипения). Типичная фазовая диаграмма чистого вещества показана на рисунке \(\PageIndex{2}\).
Принимая во внимание определение точки кипения, графики зависимости давления пара от температуры показывают, как точка кипения жидкости зависит от давления. Описано также использование кривых нагрева и охлаждения для определения температуры плавления (или замерзания) вещества. Выполнение таких измерений в широком диапазоне давлений дает данные, которые можно представить графически в виде фазовой диаграммы. Фазовая диаграмма объединяет графики зависимости давления от температуры для равновесий фазовых переходов жидкость-газ, твердое тело-жидкость и твердое тело-газ. На этих диаграммах показаны физические состояния, существующие при определенных условиях давления и температуры, а также приведена зависимость от давления температур фазовых переходов (температуры плавления, сублимации, кипения). Типичная фазовая диаграмма чистого вещества показана на рисунке \(\PageIndex{2}\).
Рисунок \(\PageIndex{2}\): Физическое состояние вещества и температуры его фазовых переходов представлены графически на фазовой диаграмме.
Чтобы проиллюстрировать полезность этих графиков, рассмотрим фазовую диаграмму воды, показанную на рисунке \(\PageIndex{3}\).
Рисунок \(\PageIndex{3}\): Оси давления и температуры на этой фазовой диаграмме воды не нарисованы в постоянном масштабе, чтобы проиллюстрировать несколько важных свойств.
Мы можем использовать фазовую диаграмму для определения физического состояния образца воды при заданных условиях давления и температуры. Например, давление 50 кПа и температура -10 °С соответствуют области диаграммы, обозначенной как «лед». В этих условиях вода существует только в твердом состоянии (лед). Давление 50 кПа и температура 50 °С соответствуют области «вода» — здесь вода существует только в виде жидкости. При 25 кПа и 200 °C вода существует только в газообразном состоянии. Обратите внимание, что на H 
Кривая BC на рисунке \(\PageIndex{3}\) представляет собой график зависимости давления паров от температуры, как описано в предыдущем модуле этой главы. Эта кривая «жидкость-пар» разделяет жидкую и газообразную области фазовой диаграммы и дает точку кипения воды при любом давлении. Например, при 1 атм температура кипения составляет 100°С. Обратите внимание, что кривая жидкость-пар заканчивается при температуре 374 °C и давлении 218 атм, что указывает на то, что вода не может существовать в жидком состоянии выше этой температуры, независимо от давления. Физические свойства воды в этих условиях занимают промежуточное положение между свойствами ее жидкой и газообразной фаз. Это уникальное состояние вещества называется сверхкритической жидкостью, и эта тема будет описана в следующем разделе этого модуля.
Кривая твердого тела-пара, обозначенная AB на рисунке \(\PageIndex{3}\), показывает температуру и давление, при которых лед и водяной пар находятся в равновесии. Эти пары данных температура-давление соответствуют точкам сублимации или осаждения воды. Если бы мы могли увеличить линию твердого тела-газа на рисунке \(\PageIndex{2}\), мы бы увидели, что лед имеет давление паров около 0,20 кПа при -10 °C. Так, если поместить замороженный образец в вакуум с давлением менее 0,20 кПа, лед возгонится. Это лежит в основе процесса «сублимационной сушки», часто используемого для сохранения продуктов, таких как мороженое, показанное на рисунке \(\PageIndex{4}\).
Если бы мы могли увеличить линию твердого тела-газа на рисунке \(\PageIndex{2}\), мы бы увидели, что лед имеет давление паров около 0,20 кПа при -10 °C. Так, если поместить замороженный образец в вакуум с давлением менее 0,20 кПа, лед возгонится. Это лежит в основе процесса «сублимационной сушки», часто используемого для сохранения продуктов, таких как мороженое, показанное на рисунке \(\PageIndex{4}\).
>
Рисунок \(\PageIndex{4}\): Сублимированные продукты, такие как это мороженое, обезвоживаются путем сублимации при давлении ниже тройной точки для воды. (кредит: ʺlwaoʺ/Flickr)
Кривая твердого тела и жидкости, обозначенная BD, показывает температуры и давления, при которых лед и жидкая вода находятся в равновесии, представляя точки плавления/замерзания воды. Обратите внимание, что эта кривая имеет небольшой отрицательный наклон (сильно преувеличенный для ясности), что указывает на то, что температура плавления воды немного снижается при увеличении давления.
Рисунок \(\PageIndex{5}\): Огромное давление под ледниками приводит к их частичному таянию, образуя слой воды, обеспечивающий смазку, способствующую движению ледников. На этом спутниковом снимке показан наступающий край ледника Перито-Морено в Аргентине. (кредит: НАСА)
Точка пересечения всех трех кривых обозначена буквой B на рисунке \(\PageIndex{3}\). При давлении и температуре, представленных этой точкой, все три фазы воды сосуществуют в равновесии. Эта пара данных температура-давление называется тройной точкой. При давлении ниже тройной точки вода не может существовать в жидком состоянии независимо от температуры.
Видео \(\PageIndex{1}\): Циклогексан в тройной точке.
Пример \(\PageIndex{2}\): определение состояния воды
Используя диаграмму состояния воды, приведенную на рис. 10.4.2, определите состояние воды при следующих температурах и давлениях:
- −10 °C и 50 кПа
- 25 °C и 90 кПа
- 50 °C и 40 кПа
- 80 °C и 5 кПа
- −10 °C и 0,3 кПа
- 50 °C и 0,3 кПа
Раствор
Используя фазовую диаграмму для воды, мы можем определить, что состояние воды при каждой заданной температуре и давлении следующее: (а) твердое; (б) жидкость; (в) жидкость; (г) газ; (д) твердый; (е) газ.
Упражнение \(\PageIndex{2}\)
Какие фазовые превращения может претерпевать вода при изменении температуры, если поддерживать давление на уровне 0,3 кПа? Если давление держится на уровне 50 кПа?
- Ответ:
При 0,3 кПа: с⟶ г при −58 °C.
 При 50 кПа: s⟶ l при 0 °C, l ⟶ g при 78 °C
При 50 кПа: s⟶ l при 0 °C, l ⟶ g при 78 °C
В качестве другого примера рассмотрим фазовую диаграмму двуокиси углерода, показанную на рисунке \(\PageIndex{6}\). Кривая твердое тело-жидкость имеет положительный наклон, что указывает на то, что температура плавления CO 2 увеличивается с давлением, как и для большинства веществ (вода является заметным исключением, как описано ранее). Обратите внимание, что тройная точка намного выше 1 атм, что указывает на то, что углекислый газ не может существовать в виде жидкости в условиях атмосферного давления. Вместо этого охлаждение газообразного диоксида углерода до 1 атм приводит к его осаждению в твердом состоянии. Точно так же твердый диоксид углерода не плавится при давлении 1 атм, а возгоняется с образованием газообразного CO 9 .0142 2 . Наконец, обратите внимание, что критическая точка для углекислого газа наблюдается при относительно скромных температуре и давлении по сравнению с водой.
Рисунок \(\PageIndex{6}\) : Показана фазовая диаграмма двуокиси углерода. Ось давления построена в логарифмическом масштабе, чтобы соответствовать большому диапазону значений.
Ось давления построена в логарифмическом масштабе, чтобы соответствовать большому диапазону значений.
Пример \(\PageIndex{3}\): определение состояния углекислого газа
Используя фазовую диаграмму для углекислого газа, показанную на рисунке 10.4.5, определите состояние CO 2 при следующих температурах и давлениях:
- −30 °C и 2000 кПа
- −60 °C и 1000 кПа
- −60 °C и 100 кПа
- 20 °C и 1500 кПа
- 0 °C и 100 кПа
- 20 °C и 100 кПа
Раствор
Используя приведенную фазовую диаграмму для двуокиси углерода, мы можем определить, что состояние CO 2 при каждой заданной температуре и давлении следующее: (а) жидкость; (б) твердый; (в) газ; (г) жидкость; д) газ; (е) газ.
Упражнение \(\PageIndex{3}\)
Определите, какие фазовые изменения претерпевает углекислый газ, когда его температура изменяется, при этом его давление остается постоянным на уровне 1500 кПа? При 500 кПа? При каких примерных температурах происходят эти фазовые превращения?
- Ответить
при 1500 кПа: с⟶л при -45°С, л⟶г при -10°С; при 500 кПа: с⟶ г при −58 °C
Сверхкритические жидкости
Видео \(\PageIndex{2}\): Наблюдайте за поведением сверхкритических флюидов.
Если мы поместим образец воды в герметичный контейнер при 25 °C, удалив воздух и позволив установиться равновесию испарения-конденсации, мы получим смесь жидкой воды и водяного пара при давлении 0,03 банкомат Отчетливо наблюдается четкая граница между более плотной жидкостью и менее плотным газом. По мере повышения температуры давление водяного пара увеличивается, как описано кривой жидкость-газ на фазовой диаграмме воды (рис. \(\PageIndex{3}\)), и двухфазное равновесие жидкости и остается газообразная фаза. При температуре 374 °С давление пара возросло до 218 атм, и дальнейшее повышение температуры приводит к исчезновению границы между жидкой и паровой фазами. Вся вода в сосуде теперь находится в одной фазе, физические свойства которой занимают промежуточное положение между газообразным и жидким состояниями. Эта фаза вещества называется сверхкритической жидкостью, а температура и давление, выше которых эта фаза существует, являются критической точкой (рис. \(\PageIndex{5}\)). При температуре выше критической газ не может сжижаться, какое бы давление ни применялось. Давление, необходимое для сжижения газа при его критической температуре, называется критическим давлением. Критические температуры и критические давления некоторых обычных веществ приведены в таблице \(\PageIndex{1}\).
Эта фаза вещества называется сверхкритической жидкостью, а температура и давление, выше которых эта фаза существует, являются критической точкой (рис. \(\PageIndex{5}\)). При температуре выше критической газ не может сжижаться, какое бы давление ни применялось. Давление, необходимое для сжижения газа при его критической температуре, называется критическим давлением. Критические температуры и критические давления некоторых обычных веществ приведены в таблице \(\PageIndex{1}\).
| Вещество | Критическая температура (К) | Критическое давление (атм) |
|---|---|---|
| водород | 33,2 | 12,8 |
| азот | 126.0 | 33,5 |
| кислород | 154,3 | 49,7 |
| двуокись углерода | 304,2 | 73,0 |
| аммиак | 405,5 | 111,5 |
| диоксид серы | 430,3 | 77,7 |
| вода | 647. 1 1 | 217,7 |
Видео \(\PageIndex{3}\): Переход из жидкости в сверхкритическую жидкость для двуокиси углерода.
Подобно газу, сверхкритическая жидкость будет расширяться и заполнять контейнер, но ее плотность намного выше, чем у обычного газа, и обычно близка к плотности жидкости. Подобно жидкостям, эти жидкости способны растворять нелетучие растворенные вещества. Однако они практически не проявляют поверхностного натяжения и имеют очень низкую вязкость, поэтому они могут более эффективно проникать в очень маленькие отверстия в твердой смеси и удалять растворимые компоненты. Эти свойства делают сверхкритические жидкости чрезвычайно полезными растворителями для широкого спектра применений. Например, сверхкритический диоксид углерода стал очень популярным растворителем в пищевой промышленности, его используют для декофеинизации кофе, удаления жиров из картофельных чипсов и извлечения вкусовых и ароматических соединений из цитрусовых масел. Он нетоксичен, относительно недорог и не считается загрязнителем. После использования CO 2 можно легко восстановить, снизив давление и собрав образовавшийся газ.
Он нетоксичен, относительно недорог и не считается загрязнителем. После использования CO 2 можно легко восстановить, снизив давление и собрав образовавшийся газ.
Рисунок \(\PageIndex{7}\): (а) Герметичный контейнер с жидким диоксидом углерода нагревается немного ниже его критической точки, что приводит к (б) образованию сверхкритической флюидной фазы. Охлаждение сверхкритической жидкости снижает ее температуру и давление ниже критической точки, что приводит к восстановлению отдельных жидких и газообразных фаз (c и d). Цветные поплавки иллюстрируют разницу в плотности между жидким, газообразным и сверхкритическим флюидным состоянием. (кредит: модификация работы «mrmrobin»/YouTube)
Пример \(\PageIndex{4}\): Критическая температура углекислого газа
Если встряхнуть углекислотный огнетушитель в прохладный день (18 °C), мы услышим, как жидкий CO 2 плещется. внутри цилиндра. Однако тот же самый цилиндр не содержит жидкости в жаркий летний день (35 °C). Объясните эти наблюдения.
Объясните эти наблюдения.
Раствор
В прохладный день температура СО 2 ниже критической температуры СО 2 , 304 K или 31 °C (таблица \(\PageIndex{1}\)), поэтому в цилиндре присутствует жидкий CO 2 . В жаркий день температура CO 2 выше его критической температуры 31 °C. Выше этой температуры никакое давление не может сжижать CO 2 , поэтому в огнетушителе нет жидкого CO 2 .
Упражнение \(\PageIndex{4}\)
Аммиак можно сжижать путем сжатия при комнатной температуре; кислород не может быть сжижен в этих условиях. Почему два газа ведут себя по-разному?
- Ответить
Критическая температура аммиака составляет 405,5 К, что выше комнатной температуры. Критическая температура кислорода ниже комнатной температуры; таким образом, кислород не может быть сжижен при комнатной температуре.
Декофеинизация кофе с использованием сверхкритического CO
2 Кофе является вторым наиболее широко продаваемым товаром в мире после нефти. Во всем мире люди любят аромат и вкус кофе. Многие из нас также зависят от одного компонента кофе — кофеина, который помогает нам двигаться утром или сохранять бодрость днем. Но в конце дня стимулирующий эффект кофе может помешать вам уснуть, поэтому вечером вы можете пить кофе без кофеина.
Во всем мире люди любят аромат и вкус кофе. Многие из нас также зависят от одного компонента кофе — кофеина, который помогает нам двигаться утром или сохранять бодрость днем. Но в конце дня стимулирующий эффект кофе может помешать вам уснуть, поэтому вечером вы можете пить кофе без кофеина.
С начала 1900-х годов для удаления кофеина из кофе применялось множество методов. У всех есть преимущества и недостатки, и все зависит от физических и химических свойств кофеина. Поскольку кофеин представляет собой несколько полярную молекулу, он хорошо растворяется в воде, полярной жидкости. Однако, поскольку многие из более чем 400 других соединений, влияющих на вкус и аромат кофе, также растворяются в H 2 O, процессы декофеинизации горячей водой также могут удалить некоторые из этих соединений, что отрицательно скажется на запахе и вкусе кофе без кофеина. Дихлорметан (СН 2 Cl 2 ) и этилацетат (CH 3 CO 2 C 2 H 5 ) имеют полярность, аналогичную кофеину, и поэтому являются очень эффективными растворителями для экстракции кофеина, но оба они также удаляют некоторые компоненты вкуса и аромата, и их использование требует длительного времени экстракции и очистки. Поскольку оба этих растворителя являются токсичными, возникают опасения по поводу воздействия остаточного растворителя, остающегося в кофе без кофеина, на здоровье.
Поскольку оба этих растворителя являются токсичными, возникают опасения по поводу воздействия остаточного растворителя, остающегося в кофе без кофеина, на здоровье.
Рисунок \(\PageIndex{8}\): (a) Молекулы кофеина имеют как полярные, так и неполярные области, что делает его растворимым в растворителях различной полярности. (b) На схеме показан типичный процесс удаления кофеина с использованием сверхкритического диоксида углерода.
Сверхкритическая флюидная экстракция с использованием диоксида углерода в настоящее время широко используется как более эффективный и экологически безопасный метод удаления кофеина (рис. \(\PageIndex{8}\)). При температуре выше 304,2 К и давлении выше 7376 кПа СО 2 — сверхкритическая жидкость, обладающая свойствами как газа, так и жидкости. Подобно газу, он проникает глубоко в кофейные зерна; подобно жидкости, он эффективно растворяет определенные вещества. Экстракция пропаренных кофейных зерен сверхкритическим диоксидом углерода удаляет 97-99% кофеина, оставляя вкусовые и ароматические соединения кофе нетронутыми. Поскольку CO 2 представляет собой газ при стандартных условиях, его удаление из экстрагированных кофейных зерен осуществляется легко, как и извлечение кофеина из экстракта. Кофеин, извлеченный из кофейных зерен с помощью этого процесса, является ценным продуктом, который впоследствии можно использовать в качестве добавки к другим продуктам питания или лекарствам.
Поскольку CO 2 представляет собой газ при стандартных условиях, его удаление из экстрагированных кофейных зерен осуществляется легко, как и извлечение кофеина из экстракта. Кофеин, извлеченный из кофейных зерен с помощью этого процесса, является ценным продуктом, который впоследствии можно использовать в качестве добавки к другим продуктам питания или лекарствам.
Сводка
Видео \(\PageIndex{4}\): Обзор фазовых переходов и фазовых диаграмм.
Температуры, при которых происходят фазовые переходы, определяются относительной силой межмолекулярного притяжения и, следовательно, зависят от химической идентичности вещества. Условия температуры и давления, при которых вещество существует в твердом, жидком и газообразном состояниях, суммированы на фазовой диаграмме для этого вещества. Фазовые диаграммы представляют собой объединенные графики трех кривых равновесия давления и температуры: твердое тело-жидкость, жидкость-газ и твердое тело-газ. Эти кривые представляют отношения между температурами фазового перехода и давлениями. Точка пересечения всех трех кривых представляет тройную точку вещества — температуру и давление, при которых все три фазы находятся в равновесии. При давлениях ниже тройной точки вещество не может существовать в жидком состоянии независимо от его температуры. Конец кривой жидкость-газ представляет критическую точку вещества, давление и температуру, выше которых не может существовать жидкая фаза. 9{−ΔH_\ce{испарение}/RT}\)
Эти кривые представляют отношения между температурами фазового перехода и давлениями. Точка пересечения всех трех кривых представляет тройную точку вещества — температуру и давление, при которых все три фазы находятся в равновесии. При давлениях ниже тройной точки вещество не может существовать в жидком состоянии независимо от его температуры. Конец кривой жидкость-газ представляет критическую точку вещества, давление и температуру, выше которых не может существовать жидкая фаза. 9{−ΔH_\ce{испарение}/RT}\)
Глоссарий
- критическая точка
- температура и давление, выше которых газ не может сконденсироваться в жидкость
- фазовая диаграмма
- график давление-температура, обобщающий условия, при которых могут существовать фазы вещества
- сверхкритическая жидкость
- вещество при температуре и давлении выше его критической точки; проявляет промежуточные свойства между газообразным и жидким состояниями
- тройная точка
- температура и давление, при которых паровая, жидкая и твердая фазы вещества находятся в равновесии
Авторы
Пол Флауэрс (Университет Северной Каролины, Пемброк), Клаус Теопольд (Университет Делавэра) и Ричард Лэнгли (Государственный университет Стивена Ф.
 Остина) с соавторами. Контент учебника, созданный OpenStax College, находится под лицензией Creative Commons Attribution License 4.0. Скачать бесплатно на http://cnx.org/contents/85abf193-2бд…[email protected]).
Остина) с соавторами. Контент учебника, созданный OpenStax College, находится под лицензией Creative Commons Attribution License 4.0. Скачать бесплатно на http://cnx.org/contents/85abf193-2бд…[email protected]).- Аделаида Кларк, Орегонский технологический институт
- Ускоренный курс Физика: Ускоренный курс является подразделением компании Complexly, и видео можно бесплатно транслировать в образовательных целях.
Обратная связь
Хотите оставить отзыв об этом тексте? Кликните сюда.
Нашли опечатку и хотите получить дополнительные баллы? Кликните сюда.
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или Страница
- Лицензия
- СС BY
- Показать страницу TOC
- № на стр.

- Теги
Простое введение в науку о тепловой энергии
Криса Вудфорда. Последнее обновление: 24 марта 2022 г.
Коснитесь радиатора, и он станет горячим. Окуните палец в воду из-под крана, и он станет холодным. Это не просто! Но что, если белый медведь, привыкший к арктическим морозам, прикоснется к тем же вещам? И то, и другое может показаться полярному медведю жарким, потому что он живет в гораздо более холодных условиях, чем мы. «Горячий» и «холодный» — это относительные термины, которые мы можем использовать для сравнения того, как вещи себя чувствуют, когда они обладают большей или меньшей энергией определенного вида, который мы называем теплом. Что это такое, откуда оно берется и как оно перемещается по нашему миру? Давайте узнаем больше!
Фото: Вот это я называю жарой! Температуру горячего выхлопа ракеты вы можете увидеть здесь,
во время запуска космического челнока, что-то вроде 3300°C (6000°F). Фото любезно предоставлено НАСА на Викискладе.
Фото любезно предоставлено НАСА на Викискладе.
Содержание
- Что такое тепло?
- Что происходит, когда что-то совсем не нагревается?
- Какая разница между теплом и температурой?
- Как мы можем измерить температуру?
- Как распространяется тепло?
- Проводка
- Конвекция
- Радиация
- Почему одни вещи нагреваются дольше, чем другие?
- Скрытая теплота
- Узнать больше
Что такое тепло?
Тепло — это сокращенное название «тепловая энергия». Когда что-то горячее, оно имеет много тепловая энергия; когда холодно, меньше. Но даже вещи, которые кажутся холодными (например, белые медведи и айсберги), обладают гораздо большей тепловой энергией, чем вы можете предположить.
Объекты могут накапливать тепло, потому что атомы и молекулы внутри них толкаются и натыкаются друг на друга, как люди в толпе. Эта идея называется
кинетическая теория материи, потому что она описывает тепло как своего рода
кинетическая энергия (энергия, которой обладают вещи, потому что они движутся), хранящаяся в атомах и молекулах, из которых состоят материалы.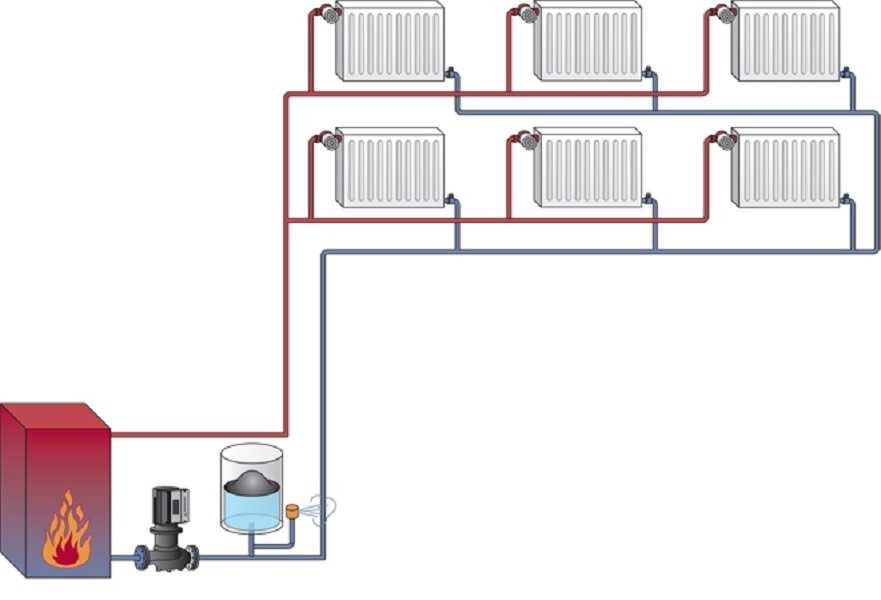 Он был разработан в 19 веке разными учеными, в том числе австрийским физиком
Людвиг Больцман (1844–1906) и британский физик Джеймс Клерк Максвелл (1831–1879).). Если вам интересно, вот более подробное введение в кинетическую теорию.
Он был разработан в 19 веке разными учеными, в том числе австрийским физиком
Людвиг Больцман (1844–1906) и британский физик Джеймс Клерк Максвелл (1831–1879).). Если вам интересно, вот более подробное введение в кинетическую теорию.
Художественное произведение: более горячие предметы имеют больше тепловой энергии, чем более холодные. Это потому, что атомы или молекулы движутся быстрее в горячих вещах (красный, справа), чем в холодных вещах (синий, слева). Эта идея называется кинетическая теория.
Кинетическая теория помогает нам понять, куда уходит энергия, когда мы что-то нагреваем. Если вы поставите кастрюлю с холодной водой на горячую плиту, вы заставите молекулы воды двигаться быстрее. Чем больше тепла вы подаете, тем быстрее движутся молекулы и тем дальше они удаляются друг от друга. В конце концов, они так сильно натыкаются, что отрываются друг от друга. В этот момент жидкость, которую вы нагревали, превращается в газ: ваша вода превращается в пар и начинает испаряться.
Что происходит, когда что-то совсем не нагревается?
Теперь предположим, что мы попробуем противоположный трюк. Давайте возьмем кувшин с водой и поставим его в холодильник, чтобы охладить. Холодильник работает, систематически удаляя тепловую энергию из продуктов. Поместите воду в холодильник, и он сразу же начнет терять тепловую энергию. Чем больше тепла он теряет, тем больше кинетической энергии теряют его молекулы, тем медленнее они движутся и тем ближе подбираются. Рано или поздно они подходят достаточно близко, чтобы слиться в кристаллы; жидкость превращается в твердое вещество; и вы оказываетесь с кувшином льда!
Но что, если у вас есть супер-потрясающий холодильник, который постоянно охлаждает воду, и она становится все холоднее… и холоднее… и холоднее. Домашняя морозильная камера, если она у вас есть, может понизить температуру где-то между -10°C и -20°C (от 14°F до -4°F). Но что, если продолжать охлаждать ниже этого значения, забирая еще больше тепловой энергии? В конце концов вы достигнете температуры, при которой молекулы воды почти полностью перестанут двигаться, потому что у них совсем не останется кинетической энергии. По причинам, которые мы не будем здесь обсуждать, эта волшебная температура составляет −273,15.
° С (-4590,67 ° F), и мы называем его абсолютным нулем.
По причинам, которые мы не будем здесь обсуждать, эта волшебная температура составляет −273,15.
° С (-4590,67 ° F), и мы называем его абсолютным нулем.
Фото: Лед может показаться холодным, но он намного горячее абсолютного нуля. Фотография Эриха Регера предоставлена Службой охраны рыбных ресурсов и дикой природы США.
Теоретически абсолютный ноль — это самая низкая температура, которую когда-либо можно достичь. На практике настолько охладить что-либо практически невозможно — ученые очень старались, но так и не достигли такой низкой температуры. Удивительные вещи случаются, когда вы приближаетесь к абсолютному нулю. Некоторые материалы, например, могут потерять практически все свое сопротивление и стать удивительными проводниками электричества, называемыми сверхпроводниками. Есть отличный веб-сайт PBS, на котором можно узнать гораздо больше об абсолютном нуле и о замечательных вещах, которые там происходят.
В чем разница между теплом и температурой?
Теперь, когда вы знаете об абсолютном нуле, легко понять, почему что-то вроде айсберга (который может иметь холодную температуру около 3-4°C или около 40°F) является относительно горячим. По сравнению с абсолютным нулем все в нашем повседневном мире горячо, потому что его молекулы движутся и обладают хоть какой-то тепловой энергией. Все вокруг нас также имеет гораздо более высокую температуру, чем абсолютный ноль.
По сравнению с абсолютным нулем все в нашем повседневном мире горячо, потому что его молекулы движутся и обладают хоть какой-то тепловой энергией. Все вокруг нас также имеет гораздо более высокую температуру, чем абсолютный ноль.
Вы можете видеть, что существует тесная связь между количеством тепловой энергии чего-либо и его температурой. Значит, тепловая энергия и температура — это одно и то же? Нет! Давайте разберемся:
- Тепло — это энергия, хранящаяся внутри чего-либо.
- Температура — это мера того, насколько горячим или холодным является что-либо.
Температура объекта не говорит нам, сколько у него тепловой энергии. Легко понять, почему нет, если подумать об айсберге и кубике льда. Оба имеют более или менее одинаковую температуру, но поскольку айсберг имеет гораздо большую массу, чем кубик льда, он содержит на миллиарды больше молекул и намного больше тепловой энергии. Айсберг может содержать даже больше тепловой энергии, чем чашка кофе или раскаленный докрасна железный стержень. Это потому, что он больше и содержит гораздо больше молекул, каждая из которых имеет некоторую тепловую энергию. Кофе и железный батончик более горячие (имеют более высокую температуру), но айсберг держит больше тепла, потому что он больше.
Это потому, что он больше и содержит гораздо больше молекул, каждая из которых имеет некоторую тепловую энергию. Кофе и железный батончик более горячие (имеют более высокую температуру), но айсберг держит больше тепла, потому что он больше.
Работа: Айсберг намного холоднее чашки кофе, но он содержит больше тепловой энергии, потому что он намного больше.
Как мы можем измерить температуру?
Термометр измеряет, насколько что-то горячо, а не количество тепловой энергии, которое оно содержит. Два объекта с одинаковой температурой одинаково горячие, но один из них может содержать гораздо больше тепловой энергии, чем другой. Мы можем сравнивать температуры разных вещей, используя две распространенные (и довольно произвольные) шкалы, называемые Цельсия (или по Цельсию) и Фаренгейта, названные в честь шведского астронома Андерса Цельсия (1701–1744) и немецкого физика Даниэля Фаренгейта (1686–1736).
Существует также научная температурная шкала Кельвина (или абсолютная шкала), названная в честь британского физика Уильяма Томпсона (впоследствии лорда Кельвина, 1824–1907). Логически, шкала Кельвина имеет гораздо больше смысла для ученых, потому что она идет вверх от абсолютного нуля (который также известен как 0K, без символа градуса между нулем и K). В физике вы встретите множество значений температуры Кельвина, но вы не найдете синоптиков, сообщающих вам температуру таким образом. Для справки, достаточно жаркий день (20–30°C) наступает примерно при 29°C.0–300K: вы просто добавляете 273 к значению по Цельсию, чтобы преобразовать его в кельвины.
Логически, шкала Кельвина имеет гораздо больше смысла для ученых, потому что она идет вверх от абсолютного нуля (который также известен как 0K, без символа градуса между нулем и K). В физике вы встретите множество значений температуры Кельвина, но вы не найдете синоптиков, сообщающих вам температуру таким образом. Для справки, достаточно жаркий день (20–30°C) наступает примерно при 29°C.0–300K: вы просто добавляете 273 к значению по Цельсию, чтобы преобразовать его в кельвины.
Как распространяется тепло?
Одна вещь, которую вы, вероятно, заметили в отношении тепла, заключается в том, что оно обычно не остается там, где вы его поместили. Горячее становится холоднее, холодное — горячее, и — по прошествии достаточного времени — большинство вещей в конечном итоге такая же температура. Почему?
Есть основной закон физики, называемый вторым законом термодинамики, и он гласит:
по сути, чашки кофе всегда остывают, а мороженое всегда
таять: тепло течет от горячих предметов к холодным, а не наоборот
наоборот. Вы никогда не увидите, чтобы кофе кипел сам по себе или мороженое.
становится холоднее в солнечные дни! Второй закон термодинамики
также несет ответственность за болезненные счета за топливо, которые падают через ваши
почтовый ящик несколько раз в год. Короче говоря: чем горячее вы делаете свой
дома и чем холоднее на улице, тем больше тепла вы собираетесь
терять. Чтобы уменьшить эту проблему, вам нужно понять три
различные пути распространения тепла: теплопроводность,
конвекция и излучение. Иногда вы увидите, что они упоминаются
как три вида теплопередачи.
Вы никогда не увидите, чтобы кофе кипел сам по себе или мороженое.
становится холоднее в солнечные дни! Второй закон термодинамики
также несет ответственность за болезненные счета за топливо, которые падают через ваши
почтовый ящик несколько раз в год. Короче говоря: чем горячее вы делаете свой
дома и чем холоднее на улице, тем больше тепла вы собираетесь
терять. Чтобы уменьшить эту проблему, вам нужно понять три
различные пути распространения тепла: теплопроводность,
конвекция и излучение. Иногда вы увидите, что они упоминаются
как три вида теплопередачи.
Теплопроводность
Теплопроводность — это то, как тепло течет между двумя твердыми телами, находящимися на разных
температуры и соприкосновения друг с другом (или между двумя частями
один и тот же твердый объект, если они находятся при разных температурах). Прогулка по
каменный пол в твоих босых ногах и кажется холодным, потому что течет тепло
быстро из вашего тела в пол по проводимости. Размешайте
кастрюлю супа с металлической ложкой, и вам скоро придется найти
деревянную: тепло быстро распространяется по ложке
проводимость из горячего супа в пальцы.
Анимация: Когда вы держите железный прут в огне, тепло распространяется по металлу за счет проводимость (красная стрелка). Почему? Атомы на горячем конце движутся быстрее, поскольку поглощают тепло огня. Они постепенно передают свою энергию дальше по планке, в конечном итоге прогревая все это дело.
Конвекция
Конвекция — это основной способ передачи тепла через жидкости и газы. Ставим кастрюлю с холодной, жидкой
суп на плите и включите огонь. Суп на дне
сковорода, ближайшая к огню, быстро прогревается и становится менее плотной
(светлее), чем холодный суп выше. Более теплый суп поднимается вверх и
более холодный суп сверху падает, чтобы занять его место. Очень скоро
у вас есть циркуляция тепла, проходящего через кастрюлю, что-то вроде
невидимый тепловой конвейер, с подогревом, подъемом супа и охлаждением,
падающий суп. Постепенно вся сковорода нагревается. Конвекция тоже есть
один из способов, которым наши дома нагреваются, когда мы включаем отопление. Воздуха
прогревается над обогревателями и поднимается в воздух, выталкивая холодный воздух
вниз с потолка. Вскоре происходит циркуляция
который постепенно прогревает всю комнату.
Воздуха
прогревается над обогревателями и поднимается в воздух, выталкивая холодный воздух
вниз с потолка. Вскоре происходит циркуляция
который постепенно прогревает всю комнату.
Анимация: Как конвекция накачивает тепло в кастрюлю. Схема нагревания, подъема супа (красные стрелки) и опускания, охлаждения супа (синие стрелки) работает как конвейер, который переносит тепло от плиты в суп (оранжевые стрелки).
Излучение
Изображение: Инфракрасные тепловые изображения (иногда называемые термографами или термограммами) показывают, что все объекты выделяют некоторую тепловую энергию путем излучения. На этих двух фотографиях вы можете увидеть ракету на стартовой площадке, сфотографированную обычной камерой (вверху) и инфракрасной тепловизионной камерой (внизу). Самые холодные части — фиолетовые, синие и черные; самые горячие области — красные, желтые и белые. Фото Р. Хёрта, НАСА/Лаборатория реактивного движения-Калифорнийский технологический институт, предоставлено НАСА.
Излучение — третий основной путь распространения тепла. Теплопроводность переносит тепло через твердые вещества; конвекция переносит тепло через жидкости и газы; но излучение может переносить тепло через пустое пространство — даже через вакуум. Мы знаем это просто потому, что мы живы: почти все, что мы делаем, на Земле питается от солнечной радиации, направленной на нашу планету из Солнце сквозь воющую пустую тьму космоса. Но есть много теплового излучения на Земле тоже. Сядьте возле потрескивающего костра и вы почувствуете, как жар исходит наружу и обжигает ваши щеки. Вы не соприкасаетесь с огнём, так что тепло к вам не идёт за счет теплопроводности, а если вы на улице, конвекции, вероятно, нет. нести многое к вам либо. Вместо этого все тепло, которое вы чувствуете распространяется излучением — по прямой, со скоростью свет, переносимый типом электромагнетизма, называемым инфракрасная радиация.
Почему некоторые вещи нагреваются дольше, чем другие?
Различные материалы могут накапливать больше или меньше тепла в зависимости от их внутренней атомной или молекулярной структуры.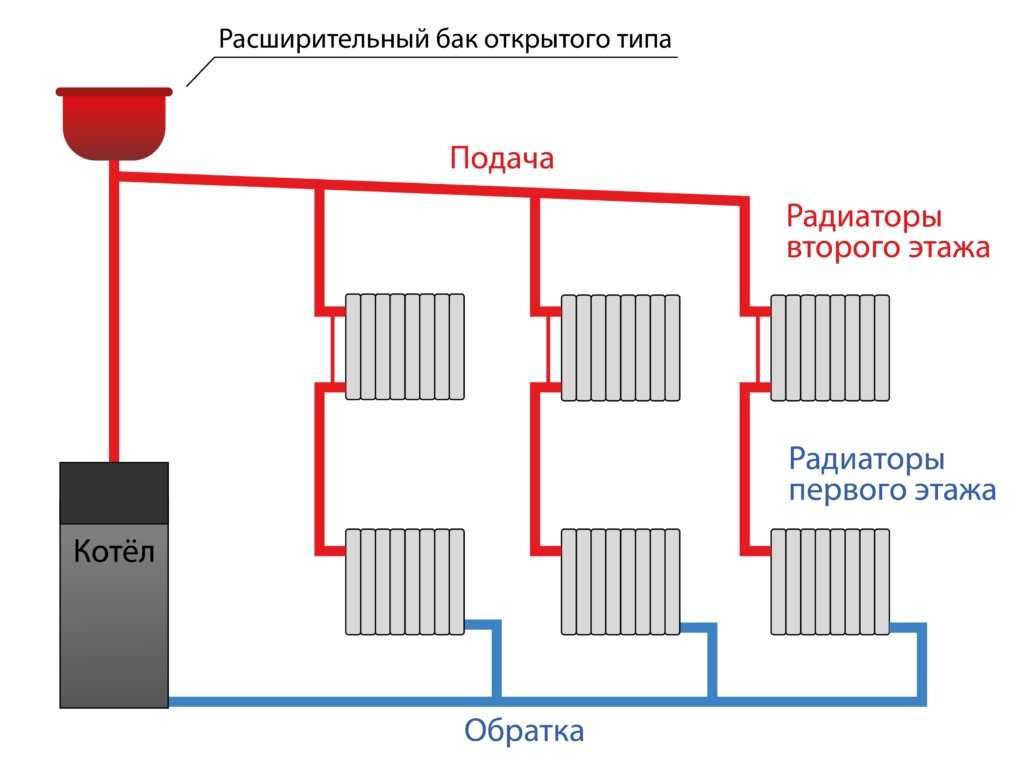 Вода, например, может хранить огромное количество тепла — это одна из причин, по которой мы используем ее в системах центрального отопления, — хотя для ее нагрева также требуется относительно много времени. Металлы очень хорошо пропускают тепло и быстро нагреваются, но плохо сохраняют тепло. Говорят, что вещества, которые хорошо сохраняют тепло (например, вода), обладают высокой удельной теплоемкостью.
Вода, например, может хранить огромное количество тепла — это одна из причин, по которой мы используем ее в системах центрального отопления, — хотя для ее нагрева также требуется относительно много времени. Металлы очень хорошо пропускают тепло и быстро нагреваются, но плохо сохраняют тепло. Говорят, что вещества, которые хорошо сохраняют тепло (например, вода), обладают высокой удельной теплоемкостью.
Идея удельной теплоемкости помогает нам по-другому понять разницу между теплом и температурой. Предположим, вы ставите пустую медную кастрюлю на горячую плиту определенной температуры. Медь очень хорошо проводит тепло и имеет относительно низкую удельную теплоемкость, поэтому она очень быстро нагревается и остывает (поэтому кастрюли, как правило, имеют медное дно). Но если вы наполните ту же кастрюлю водой, она нагреется до той же температуры гораздо дольше. Почему? Потому что вам нужно поставить гораздо больше тепловой энергии, чтобы поднять температуру воды на ту же величину. Удельная теплоемкость воды примерно в 11 раз выше, чем у меди, поэтому при одинаковой массе воды и меди потребуется в 11 раз больше энергии, чтобы поднять температуру воды на то же число градусов.
Таблица: Бытовые материалы имеют очень разную удельную теплоемкость. Металлы (синего цвета) имеют низкую удельную теплоемкость: они хорошо проводят тепло и плохо его сохраняют, поэтому на ощупь они холодные. Керамические/минеральные материалы (оранжевые) имеют более высокую удельную теплоемкость: они не проводят тепло так хорошо, как металлы, лучше его сохраняют и при прикосновении к ним ощущаются немного теплее. Органические изоляционные материалы (зеленые), такие как дерево и кожа, очень плохо проводят тепло и хорошо его сохраняют, поэтому на ощупь они теплые. Обладая очень высокой удельной теплоемкостью, вода (желтая) находится в своем собственном классе.
Удельная теплоемкость может помочь вам понять, что происходит, когда вы отапливаете свой дом разными способами в зимнее время. Воздух нагревается относительно быстро по двум причинам: во-первых, потому что удельная теплоемкость воздуха составляет около четверти удельной теплоемкости воды; во-вторых, поскольку воздух представляет собой газ, он имеет относительно небольшую массу. Если в вашей комнате холодно и вы включаете вентилятор (конвекционный) обогреватель, вы обнаружите, что все нагревается очень быстро. Это потому, что вы, по сути, просто нагреваете воздух. Выключите тепловентилятор, и комната тоже довольно быстро остынет, потому что воздух сам по себе не имеет большой способности сохранять тепло.
Если в вашей комнате холодно и вы включаете вентилятор (конвекционный) обогреватель, вы обнаружите, что все нагревается очень быстро. Это потому, что вы, по сути, просто нагреваете воздух. Выключите тепловентилятор, и комната тоже довольно быстро остынет, потому что воздух сам по себе не имеет большой способности сохранять тепло.
Фото: Деревянная ложка намного теплее металлической, хотя оба имеют одинаковую температуру. Металлическая ложка легче отводит тепло от вашей руки, и именно это заставляет чувствовать себя холоднее.
Так как же сделать комнату действительно теплой? Не забывайте, что в нем не только воздух, который нужно нагреть, но и добротная мебель, ковры, шторы и многое другое. Нагрев этих вещей занимает гораздо больше времени, потому что они твердые и гораздо более массивные, чем воздух. Чем больше у вас в комнате холодных и твердых предметов, тем больше тепловой энергии вы должны выделить, чтобы нагреть их все до определенной температуры. Вам нужно будет нагреть их, используя проводимость и излучение, а также конвекцию, а это требует времени. Но поскольку твердые предметы хорошо сохраняют тепло, им также требуется время, чтобы остыть. Таким образом, если у вас есть достойная изоляция, чтобы остановить утечку тепла от стен, окон и т. Д., Как только ваша комната достигнет определенной температуры, она должна оставаться теплой в течение некоторого времени без необходимости дополнительного нагрева.
Но поскольку твердые предметы хорошо сохраняют тепло, им также требуется время, чтобы остыть. Таким образом, если у вас есть достойная изоляция, чтобы остановить утечку тепла от стен, окон и т. Д., Как только ваша комната достигнет определенной температуры, она должна оставаться теплой в течение некоторого времени без необходимости дополнительного нагрева.
Скрытая теплота
Всегда ли больше тепла делает более высокую температуру? Судя по тому, что мы сказали до сих пор, вы можете быть прощены за то, что думаете, что придать чему-то больше тепла всегда вызывает повышение температуры. Обычно это так, но не всегда.
Предположим, у вас есть кусок льда, плавающий в кастрюле с водой, и вы ставите его на горячую плиту. Если вы наклеите
термометр в смеси ледяной воды, вы обнаружите, что она составляет около 0°C (32°F) —
нормальная температура замерзания воды. Но если вы продолжите нагревать, вы найдете температуру
остается прежним, пока почти весь лед не растает, даже если вы поставляете больше
все время греть. Как будто смесь льда и воды принимает тепло
вы даете его и прячете его где-то. Как ни странно, именно это и происходит!
Как будто смесь льда и воды принимает тепло
вы даете его и прячете его где-то. Как ни странно, именно это и происходит!
Художественное произведение: Обычно вещи нагреваются (температура повышается), когда вы выделяете больше тепловой энергии. Этого не происходит в момент, когда что-то плавится (переходит из твердого состояния в жидкое) и испаряется (превращается в жидкое). из жидкости в газ). Вместо этого энергия, которую вы поставляете, используется для изменения состояния материи. Энергия никуда не исчезает: она хранится в виде скрытого тепла.
Когда вещество переходит из твердого состояния в жидкое или из жидкого в газообразное, для изменения его состояния требуется энергия. Например, чтобы превратить твердый лед в жидкую воду, вам нужно толкнуть молекулы воды.
внутри еще дальше друг от друга и разбить каркас (или кристаллическую структуру), который держит
их вместе. Таким образом, пока лед тает (другими словами, во время изменения состояния из твердой воды в жидкий лед), вся подводимая вами тепловая энергия используется для разделения молекул, и ничего не остается. для повышения температуры.
для повышения температуры.
Теплота, необходимая для превращения твердого тела в жидкость, называется скрытая теплота плавления. Скрытый означает скрытый и «латентный». теплота плавления» относится к скрытому теплу, участвующему в изменении состояния вещества. из твердого состояния в жидкое или наоборот. Точно так же вам нужно подавать тепло, чтобы изменить жидкости в газ, и это называется скрытой теплотой парообразования.
Скрытая теплота — это вид энергии, и, хотя она может показаться «скрытой», она не растворяется в воздухе. Когда жидкая вода замерзает и снова превращается в лед, снова выделяется скрытая теплота плавления. Это можно увидеть, если систематически охлаждать воду. Начнем с того, что температура воды регулярно падает по мере того, как вы отбираете тепловую энергию. Но в точке, где жидкая вода превращается в твердый лед, вы обнаружите, что вода замерзает, не становясь холоднее. Это потому, что скрытая теплота плавления теряется из жидкости по мере ее затвердевания, и это предотвращает столь быстрое падение температуры.