- Переход на водород
- создана новая технология получения водорода из воды
- Химики получили водород на катоде и аноде одновременно
- Решения для производства водорода | Возобновляемые источники энергии
- Получение водорода из морской воды с помощью солнечных панелей
- Новый пористый материал помогает получить возобновляемую энергию из воды
- Новый материал выделяет водород из воды с почти идеальной эффективностью
- Новый устойчивый способ производства водорода для топливных элементов и удобрений
- Новый метод разделения воды эффективно производит водородное топливо — ScienceDaily
- Производство водорода путем электролиза — бюллетень h3
- Производство водорода | Air Liquide Energies
- Химические реакции с выделением водорода
- История получения водорода
- Области применения
- Реакции с выделением водорода
- Получение водорода с помощью аппарата Киппа.
- Реакция с выделением водорода с участием сульфата меди, алюминия и соли
- Реакция с выделением водорода с использованием щелочных и щелочноземельных металлов и воды.
- Реакция выделения водорода с использованием кальция и воды
Переход на водород
Водород и сегодня используют для производства удобрений, повышения качества бензина, улучшения свойств стали, а также в пищевой промышленности для производства маргарина и твердых кондитерских жиров методом гидрогенизации растительных масел. Без него не обходятся все процессы гидроочистки, гидрообессеривания, гидрокрекинга, регенерации катализаторов. Его также широко применяют для охлаждения генераторов на электростанциях.
С тех пор как появилась перспектива перехода на водородную энергетику с углеводородной, потребность в водороде увеличилась на порядки. Сегодня эта перспектива стала реальностью, поскольку примерно десять лет назад была решена одна из основных проблем с его хранением для дальнейшего использования в качестве автомобильного топлива. Вместо тяжелых, дорогих и небезопасных стальных баллонов для сжатого под высоким давлением водорода стали применять легкие композитные емкости из углепластика, которые прекрасно помещаются в легковых автомобилях.
Около 20 лет назад во всем мире начали появляться автомобили на водороде, и бывшие выставочные центры пилотных моделей превратились в салоны-магазины серийных образцов. Количество автомобилей на водородном топливе сегодня исчисляется тысячами. Их стоимость составляет около $50–60 тыс. Серийные автомобили на водороде есть у Toyota, Hyundai, Honda. Предсерийные образцы тестируют Audi, Mercedes, BMW, Mazda, Ford и ряд других производителей. Все технические препятствия, столько десятилетий казавшиеся непреодолимыми, пройдены за считаные годы, и теперь вопрос только в экономической целесообразности для массового потребителя. В России такой автомобиль приобрел себе житель Красноярска, но в связи с отсутствием заправок в своем городе перевез машину в Москву и получает топливо в одном из научных институтов.
Как получить водород?
Для развития водородной энергетики нужно будет на государственном уровне решить вопрос, в каком виде доставлять водород к месту его получения. Дело в том, что водород содержится в очень многих видах ископаемых топлив.
Дело в том, что водород содержится в очень многих видах ископаемых топлив.
«Наиболее дешевый водород получается методом паровой конверсии метана,— рассказывает заведующий отделом гетерогенного катализа Института катализа СО РАН Павел Снытников.— Другой способ — из аммиака. Для его транспортировки, как и для природного газа, в нашей стране даже существует трубопровод, так как аммиак сжижается всего при давлении 8,5 атмосферы. Третье решение — перевозка будущего водорода в виде метанола. В Китае метанол используют как автомобильное топливо. Но в России против метанола почему-то предубеждение, по-видимому, в связи с тем, что с давних пор у нас простой народ пил все, что горело, в том числе и метанол, и люди лишались зрения».
А вот получать его лучше всего там же, где будут потреблять, чтобы уйти от проблем транспортировки чистого водорода. Чтобы использовать водород, например, как автомобильное топливо, нужно закачать его в баллоны под давлением 700 атмосфер. Правда, на сжатие нужна дополнительная энергия. Не меньше энергии требуется на сжижение водорода, так что один из подходящих способов его транспортировки — это перевозка в химически связанном состоянии, например в виде метана, из которого водород должен производиться там же, где будет использоваться. То есть до заправки везут метан, а уже на самой заправке устанавливается небольшое производство, например, конвертер метана в водород. Но этот способ не очень хорош для экологии, поскольку на небольших производствах сложно обеспечить качественную очистку выбросов. Зато экономически он себя вполне оправдывает. Опыт Японии, Кореи и ряда других стран показал, что километр пробега на водороде выходит не дороже бензина. 4 кг водорода, закачанного в баллон, хватает примерно на 800 км пути обычного седана.
Правда, на сжатие нужна дополнительная энергия. Не меньше энергии требуется на сжижение водорода, так что один из подходящих способов его транспортировки — это перевозка в химически связанном состоянии, например в виде метана, из которого водород должен производиться там же, где будет использоваться. То есть до заправки везут метан, а уже на самой заправке устанавливается небольшое производство, например, конвертер метана в водород. Но этот способ не очень хорош для экологии, поскольку на небольших производствах сложно обеспечить качественную очистку выбросов. Зато экономически он себя вполне оправдывает. Опыт Японии, Кореи и ряда других стран показал, что километр пробега на водороде выходит не дороже бензина. 4 кг водорода, закачанного в баллон, хватает примерно на 800 км пути обычного седана.
Получать водород можно практически из любого углеводородного топлива: из бензина, дизельного топлива или пропан-бутановых смесей. В Институте катализа им. Г. К. Борескова СО РАН ведется работа по гранту РНФ по тематике получения водорода из дизельного топлива. Также разрабатываются методы получения водорода даже из органических носителей, например из бор-гидридов. Главные задачи на будущее развитие водородной энергетики — это не только получение водорода, но и его хранение. Жидкий водород можно хранить только при низких температурах, поэтому его использовали только в критически важных областях, например, как ракетное топливо.
Также разрабатываются методы получения водорода даже из органических носителей, например из бор-гидридов. Главные задачи на будущее развитие водородной энергетики — это не только получение водорода, но и его хранение. Жидкий водород можно хранить только при низких температурах, поэтому его использовали только в критически важных областях, например, как ракетное топливо.
Если отвлечься от автомобилей и обратить внимание на энергообеспечение более крупных стационарных объектов, например жилых или промышленных комплексов, то вся идеология водородной энергетики строится на ее связке с другими источниками энергии. Например, с возобновляемыми — гидро-, ветряными, солнечными электростанциями или с крупными атомными электростанциями. Производство такой энергии идет в одном режиме, а тратится потребителями она в другом, поэтому, когда есть излишки энергии, ее можно тратить на получение водорода даже из обычной воды методом электролиза.
Голубая мечта о зеленом водороде
Электролиз — это способ получения водорода из воды, который, к сожалению, требует больших энергозатрат, поэтому он оправдан только в тех случаях, когда вырабатываемую энергию необходимо запасти, пусть даже и с невысоким КПД.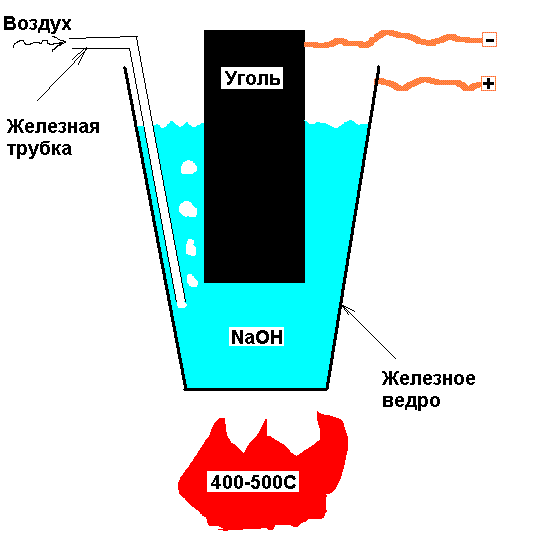
Основные организации в России, заинтересованные в получении водорода — это компании «Росатом» и «Газпром». Атомные электростанции нуждаются в сохранении избытка энергии в виде водорода и дальнейшего его использования.
Как перестать сжигать топливо
Вообще, заявления о том, что водород — это экологически чистое топливо, не совсем справедливы. Из школьного курса химии мы помним, что после сжигания водорода получается вода. Но горит-то он в воздухе, где высокое содержание азота, и в результате реакции кислорода и азота при высоких температурах мы получаем те же токсичные оксиды азота, что и при сжигании бензина, только в меньшем объеме. Собственно, водород здесь ни при чем: любое высокотемпературное горение вызывает в воздухе реакцию взаимодействия кислорода и азота с образованием оксидов.
Применение водорода в топливных элементах является самым экологичным. Разные топливные элементы используют водород при разных температурах и могут быть более или менее привередливы к его чистоте. Низкотемпературные топливные элементы работают на чистом водороде, а высокотемпературные вполне удовлетворяются синтез-газом. Топливный элемент — это электрохимическое устройство, которое преобразует химическую энергию водорода в электрическую (процесс, обратный электролизу) с достаточно высоким КПД. Институт катализа СО РАН сотрудничает с российскими производителями топливных элементов — ГК «ИнЭнерджи» и Институтом проблем химической физики РАН, где были разработаны и созданы сверхлегкие топливные элементы для беспилотных летательных аппаратов.
Сегодня в мире на топливных элементах работают тысячи небольших энергоустановок. В США, Японии и некоторых странах Европы они уже около 30 лет снабжают водородной энергией небольшие частные поселки, большие и удаленные от города супермаркеты или промышленные объекты. В отличие от дизель-генераторов это намного более бесшумные системы, так что их широко используют как запасные источники энергии в случае сбоев в работе основного источника энергообеспечения.
Сколько стоит чистый воздух
В качестве грантового финансирования на развитие индустрии водородной энергетики некоторые страны ЕС ежегодно выделяют сотни миллионов евро, США — сотни миллионов долларов. Совокупные вложения Европы и США в эту отрасль исчисляются миллиардами. Сейчас многие компании во всем мире делают попытки использовать источники энергии на топливных элементах в самых разных областях. В ближайшие десятилетия может измениться сама концепция человеческого энергопотребления.
В России развитие топливных элементов исторически связано с космическими программами в середине ХХ века. Щелочные топливные элементы использовались во многих космических проектах, где требовались автономные энергоустановки.
В 2020 году правительство России утвердило энергетическую стратегию Российской Федерации на период до 2035 года и ключевые меры развития водородной энергетики. В этом же году был создан консорциум по водородной энергетике, куда вошли ведущие научные институты: Томский политехнический университет, Институт катализа СО РАН, Институт проблем химической физики РАН, Институт нефтехимического синтеза РАН, Самарский государственный политехнический университет и Сахалинский государственный университет. В программе развития водородной энергетики РФ намечено создание водородных кластеров и пилотных проектов по производству и экспорту водорода. Планируется развитие первых коммерческих проектов производства водорода. Сегодня в РФ появляются отдельные пилотные проекты с использованием водородной энергетики, но до массового внедрения пока не дошло: скорее производители демонстрируют свою готовность к реализации подобных проектов в случае выделения финансирования со стороны, например, госкорпораций. Так, в конце 2019 года в Санкт-Петербурге был запущен трамвай на водородном топливе, а ОАО «Газпром» и ОАО «РЖД» в качестве пилотного проекта обсуждают возможность запуска поезда на Сахалине на топливных водородных элементах.
В программе развития водородной энергетики РФ намечено создание водородных кластеров и пилотных проектов по производству и экспорту водорода. Планируется развитие первых коммерческих проектов производства водорода. Сегодня в РФ появляются отдельные пилотные проекты с использованием водородной энергетики, но до массового внедрения пока не дошло: скорее производители демонстрируют свою готовность к реализации подобных проектов в случае выделения финансирования со стороны, например, госкорпораций. Так, в конце 2019 года в Санкт-Петербурге был запущен трамвай на водородном топливе, а ОАО «Газпром» и ОАО «РЖД» в качестве пилотного проекта обсуждают возможность запуска поезда на Сахалине на топливных водородных элементах.
Теги
Инженерные науки
создана новая технология получения водорода из воды
20 июля 2021 14:06 Ольга Мурая
Водородный транспорт, наравне с электрическим, постепенно входит в нашу повседневную жизнь.
Global Look Press
Внешний вид устройства.
Фото Cockrell School of Engineering/The University of Texas at Austin.
Сегодня развитие водородного транспорта ограничено дороговизной производства чистого водорода. Инженеры из Техасского университета в Остине создали дешёвый способ получения водорода, который можно легко масштабировать для массового производства.
Инженеры из Техасского университета в Остине предложили доступный способ отделения молекулы кислорода от молекулы воды с помощью солнечного света.
Эта технология приближает наступление эры водородного топлива, которая в перспективе приведёт к полному отказу от углеводородов (нефти и газа) в качестве основных источников энергии.
Начнём с того, что водород (H) – самый распространённый химический элемент во Вселенной.
При обычных температуре и давлении воздуха на Земле водород можно встретить в виде бесцветного двухатомного газа (H2). Однако большая часть водорода на Земле содержится в органических соединениях (в связке с углеродом) и воде (H2O).
В присутствии воздуха H2 становится в высшей степени взрывоопасен — при реакции водорода с кислородом высвобождается большое количество энергии.
Поэтому исследователи уже давно рассматривают водород как один из перспективных источников энергии, а создание и использование водородного топлива считается будущим энергетической промышленности.
У водородного топлива есть множество плюсов — оно позволит сократить выбросы углекислого газа в атмосферу, к тому же КПД водородного двигателя заметно выше, чем у двигателя внутреннего сгорания.
При этом минусов у водородного транспорта на сегодняшний день насчитывается тоже немало. Очевидно, что горючесть водорода представляет высокую опасность: как самовоспламенения сжатого газа внутри двигателя, так и возможной утечки газа в салон автомобиля, где малейшая искра может вызвать взрыв.
Очевидно, что горючесть водорода представляет высокую опасность: как самовоспламенения сжатого газа внутри двигателя, так и возможной утечки газа в салон автомобиля, где малейшая искра может вызвать взрыв.
Кроме этого, сегодня производство водородного топлива зависит от ископаемых углеводородов, и к тому же стоит непомерно дорого.
Поэтому инженеры всего мира стремятся разработать новые экологические чистые методы производства водородного топлива, самым популярным из которых является выделение водорода из воды с помощью солнечного света.
Эта задача сопряжена с несколькими техническими трудностями.
«Вам потребуются материалы, которые хорошо поглощают солнечный свет, но при этом не разлагаются, когда происходит реакция расщепления воды. Оказывается, материалы, которые хорошо поглощают солнечный свет, обычно нестабильны в условиях, которые требуются для реакции расщепления воды, в то время как стабильные материалы плохо поглощают свет», – объясняет соавтор работы профессор Эдвард Юй (Edward Yu) из Техасского университета в Остине.
Всё выглядит так, будто эти противоречивые требования заставляют учёных искать некий компромисс, однако разрешить этот «конфликт» можно и другим способом. Использование комбинации разных материалов – одного, который хорошо поглощает солнечный свет (к примеру, кремния), и другого, который обеспечивает стабильность разработки (такого как диоксид кремния) – поможет в создании эффективной технологии расщепления воды.
Именно этим способом и воспользовались авторы новой разработки.
Главный прорыв, который удалось совершить исследователям, заключается в создании электропроводящих путей сквозь толстый слой диоксида кремния. Для этого инженеры покрывают диоксид кремния тонким слоем алюминия и нагревают получившуюся структуру. Так получаются наноразмерные «шипы» алюминия по всей поверхности диоксида кремния. После этой процедуры их легко можно заменить никелем или другими материалами, ускоряющими расщепление воды.
Этот метод не требует больших финансовых вложений, более того, его легко можно масштабировать для больших объёмов производства. Это ли не мечта любого сторонника водородной энергетики?
Это ли не мечта любого сторонника водородной энергетики?
Освещённое солнечным светом устройство эффективно окисляет воду, образуя, с одной стороны, молекулы кислорода, а на отдельном электроде — молекулы водорода. Оно также доказало свою стабильность при длительной эксплуатации.
Внешний вид устройства.
Фото Cockrell School of Engineering/The University of Texas at Austin.
Методы, которые использовались для создания этого устройства, уже широко применяются в производстве полупроводниковой электроники. Опять же, это значит, что их легко будет внедрить в массовое производство устройств, генерирующих водород.
Команда инженеров, создавших этот прибор, уже подала заявку на патент нового устройства. Далее исследователи планируют работать над увеличением скорости реакции расщепления воды. В то же время перед ними продолжает стоять основная задача — эффективное получение водорода с помощью этого устройства.
«Сначала мы смогли обратиться к кислородной стороне этой реакции, это было самой сложной задачей.
Но чтобы полностью расщепить молекулу воды, необходимо выполнить реакции выделения как кислорода, так и водорода. Поэтому нашим очередным шагом станет применение существующих идей для создания устройств, обеспечивающих водородную часть реакции», – добавил профессор Юй.
Работа американских учёных была опубликована в июне 2021 года в издании Nature Communications.
Напомним, ранее мы писали о техническом прорыве, который поможет в создании полностью прозрачных солнечных элементов. Сообщали мы и о новом катализаторе, который сделает производство водородного топлива более доступным.
Больше новостей из мира науки вы найдёте в разделе «Наука» на медиаплатформе «Смотрим».
технологии наука энергетика водород водородное топливо альтернативная энергетика общество новости
Химики получили водород на катоде и аноде одновременно
Химия Экология и климат
Сложность 5.5
Общая схема электролиза с получением водорода на катоде и аноде
D. Xiangfeng et al. / Nature Catalysis, 2021
Ученые из США и Китая разработали систему электролиза, в которой на аноде и катоде выделялся водород. При этом протекало две реакции: окисление природного альдегида и восстановление воды. Такая система позволила получать водород при низком напряжении в цепи и небольшом потреблении энергии. Исследование опубликовано в журнале Nature Catalysis.
95 процентов всего производимого водорода получают риформингом ископаемого топлива — дешевым, но вредным для окружающей среды процессом. В качестве альтернативы ученые долгое время предлагают электролиз воды, однако из-за высокого напряжения, требуемого для протекания реакции окисления, получать водород электролизом оказывается слишком дорого.
Еще одна проблема, из-за которой электролиз воды трудно применять в промышленности, заключается в следующем: в результате реакции на аноде выделяется водород, а на катоде — кислород, которые вместе дают очень взрывоопасную смесь. Из-за этого приходится разделять анодное и катодное пространства, а также тщательно контролировать состав получаемого газа. Кроме того, образующиеся в процессе радикальные частицы могут разрушать мембраны электролизера.
Химики под руководством Дуаня Сянфэня (Duan Xiangfeng) из Калифорнийского университета решили разработать метод электролитического получения водорода из дешевого органического исходного и воды. При этом их целью было провести электролиз при низком напряжении и без выделения побочных газообразных продуктов.
Химикам было известно, что альдегиды можно электрохимически окислять до карбоновых кислот в присутствии металлических катализаторов, при этом на поверхности металла адсорбируются атомы водорода, которые затем окисляются с образованием воды. Исходя из этого, авторы статьи предположили, что можно провести процесс, при котором адсорбированные атомы водорода будут объединяться с образованием молекулярного водорода, а не окисляться.
Исходя из этого, авторы статьи предположили, что можно провести процесс, при котором адсорбированные атомы водорода будут объединяться с образованием молекулярного водорода, а не окисляться.
Значения напряжения, требуемые для электролиза воды и окисления альдегидов
D. Xiangfeng et al. / Nature Catalysis, 2021
Поделиться
Для исследования реакции окисления химики выбрали альдегид гидроксиметилфурфураль — он встречается в природе и легко получается из сахаров. А в качестве катализатора ученые решили использовать металлическую медь с большой площадью поверхности, которую они предварительно получали электрохимическим восстановлением оксида меди Cu2O. Ученым удалось установить, что при проведении реакции анодного окисления ток в цепи возникает уже при напряжении в 0,05 Вольт, а затем повышается, достигая максимума около 0,4 Вольт. Масс-спектрометрический анализ показал, что продукты реакции — газообразный водород и соответствующая карбоновая кислота.
a) Зависимость потенциала от плотности тока. Первый пик отвечает окислению альдегида, а второй — окислению медного катализатора. b) Концентрация получившейся кислоты в зависимости от напряжения в цепи (желтая линия)
D. Xiangfeng et al. / Nature Catalysis, 2021
Поделиться
Чтобы получить еще больше водорода, химики попробовали объединить процесс окисления альдегида на аноде и реакцию выделения водорода из воды на катоде. В качестве анода они использовали металлическую медь, а в качестве катода выбрали платину на угле. Реакция началась уже при напряжении менее 0,1 Вольта, а плотность тока достигла 100 миллиампер на квадратный сантиметр при напряжении 0,27 Вольта.
В результате химикам удалось разработать эффективный процесс получения водорода. Рассчитанный выход по току составил 100 процентов и для анодного, и для катодного процесса (то есть на каждый прошедший через цепь электрон выделялась одна молекула водорода). При одинаковой плотности тока новый процесс позволил получать в два раза больше водорода, чем классический электролиз воды, а потребление энергии оказалось меньше примерно в 14 раз.
При одинаковой плотности тока новый процесс позволил получать в два раза больше водорода, чем классический электролиз воды, а потребление энергии оказалось меньше примерно в 14 раз.
Сравнение эффективности разных органических субстратов в реакции получения водорода. По вертикальной оси отложено требуемое значение напряжения
D. Xiangfeng et al. / Nature Catalysis, 2021
Поделиться
Чтобы реакция выделения водорода из воды протекала быстрее, химики используют дорогие платиновые катализаторы. Но недавно им удалось применить для этой цели более дешевые золото-родиевые наночастицы. О необычной роли золота в этом процессе мы рассказывали несколько месяцев назад.
Михаил Бойм
Решения для производства водорода | Возобновляемые источники энергии
Экологически чистая генерация водорода
Одной из самых важных задач настоящего времени является декарбонизация мировой экономики. Ключом к решению этой задачи является последовательное увеличение доли источников возобновляемой энергии и их интеграция в развитые инфраструктуры промышленности, энергетики и электрических сетей. Мы вырабатываем «зеленый» водород, используя возобновляемую энергию с помощью электролиза через мембраны PEM, внося тем самым важный вклад в глобальную трансформацию энергетической отрасли. Линейка продукции SILYZER помогает интегрировать в ваш процесс такие нестабильные источники энергии, как солнце и ветер. Мы устанавливаем стандарты в вопросах устойчивой генерации водорода для будущего. Начиная с планирования и ввода в эксплуатацию и заканчивая эксплуатацией, мы осуществляем поддержку клиентов в качестве надежного партнера, предоставляющего проверенную концепцию обслуживания, которая отвечает их требованиям.
Ключом к решению этой задачи является последовательное увеличение доли источников возобновляемой энергии и их интеграция в развитые инфраструктуры промышленности, энергетики и электрических сетей. Мы вырабатываем «зеленый» водород, используя возобновляемую энергию с помощью электролиза через мембраны PEM, внося тем самым важный вклад в глобальную трансформацию энергетической отрасли. Линейка продукции SILYZER помогает интегрировать в ваш процесс такие нестабильные источники энергии, как солнце и ветер. Мы устанавливаем стандарты в вопросах устойчивой генерации водорода для будущего. Начиная с планирования и ввода в эксплуатацию и заканчивая эксплуатацией, мы осуществляем поддержку клиентов в качестве надежного партнера, предоставляющего проверенную концепцию обслуживания, которая отвечает их требованиям.
Водород
Использование водорода для декарбонизации
Роль возобновляемых источников энергии становится все более важной во всем мире. Они являются основой создания устойчивой энергетической отрасли, свободной от выбросов CO2, и, следовательно, ключевой технологией достижения декарбонизации к 2100 году. Их доля в выработке энергии в мировом масштабе постоянно растет. Но каким образом такие нестабильные источники энергии, как солнце и ветер, могут быть интегрированы в существующие сети, производственные процессы и гибкую индивидуализированную систему передачи энергии?
Они являются основой создания устойчивой энергетической отрасли, свободной от выбросов CO2, и, следовательно, ключевой технологией достижения декарбонизации к 2100 году. Их доля в выработке энергии в мировом масштабе постоянно растет. Но каким образом такие нестабильные источники энергии, как солнце и ветер, могут быть интегрированы в существующие сети, производственные процессы и гибкую индивидуализированную систему передачи энергии?
Водород является не только топливом будущего, но и настоящего!
Водород – самый распространенный химический элемент во вселенной. Почти все виды химического топлива имеют в своем составе водород, хоть он и представлен в связанной форме в виде углеводородов или других водородных соединений. Для того, чтобы ограничить изменения климата, вызванные глобальным увеличением выбросов CO2, необходимо найти решения для получения безуглеродного и, следовательно, устойчивого топлива. Помимо прочего, для этого требуется, чтобы водород вырабатывался с использованием возобновляемых источников энергии.
Варианты использования
Около 90% от более чем 600 миллиардов кубических метров водорода, вырабатываемого ежегодно во всем мире, потребляется промышленностью. Водород является важнейшим химическим веществом в промышленности и используется в качестве топлива, добавки или восстановителя. Водород в основном используется в качестве основного химического вещества при синтезе аммиачных и других удобрений, таких как мочевина, а также для синтеза метанола, различных полимеров и смол. Другими важными потребителями продукции современной водородной промышленности являются нефтеперерабатывающие заводы и металлообрабатывающая промышленность, а также полупроводниковая, стекольная и пищевая промышленность.
Только небольшое количество водорода используется в энергетической отрасли в настоящее время, хотя применение водорода считается одной из наиболее перспективных технологий в крупномасштабной интеграции источников возобновляемой энергии.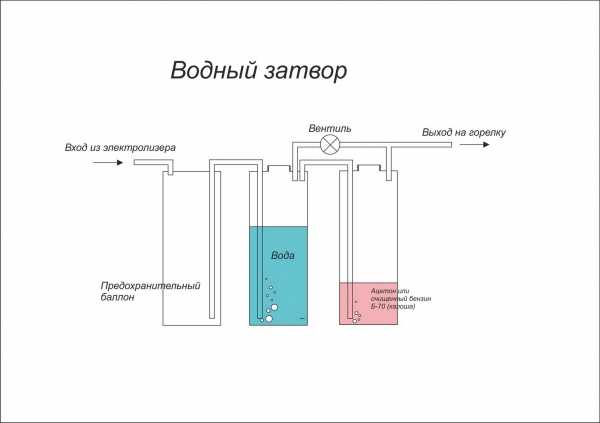 Чем больше электроэнергии вырабатывается из нестабильных возобновляемых источников, таких как солнце и ветер, и чем сильнее снижается зависимость от традиционных энергосистем, тем важнее становится модернизация энергосистем. Кроме того, возобновляемая энергия также должна быть доступна в тех случаях, когда энергии солнца и ветра недостаточно. Это требует накопления энергии, в том числе в течение длительных периодов времени. Водород имеет важнейшее значение в качестве источника и среды хранения энергии. Одним из примеров подходящей инфраструктуры могут быть газовые сети с огромным потенциалом хранения.
Чем больше электроэнергии вырабатывается из нестабильных возобновляемых источников, таких как солнце и ветер, и чем сильнее снижается зависимость от традиционных энергосистем, тем важнее становится модернизация энергосистем. Кроме того, возобновляемая энергия также должна быть доступна в тех случаях, когда энергии солнца и ветра недостаточно. Это требует накопления энергии, в том числе в течение длительных периодов времени. Водород имеет важнейшее значение в качестве источника и среды хранения энергии. Одним из примеров подходящей инфраструктуры могут быть газовые сети с огромным потенциалом хранения.
Готовые решения «Комплексного энергоблока» также могут быть реализованы с использованием водородной инфраструктуры. Высокая оперативность работы электролизной системы PEM идеально подходит для прямого подключения к возобновляемым источникам энергии. Таким образом, пики нагрузки могут быть ограничены в обособленной сети, а энергия может быть возвращена в газовые турбины или топливные элементы по мере необходимости.
Электрификация транспортных средств является одной из самых серьезных проблем декарбонизации в мировом масштабе. Водород может способствовать декарбонизации двумя способами. Транспортные средства на топливных элементах могут напрямую использовать водород. Вместо CO2 и NOx они производят лишь воду. Вместе с аккумуляторными батареями они не только позволяют сократить выбросы городского транспорта, но также легкового и грузового локального и междугородного транспорта, поскольку эти транспортные средства имеют значительно большую дальность, чем автомобили с исключительно батарейным питанием. Кроме того, для их заправки требуется всего три минуты.
Второй способ использования водорода заключается в синтезе углеводородов из устойчивого водорода и углерода, получаемого из отходов сельского и лесного хозяйства. Таким образом, даже отрасли с высокими требованиями к топливу, такие как авиация и морские перевозки, могут быть декарбонизированы.
Электролиз для устойчивой генерации водорода
В 1800 году два англичанина, Уильям Николсон и Энтони Карлайл, открыли процесс электролиза, заключающийся в разложении воды на водород и кислород. Для этого использовался постоянный ток. Таким образом, эти два исследователя основали новую область химии – электрохимию.
Для этого использовался постоянный ток. Таким образом, эти два исследователя основали новую область химии – электрохимию.
В течение многих десятилетий электролиз воды был стандартным методом получения водорода и вдохновившись им французский писатель Жюль Верн в своем романе 1874 года «Таинственный остров» написал следующее: «Вода станет углем будущего». На протяжении многих лет благодаря развитию инфраструктуры использования природного газа в качестве основного источника водорода преобладали риформинг газа и газификация угля.
Электролиз с использованием протонно-обменных мембран (PEM) – быстрый, эффективный, экологичный
Дж. Х. Рассел и его коллеги впервые осознали огромный потенциал электролиза с использованием технологии PEM для энергетической промышленности в 1973 году.
Аббревиатура «PEM» обозначает протонно-обменную мембрану (proton exchange membrane). Особенностью мембраны PEM является то, что она проницаема для протонов, но не для газов, таких как водород или кислород. Благодаря этому в электролитическом процессе мембрана выполняет, помимо прочего, функцию разделителя, который предотвращает смешивание газообразных продуктов.
Благодаря этому в электролитическом процессе мембрана выполняет, помимо прочего, функцию разделителя, который предотвращает смешивание газообразных продуктов.
На передней и задней сторонах мембраны расположены электроды, которые подключены к положительному и отрицательному полюсам источника питания. Именно здесь расщепляются молекулы воды. В отличие от традиционного щелочного электролиза, технология PEM идеально подходит для сбора энергии ветра и солнца, которая вырабатывается нерегулярно, за счет того, что ее можно быстро включать и выключать без необходимости предварительного нагрева. Электролиз PEM также имеет следующие особенности:
- Высокая эффективность при высокой удельной мощности
- Высокое качество получаемого газа даже при частичной нагрузке
- Низкие расходы на обслуживание и надежная работа
- Отсутствие выделения вредных химических веществ
Портфель продукции
Выработка достаточных количеств водорода требует инновационных решений, таких как семейство продуктов SILYZER компании «Сименс», представляющее инновационную систему PEM-электролиза, которая использует энергию ветра и солнца для выработки водорода, исключая выбросы CO2.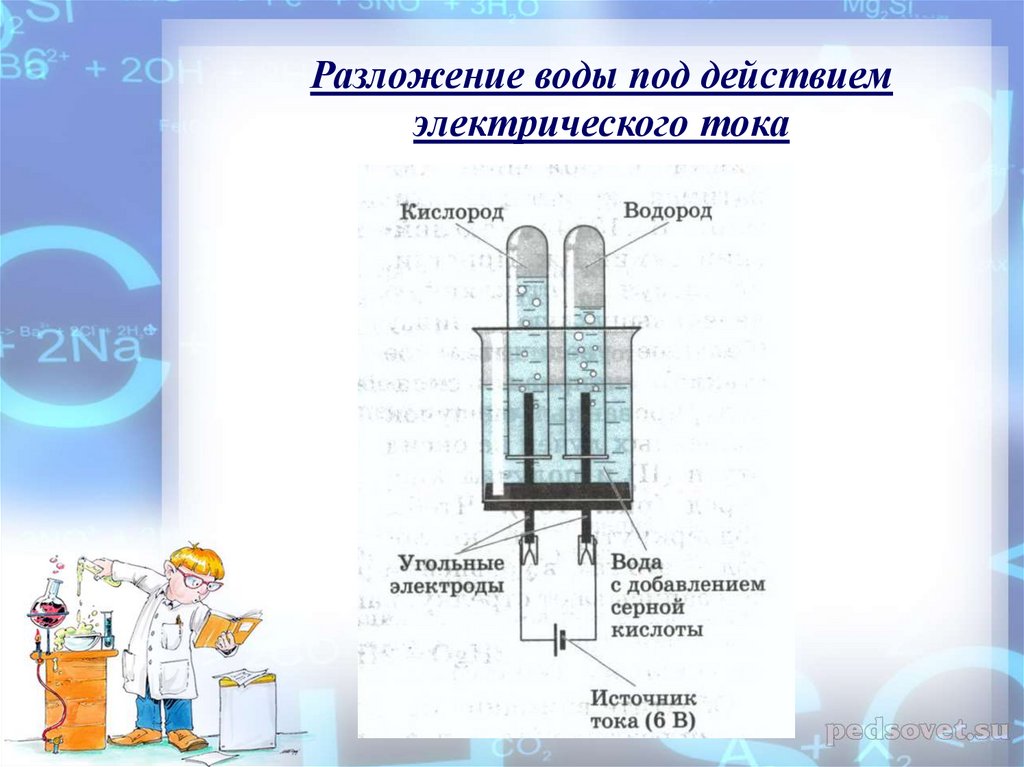 Это делает SILYZER вдвойне полезным и вдвойне чистым решением.
Это делает SILYZER вдвойне полезным и вдвойне чистым решением.
SILYZER 300 является новейшей и самой мощной линейкой продуктов в диапазоне десятков мегаватт в линейке продукции для PEM-электролиза компании «Сименс». Модульная конструкция SILYZER 300 позволяет использовать уникальные свойства масштабирования для минимизации инвестиционных затрат для крупных промышленных электролизных установок. Оптимизированное решение обеспечивает очень низкие затраты на выработку водорода благодаря высокого КПД и эксплуатационной готовности установки.
Осуществляйте декарбонизацию своей отрасли с использованием системы, которая:
- Предлагает максимальный КПД и превосходную оперативность по конкурентоспособной цене и при низких расходах на обслуживание
- Работает без выделения вредных веществ
- Обеспечивает только чистый водород наивысшего качества
- Спецификация (англ. язык)
Решение SILYZER 200 может быть адаптировано для выполнения ваших конкретных задач. Благодаря своей конструкции и практическим возможностям расширения оно обеспечивает максимальную гибкость. Базовая система состоит минимум из одного блока на 1,25 МВт. Несколько базовых систем могут быть объединены в сеть PEM-электролиза более высокого класса производительности. В зависимости от ваших потребностей, в пакет входит целый ряд технических опций, включая систему обратного охлаждения, систему очистки воды, подключение к электросети и многое другое. И, разумеется, все компоненты идеально совместимы. Решение также обеспечивает производство водорода при работе под высоким давлением до 35 бар.
Благодаря своей конструкции и практическим возможностям расширения оно обеспечивает максимальную гибкость. Базовая система состоит минимум из одного блока на 1,25 МВт. Несколько базовых систем могут быть объединены в сеть PEM-электролиза более высокого класса производительности. В зависимости от ваших потребностей, в пакет входит целый ряд технических опций, включая систему обратного охлаждения, систему очистки воды, подключение к электросети и многое другое. И, разумеется, все компоненты идеально совместимы. Решение также обеспечивает производство водорода при работе под высоким давлением до 35 бар.
- Спецификация (англ. язык)
Мы подбираем идеальный пакет услуг для ваших индивидуальных потребностей. Наши сервисные предложения варьируются от базовых работ по техническому обслуживанию до комплексного обслуживания с использованием самых современных систем анализа данных. Таким образом мы обеспечиваем бесперебойную работу.
Наши сервисные предложения разрабатываются с учетом индивидуальных требований клиентов:
- Базовые: поддержка и устранение неполадок по запросу
- Расширенные: профилактическое обслуживание, дистанционное обслуживание, контроль состояния, круглосуточная горячая линия и многое другое
- Интегрированные: заключение договоров о техническом обслуживании на основе производительности
Компания «Сименс» в качестве партнера Ваш компетентный, надежный и опытный партнер.
На протяжении более 170 лет мы и наша продукция соответствуем самым высоким стандартам качества. Благодаря обширным знаниям в области промышленности, транспортных средств и энергетики, мы можем разрабатывать межотраслевые решения, предназначенные для повышения эффективности работы наших клиентов. Начиная с подключения к сети и заканчивая инновационными технологиями управления, вы получаете возможность использовать многолетний опыт и инновационный потенциал «Сименс». У нас также есть доступ к обширной сети специальных партнеров, которые оптимально дополняют наши предложения. Эти знания и опыт позволяют нам создавать индивидуальные решения, основанные на специальных требованиях клиентов и раскрывающие весь ваш потенциал.
У нас также есть доступ к обширной сети специальных партнеров, которые оптимально дополняют наши предложения. Эти знания и опыт позволяют нам создавать индивидуальные решения, основанные на специальных требованиях клиентов и раскрывающие весь ваш потенциал.
Решение SILYZER основано на характерных для «Сименс» высоких технологиях и опыте, включая нашу систему управления SIMATIC PCS 7 и преобразователи серии SINAMICS DCM. Мы гарантируем надежную и оптимальную совместную работу компонентов, обеспечивая максимальную эксплуатационную готовность, надежность и безопасность. Вы можете быть уверены в том, что мы используем весь наш опыт и знания для создания высококачественной системы и обеспечим вам круглосуточную поддержку.
Дополнительная информация
Вопросы и ответы
Водород (химический символ Н) является газом. В качестве свободных молекул (h3) данный элемент встречается в природе только в небольших количествах, а в основном он химически связан, например в виде h3O.
Водород – самый распространенный химический элемент во вселенной. 90% всех атомов являются атомами водорода. Они составляют до трех четвертей общей массы вселенной.
Водород превращается в жидкость при температуре минус 253 ºC.
Водород имеет самую высокую удельную энергоемкость по массе среди всех традиционных видов топлива: она почти в три раза выше, чем у бензина или дизельного топлива. Это одна из причин, по которой водород используется в качестве топлива для космических аппаратов.
Высшая теплотворная способность h3: 39,4 кВт ч/кг, низшая теплотворная способность h3: 33,3 кВт ч/кг
При сжигании водорода выделяется тепло. Используемый в топливных элементах водород электрохимически преобразуется в электрическую энергию.
Водород производится и используется уже более 200 лет. Опыт показывает, что водород можно безопасно хранить, транспортировать и преобразовывать. Еще в 1808 году водород впервые был широко использован для системы уличного освещения Лондона.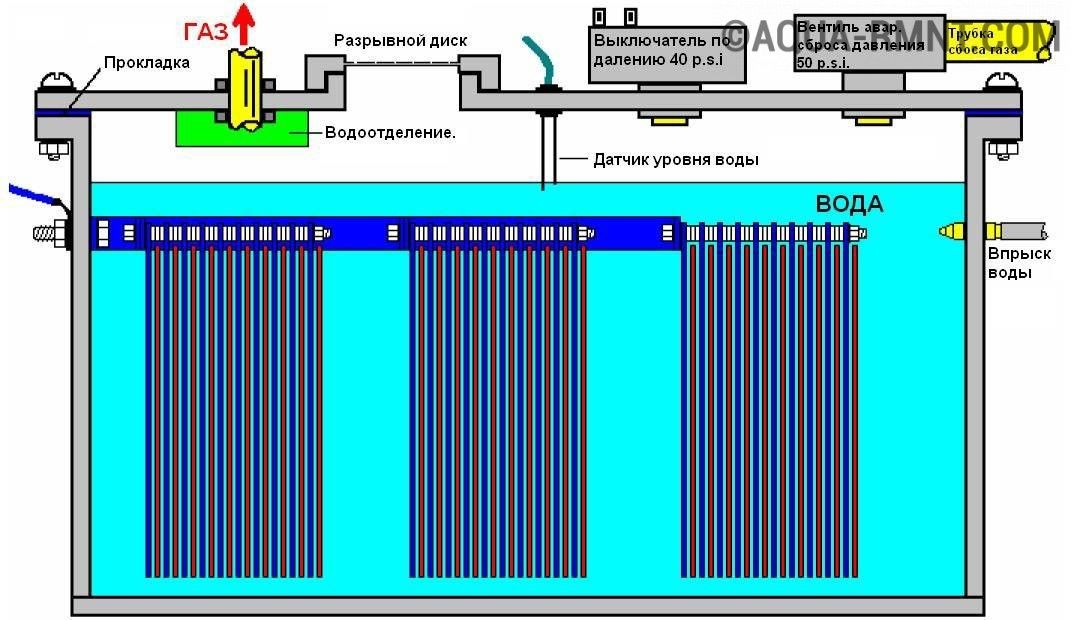
Водород (h3) можно получать различными способами. На данный момент более 95% водорода во всем мире производится из углеводородов, при этом побочным продуктом является вредный CO2. Электролиз воды предлагает более современную и экологичную технологию получения водорода, без выбросов CO2.
Водород может получаться из углеводородов путем парового риформинга природного газа, зачастую называемого паровым риформингом метана (SMR), газификации угля, а также электролиза воды (h3O).
Водород можно хранить в резервуарах в виде сжатого газа или в виде жидкости. Водород также может храниться в подземных природных резервуарах или в сети природного газа для различных применений при условии, что такая сеть удовлетворяет всем технологическим требованиям.
Объемная удельная энергоемкость водорода при атмосферном давлении составляет примерно одну треть от энергоемкости традиционных видов топлива. Объемная удельная энергоемкость может быть увеличена путем сжатия или сжижения газообразного водорода для хранения и транспортировки большего его количества.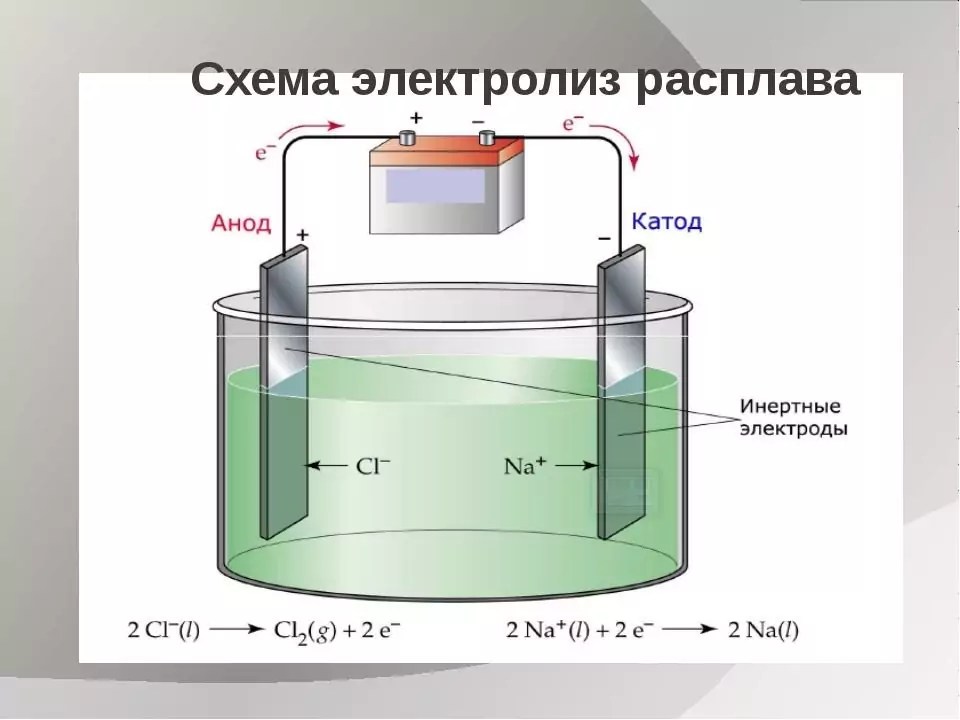
Для автомобилей на водородном топливе установлен промышленный стандарт от 300 до 700 бар. Транспортные средства для перевозки сжатого водорода (автоцистерны) как правило работают с максимальным давлением 200 бар.
Водород можно перевозить в виде сжатого газа или в виде низкотемпературной жидкости. В настоящее время два основных способа транспортировки водорода (главным образом в газообразном состоянии) подразумевают использование автоцистерн, например, трейлеров для перевозки баллонов, а также газопроводов (на малые расстояния).
Водород является нетоксичным чистым газом. Он не ядовит, не имеет вкуса и запаха. При его использовании в топливных элементах водород не создает паров, не загрязняет атмосферу углекислым газом и не выделяет оксидов азота.
По своей природе он не более опасен, чем другие виды топлива. Водород легковоспламеняем, поэтому с ним следует обращаться с осторожностью, как и с другими легковоспламеняющимися видами топлива. Для воспламенения водорода должны присутствовать дополнительный окислитель (воздух, чистый кислород, хлор и т. д.) определенной концентрации и источник возгорания (искра). В худшем случае, если водород воспламеняется, то он сгорает очень быстро. Он не создает опасного теплового излучения над местом происшествия, в отличие от бензина или керосина.
д.) определенной концентрации и источник возгорания (искра). В худшем случае, если водород воспламеняется, то он сгорает очень быстро. Он не создает опасного теплового излучения над местом происшествия, в отличие от бензина или керосина.
Оборудование проектируется так, чтобы обеспечивать постоянную герметичность. Фланцевые соединения проектируются специально для водорода, а количество разъемных соединений сводится к минимуму. Кроме того, в зданиях обеспечивается стабильный воздухообмен, а объекты оборудуются предохранительными клапанами и клапанами сброса давления. Также определяются зоны взрывобезопасности. В этих зонах электрическое и прочее оборудование должно соответствовать требованиям 2014/34/EU (директива ATEX).
Нет. Водород можно безопасно хранить и обрабатывать, а также транспортировать. В промышленности это осуществляется уже более ста лет.
В отличие от бензина и природного газа, газообразный водород обладает значительной подъемной силой в атмосфере вследствие своей низкой плотности. Любой неконтролируемо поступающий газообразный водород немедленно поднимается вверх и рассеивается, что снижает риск возгорания на открытом воздухе.
Любой неконтролируемо поступающий газообразный водород немедленно поднимается вверх и рассеивается, что снижает риск возгорания на открытом воздухе.
Вода разделяется на составляющие: водород и кислород с помощью электрического тока.
Процессы электролиза можно разделить на следующие категории: щелочной электролиз с использованием жидких щелочных электролитов, кислотный электролиз с использованием твердых полимерных электролитов (например PEM) и высокотемпературный электролиз с использованием твердых оксидов в качестве электролита.
В промышленном масштабе доступны системы PEM-электролиза и щелочного электролиза. Технология электролиза с использованием твердых оксидов находится на ранней стадии разработки.
PEM обозначает протонно-обменную мембрану (proton exchange membrane). Эта мембрана является важной частью электролитической ячейки в PEM-электролизере. Эта мембрана разделяет анод, где собирается кислород, и катод, где генерируется газообразный водород.
Они различаются типом ионов, которые замыкают электрическую цепь
- PEM-электролиз: H+
- Щелочной электролиз: OH—
- Электролиз с использованием твердых оксидов: O2—
- Высокая чистота газа >99,999%
- Высокая оперативность
- Высокий КПД (>70%)
- Высокая удельная мощность
- Продолжительный срок службы
- Экологичность (отсутствие химических веществ, только вода и электричество)
Для генерации 1 кг водорода требуется 10 литров деминерализованной воды.
В среднем для производства 1 кг водорода требуется 50 кВт ч энергии, в зависимости от эффективности электролизера и режима его работы.
Рынок водорода имеет три основных сегмента. Транспортные средства, энергетика и промышленность, причем промышленность в настоящее время является крупнейшим потребителем (~90%). В будущем ожидается смещение этого баланса в сторону транспортных средств и энергетики.
В настоящее время водород является важным промышленным газом, используемым, например, для очистки топлива, производства удобрений и метанола, гидрогенизации жиров, производства стали, обработки металлов, а также для производства листового стекла.
На 100 км пробега требуется менее 1 кг водорода.
Заправка легкового автомобиля или малотоннажного грузовика занимает от 3 до 5 минут.
Водород обеспечивает длительное хранение большого количества излишней возобновляемой энергии. Это позволяет по-новому использовать такую электроэнергию, например, использовать водород в качестве заменителя природного газа, подавая его в существующие трубопроводы, в качестве топлива для транспортных средств на топливных элементах или электростанций, или в качестве сырья для переработки водорода. При этом возникает возможность связать производство энергии с промышленностью и транспортной отраслью, создав так называемое «слияние отраслей».
При этом возникает возможность связать производство энергии с промышленностью и транспортной отраслью, создав так называемое «слияние отраслей».
Нет. Водород станет важным и постоянным элементом устойчивой энергетики.
В будущем водород будет в большей степени производиться с использованием электроэнергии из возобновляемых источников. Кроме того, биогаз и различные виды топлива, такие как твердая биомасса, помогут производить «зеленый» водород в будущем.
«Зеленый» водород на 100% получается из возобновляемых источников энергии. Это означает, что энергия, необходимая для производства водорода путем электролиза, связана с нулевыми выбросами. Водород, получаемый из ископаемого топлива с такими выбросами, как CO2, может называться «серым» или «коричневым» водородом. Если выбрасываемый углекислый газ улавливается, сохраняется (в хранилище улавливания углекислого газа) и используется повторно, то водород часто называют «синим».
Референтные проекты
Получение водорода из морской воды с помощью солнечных панелей
Эффективное и экономически выгодное получение водорода и кислорода из морской воды с помощью электролиза было целью ученых на протяжении нескольких десятилетий, сообщает Newsweek.
Количество энергии, которое запасено в 1 кг одном килограмме водорода почти в 2.5 раза больше чем в природном газе, но что еще немаловажно, единственным продуктом сгорания водорода является вода. В недалёком будущем, с помощью водорода можно будет обеспечить энергией практически всё: от автомобилей до зданий и строений. Однако, получение водорода в таком глобальном масштабе может создать нагрузку на пресные источники воды, которые нужны как для питься, так и для использования в многочисленных промышленных процессах.
Команде ученых-химиков из Стэнфордского университета удалось разработать способ получения водорода из морской воды, которая, кстати, занимает 97% от запасов всей воды на Земле. Результаты своей работы опубликовали в Известиях Национальной академии наук США (PNAS).
Типичный электролизёр состоит из двух электродов – катода и анода, погружённых в электролит и разделённых мембраной. При пропускании электрического на этих электродах выделяются пузырьки газа, на аноде – кислород, на катоде – водород. Для снижения количества электричества, требуемого для разделения молекул вода на водород и кислород, электроды обычно покрывают специальным катализатором.
Для снижения количества электричества, требуемого для разделения молекул вода на водород и кислород, электроды обычно покрывают специальным катализатором.
Электролизёр, разработанный командой из Стэнфорда во многом похож на коммерческие аналоги, только за одним исключением – их устройство может работать с солёной морской водой вместо пресно.
Если немного помните школьный курс химии, то знаете что соль NaCl состоит положительно заряженного атома натрия Na+ и отрицательно заряженного атома хлора Cl-.
Больше всего проблем ученым составлял Cl-, поскольку приводит к быстрой коррозии металлического анода. Соль можно удалить из морской воды с помощью опреснения, но это дорогой и затратный с энергетической точки зрения процесс. Чтобы избежать этапа опреснения, команда учёных разработала специальные электроды, который могут противостоять агрессивном условиях в процессе электролиза морской воды.
Анод, а именно токоприёмник они сделали из пористого никеля, который покрыли дешёвым, но высокоактивным катализатором на основе никеля и железа. Сам катализатор устойчив к коррозии, но нижележащий металлический проводит более активен и быстрее корродирует при контакте с раствором хлорида.
Сам катализатор устойчив к коррозии, но нижележащий металлический проводит более активен и быстрее корродирует при контакте с раствором хлорида.
Чтобы решить проблему коррозии учёные нашли способ предотвратить миграцию хлорид-ионов через слой катализатора, тем самым предотвращая их попадание на металл. Хитрость заключалось в добавлении в границу раздела фаза катализатор-металл отрицательно заряженных молекул сульфита и карбоната. Поскольку одинаково заряженные частицы отталкиваются между собой, то эти молекулы сульфита и карбоната будут отталкивать хлор-ионы, тем самым не пропуская их к металлу.
Такой модифицированный анод способен отработать в течение 1000 часов в ходе электролиза морской воды при той же плотности тока, что применяется в коммерческих аппаратах. Ученые попробовали сделать еще более насыщенный растворов соли, где её концентрация была в три разы выше чем в морской воде, в таких условиях анод также отработал 1000 часов.
Чтобы электролиз воды был экологически чистым, энергия для него должна использоваться из возобновляемых источников. Поэтому ученые подключили к электролизёру коммерческую солнечную панель.
Поэтому ученые подключили к электролизёру коммерческую солнечную панель.
Испытания провели прямо на территории кампус Стэнфордского университета под естественным солнечных освещением. Плотность тока, протекающая через электролизёр составила прибл. 1А/см².
Как потом использовать этот самый водород и кислород? – можете
вы спросить. Можно подумать, что сжигать также как и природный газ – но нет. Это не эффективно. Водорода и кислород обратно в электричество преобразуется с помощью водородных топливных элементов (англ., Fuel Cell). КПД таких элементов составляет 50-60%, что почти в 2 разе больше чем КПД двигателя внутреннего сгорания. Водород в них играет роль топлива, а кислород – окислителя. Активное использование водородных топливных элементов позволит стать на шаг ближе внедрению полноценной водородной энергетики.
Вообще, основная концепция водородной энергетики – это использование водорода в качестве аккумулятора энергии. Владельцы солнечных электростанций (даже маломощных) знают, что пик выработки электроэнергии приходится на дневное время, однако пик потребления электроэнергии приходится на вечернее время. Казалось бы есть выход, можно накапливать энергию в аккумуляторных батареях. Да, этот вариант подходит для частных домовладений, но не приемлем, когда речь идет о мега- и гигаваттных солнечных электростанция, поскольку в использовании аккумуляторов есть два главных недоставка. Первое, дороговизна, так
Казалось бы есть выход, можно накапливать энергию в аккумуляторных батареях. Да, этот вариант подходит для частных домовладений, но не приемлем, когда речь идет о мега- и гигаваттных солнечных электростанция, поскольку в использовании аккумуляторов есть два главных недоставка. Первое, дороговизна, так
аккумуляторные батареи могут составлять почти 50% стоимости солнечной электростанции. Второе, короткой срок службы, который составляет не более 10 лет.
Поэтому хранение энергии в виде водорода – это весьма перспективная альтернатива аккумуляторам. Избыточную энергию, которые вырабатывают солнечные панели в дневное время можно направить на получение водорода. В вечернее время, водород обратно преобразуется в электричество с помощью топливных элементов. Сказанное хорошо иллюстрирует картинка выше. Получается такой “альтернативный” цикл накопления и преобразования энергии.
Новый пористый материал помогает получить возобновляемую энергию из воды
2128
Добавить в закладки
Одним из перспективных источников возобновляемой энергии является газообразный водород, получаемый из воды с помощью солнечного света. Исследователи из Университета Линчёпинга (Швеция) разработали материал – нанопористый кубический карбид кремния, – который может впитывать солнечную энергию и расщеплять молекулы воды для получения газообразного водорода, передает пресс-служба вуза. Статья с результатами исследования опубликована в журнале ACS Nano.
Плотность энергии водорода в три раза выше, чем у бензина. Его
можно использовать для выработки электроэнергии с помощью
топливных элементов. К тому же, на рынке уже есть автомобили,
работающие на водороде. Тем не
менее, производство водорода – процесс не очень
экологичный: в результате образуется диоксид углерода,
поскольку технология для его получения, которую используют
сегодня, зависит от ископаемого топлива.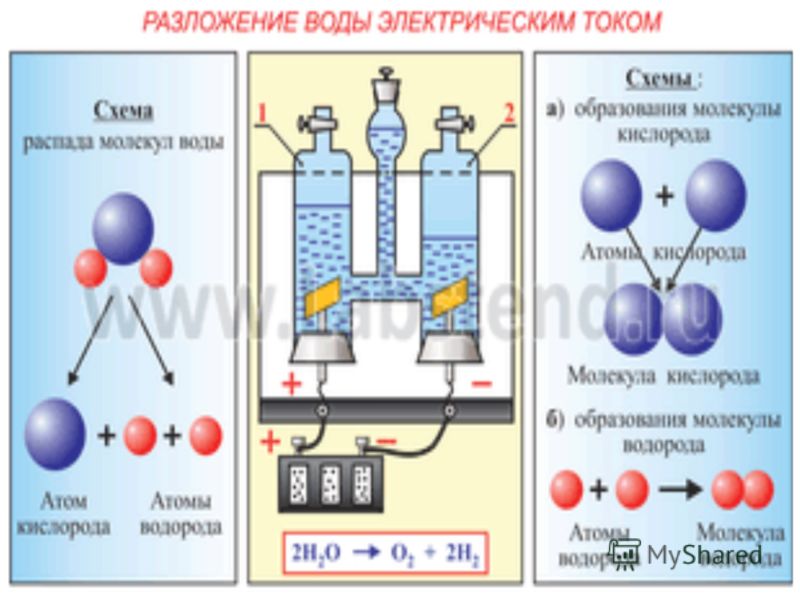 Так, при производстве
одной тонны газообразного водорода выделяется 9-12 тонн
углекислого газа.
Так, при производстве
одной тонны газообразного водорода выделяется 9-12 тонн
углекислого газа.
Производство газообразного водорода путем расщепления молекул воды с помощью солнечной энергии – экологически более безопасный подход: в данном случае не выделяется углекислый газ. При этом, полученные топливо можно хранить.
«Обычные солнечные элементы производят энергию в дневное время, и эту энергию необходимо либо использовать немедленно, либо накапливать, например, в батареях. Водород является многообещающим источником энергии, который можно хранить и транспортировать так же, как традиционные виды топлива, такие как бензин и дизельное топливо», – отмечают авторы работы.
Однако разделить воду, используя энергию солнечного света, для
получения газообразного водорода – непростая задача. Чтобы
добиться успеха, необходимо найти экономичные материалы, которые
обладают правильными свойствами для реакции, в которой вода (h3O)
расщепляется на водород (h3) и кислород (O2) посредством
фотоэлектролиза. Энергия солнечного света, которую можно
использовать для расщепления воды, поступает в основном в виде
ультрафиолетового излучения и видимого света. Следовательно,
требуется материал, который может эффективно поглощать такое
излучение для создания зарядов, которые могут быть разделены и
иметь достаточно энергии для разделения молекул воды на водород и
кислород. Большинство материалов, которые были исследованы до сих
пор, либо неэффективны в том, как они используют энергию видимого
солнечного света (например, диоксид титана поглощает только
ультрафиолетовый солнечный свет), либо не обладают свойствами,
необходимыми для разделения воды на газообразный водород
(например, кремний).
Энергия солнечного света, которую можно
использовать для расщепления воды, поступает в основном в виде
ультрафиолетового излучения и видимого света. Следовательно,
требуется материал, который может эффективно поглощать такое
излучение для создания зарядов, которые могут быть разделены и
иметь достаточно энергии для разделения молекул воды на водород и
кислород. Большинство материалов, которые были исследованы до сих
пор, либо неэффективны в том, как они используют энергию видимого
солнечного света (например, диоксид титана поглощает только
ультрафиолетовый солнечный свет), либо не обладают свойствами,
необходимыми для разделения воды на газообразный водород
(например, кремний).
Как альтернативу, ученые использовали карбид кремния (3C-SiC).
Группа создала кубический карбид кремния с очень маленькими
порами. Материал обладает многообещающими свойствами,
которые позволяют предположить, что его можно использовать для
производства газообразного водорода из воды с помощью солнечного
света. Этот новый пористый материал может эффективно собирать
ультрафиолет и большую часть видимого солнечного света. Кроме
того, пористая структура помогает разделять заряды, обладающие
необходимой энергией, в то время как небольшие поры обеспечивают
большую активную площадь поверхности. Это улучшает перенос заряда
и увеличивает количество реакции, поэтому молекулы воды
разделяются на водород и кислород быстрее.
Этот новый пористый материал может эффективно собирать
ультрафиолет и большую часть видимого солнечного света. Кроме
того, пористая структура помогает разделять заряды, обладающие
необходимой энергией, в то время как небольшие поры обеспечивают
большую активную площадь поверхности. Это улучшает перенос заряда
и увеличивает количество реакции, поэтому молекулы воды
разделяются на водород и кислород быстрее.
[Фото: THOR BALKHED/LIU]
Автор Материал Оформила Татьяна Матвеева
альтернативное топливо альтернативные источники энергии вода водород возобновляемая энергетика карбид кремния нанопористый кубический карбид кремния солнечная энергия
Источник: liu.se
Информация предоставлена Информационным агентством «Научная Россия». Свидетельство о регистрации СМИ: ИА № ФС77-62580, выдано
Федеральной службой по надзору в сфере связи, информационных технологий и массовых коммуникаций 31 июля 2015 года.
НАУКА ДЕТЯМ
Россия 1, «Вести недели» с Эрнестом Мацкявичюсом. Академик РАН Анатолий Деревянко об открытии Нобелевского лауреата Сванте Паабо
21:39 / Археология, История, Палеонтология
Ихтиозаврам из юрского периода не приходилось конкурировать из-за пищи
20:00 / Палеонтология
Пермские ученые нашли способ предотвратить дефекты металлических деталей
16:24 / Инженерия, Математика, Новые технологии
РАН представит лекторий на Фестивале НАУКА 0+
15:30 / Наука и общество
Академик Анатолий Деревянко объяснил, за что присудили Нобелевскую премию по медицине 2022
15:01 / Биология, История, Медицина
«Материя» в РХТУ на Фестивале НАУКА 0+
14:30 / Наука и общество, Химия
Нобелевскую премию по медицине 2022 присудили за изучение вымерших человекообразных обезьян и эволюции человека
14:15 / Биология, История, Медицина
Физики повысили эффективность адресной доставки лекарств с помощью мягких наногелей
13:30 / Медицина, Физика
Определен ген, отвечающий за формирование «скелета» клетки
13:15 / Биология
Научные бои психологов на Фестивале НАУКА 0+
12:30 / Наука и общество, Психология
Памяти великого ученого.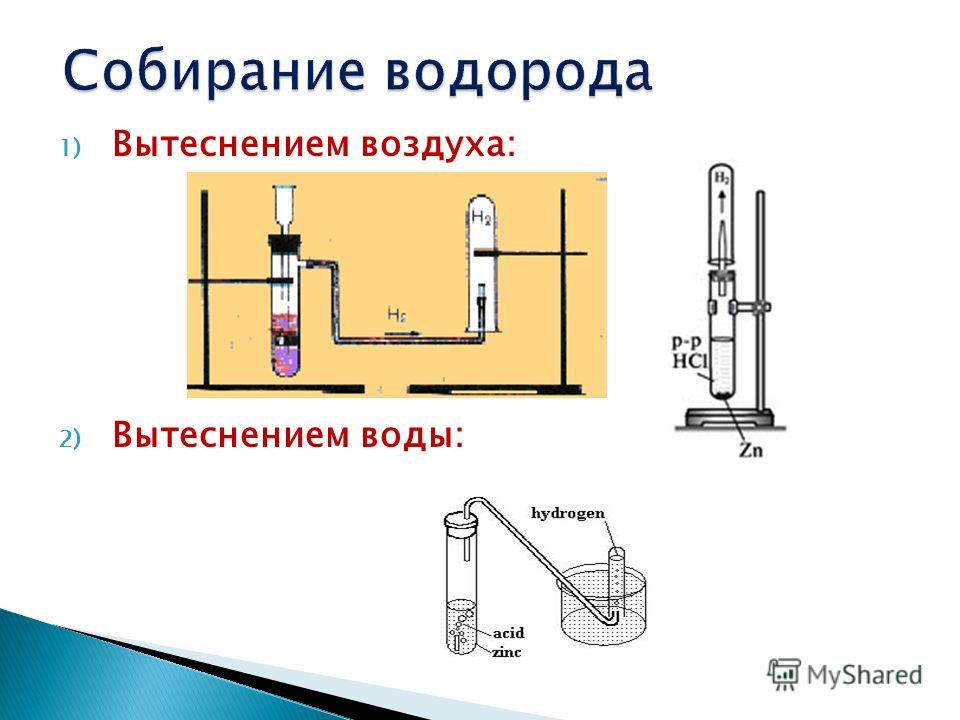 Наука в глобальном мире. «Очевиднное — невероятное» эфир 10.05.2008
Наука в глобальном мире. «Очевиднное — невероятное» эфир 10.05.2008
04.03.2019
Памяти великого ученого. Нанотехнологии. «Очевидное — невероятное» эфир 3.08.2002
04.03.2019
Вспоминая Сергея Петровича Капицу
14.02.2017
Смотреть все
Новый материал выделяет водород из воды с почти идеальной эффективностью
Увеличить
НАСА/Димитри Герондидакис
В солнечной энергетике в настоящее время доминируют фотогальванические устройства, которые перешли от огромной экономии за счет масштаба к доминированию в цене. Но эти устройства не обязательно являются лучшим выбором во всех обстоятельствах. Если технология аккумуляторов не улучшится, добавление значительной емкости для производства солнечной энергии обходится довольно дорого. И есть виды транспорта — междугородний железнодорожный, воздушный — где аккумуляторы не являются отличным решением. Эти ограничения заставили исследователей поддерживать интерес к альтернативным способам использования солнечной энергии.
Одним из альтернативных вариантов является использование энергии для производства портативного топлива, такого как углеводород или водород. Это можно сделать с электронами, производимыми фотогальваническими системами, но дополнительные шаги могут снизить эффективность. Однако системы, которые более непосредственно преобразуют солнечный свет в топливо, имеют еще более низкую эффективность.
Но японская группа решила решить эту проблему эффективности. Команда начала с материала, который не очень хорош — он поглощает только УФ-излучение — но хорошо изучен. И исследователи выяснили, как оптимизировать его, чтобы его эффективность при расщеплении воды с выделением водорода достигала теоретического максимума. Хотя сам по себе он бесполезен, он может указать путь к разработке более качественных материалов.
Много недостатков
Почему материалы плохо используют энергию солнечного света для расщепления воды? Подумайте обо всем, что они должны сделать. Для начала они должны быть приличными фотогальваническими материалами, эффективно преобразовывающими фотоны в свободные электроны и соответствующие дырки с положительным зарядом. Материалы должны каким-то образом удерживать эти два заряда от рекомбинации, когда они пробиваются к поверхности, где они могут взаимодействовать с водой. Как только заряды оказываются на поверхности, материал также должен действовать как катализатор, разбивая открытую воду и выделяя водород и кислород. Эта последняя часть непроста, так как образование кислорода происходит за счет дырок, а для производства водорода требуются электроны, а это означает, что эти два процесса должны быть физически разделены.
Материалы должны каким-то образом удерживать эти два заряда от рекомбинации, когда они пробиваются к поверхности, где они могут взаимодействовать с водой. Как только заряды оказываются на поверхности, материал также должен действовать как катализатор, разбивая открытую воду и выделяя водород и кислород. Эта последняя часть непроста, так как образование кислорода происходит за счет дырок, а для производства водорода требуются электроны, а это означает, что эти два процесса должны быть физически разделены.
Найти один материал, отвечающий всем этим требованиям, — непростая задача. Основной материал, который здесь используется, оксид стронция-титана, использовался для этого процесса в течение десятилетий и никогда не достигал более 60 процентов своего теоретического максимума.
Подход японской команды состоял в том, чтобы устранить каждую из этих неэффективностей, хотя из документа не совсем ясно, было ли каждое из их решений полностью преднамеренным.
Начнем с того, что выбор материала — SrTiO 3 — определяет эффективность преобразования фотонов в электроны и дырки. Он очень хорош в этом, казалось бы, способен делать это почти с максимальной эффективностью, предсказанной теоретическими расчетами.
И благодаря его истории люди определили способы улучшения переноса зарядов внутри материала. Для этой работы исследователи легировали материал алюминием. Атомы алюминия имеют тенденцию оседать в дефектах, которые замедляют перенос зарядов, позволяя электронам и дыркам рекомбинировать. Когда атомы алюминия присутствуют, они как бы покрывают эти дефекты бумагой, позволяя зарядам свободно перемещаться по материалу.
На поверхности
Где SrTiO 3 имеет тенденцию отставать, так это в катализе. Важно отметить, что в статье показано, как авторам удалось добиться значительных улучшений. Ряд разработанных катализаторов хорошо справляется с расщеплением воды. Но исследователям по-прежнему приходилось разделять электроны и дырки на пути к катализаторам.
Получается, что материал сделал работу за исследователей. В ходе своей работы исследователи обнаружили, что электроны и дырки появляются на разных участках поверхности SrTiO 9.0021 3 . В то время как поверхность материала выглядит ровной и гладкой на первый взгляд, разные области обнажают разные грани лежащей в основе кристаллической структуры на атомарном уровне. И как оказалось, из-за этих различий электроны и дырки уходят на разные поверхности.
Удивительно, но исследователи поняли это, нанеся дополнительный катализатор поверх SrTiO 3 . Они использовали процесс, называемый фотоосаждением, в котором фотоны высокой энергии используются для химической связи вещества с подстилающей поверхностью. В этом случае подстилающей поверхностью является SrTiO 3 , а длины волн использовались те же, что и для образования электронов и дырок. В результате соответствующие катализаторы оказались связаны с теми же областями, куда были доставлены необходимые им заряды.
Для части реакции, производящей водород, исследователи использовали катализатор на основе родия, который будет работать как для производства кислорода, так и для производства водорода. Но он был объединен с оксидом хрома, который физически блокировал взаимодействие кислорода с катализатором. Это гарантировало, что электроны окажутся там, где прореагировал катализатор водорода. Эти химические вещества были отложены в результате реакции восстановления, гарантируя, что они окажутся там, где есть запас электронов.
Тем временем кобальт-кислородный катализатор был нанесен посредством реакции окисления, что обеспечило его соединение с областями, снабженными отверстиями. В результате этот катализатор для производства кислорода в конечном итоге отложился только там, где были предусмотрены необходимые ему отверстия.
Подводя итог, можно сказать, что структура нижележащих материалов доставляет электроны и дырки в различные области материала SrTiO 3 . Исследователи выяснили, как использовать этот факт, чтобы связать соответствующие катализаторы именно с этими сайтами.
Исследователи выяснили, как использовать этот факт, чтобы связать соответствующие катализаторы именно с этими сайтами.
На грани теории
Невозможно сказать, насколько эффективен каждый отдельный шаг с точки зрения преобразования поступающих фотонов в конечные продукты, водород и кислород. Систему можно рассматривать только в целом, и с этой точки зрения она чрезвычайно впечатляет: общий КПД составляет 96 процентов от максимально возможного КПД, полученного из теоретических расчетов. Таким образом, каждая отдельная стадия процесса, вероятно, будет работать почти с теоретической эффективностью.
Эта новость просто фантастическая, если не считать той части, где для работы процесса требуются ультрафиолетовые фотоны. Солнце производит большую часть своей энергии в не-УФ-длинах волн, и большая часть УФ-излучения отфильтровывается нашей атмосферой. Так что этот конкретный материал не станет двигателем водородной революции.
Ключевым моментом этого исследования является то, что он определил принцип, с помощью которого мы могли бы создать катализатор, который мог бы привести к такой революции. Существует широкий спектр материалов, которые могут использовать свет, в том числе в видимой области спектра, для плохого катализа производства водорода. Существует гораздо большая коллекция фотогальванических материалов, которые могли бы сделать то же самое в сочетании с правильными катализаторами. Описанная здесь работа дает рецепт, который может превратить некоторые из них в полезные материалы.
Существует широкий спектр материалов, которые могут использовать свет, в том числе в видимой области спектра, для плохого катализа производства водорода. Существует гораздо большая коллекция фотогальванических материалов, которые могли бы сделать то же самое в сочетании с правильными катализаторами. Описанная здесь работа дает рецепт, который может превратить некоторые из них в полезные материалы.
Избавьтесь от дефектов. Найдите материал, в котором электроны и дырки проходят через материал разными путями. Используйте присутствие электронов и дырок, чтобы связать нужные катализаторы с источниками заряда. Если это сработает с лучшим исходным материалом, мы сможем производить водород с помощью чрезвычайно простой системы.
Nature , 2020. DOI: 10.1038/s41586-020-2278-9 (О DOI).
Новый устойчивый способ производства водорода для топливных элементов и удобрений
15 февраля 2022 г. Пресс-релиз Химия Инжиниринг
- Японская страница
Новый устойчивый и практичный метод производства водорода из воды был открыт группой исследователей из Центра исследования устойчивых ресурсов RIKEN (CSRS) в Японии под руководством Рюхея Накамуры. В отличие от существующих методов, новый метод не требует редких металлов, которые дороги или дефицитны. Вместо этого водород для топливных элементов и сельскохозяйственных удобрений теперь можно производить с использованием кобальта и марганца, двух довольно распространенных металлов. Исследование было опубликовано в журнале Nature Catalysis.
В отличие от существующих методов, новый метод не требует редких металлов, которые дороги или дефицитны. Вместо этого водород для топливных элементов и сельскохозяйственных удобрений теперь можно производить с использованием кобальта и марганца, двух довольно распространенных металлов. Исследование было опубликовано в журнале Nature Catalysis.
В отличие от обычного ископаемого топлива, при сгорании которого выделяется углекислый газ, водород является чистым топливом, при котором в качестве побочного продукта образуется только вода. Если водород можно извлекать из воды с использованием возобновляемой электроэнергии, энергосистему можно сделать чистой, возобновляемой и устойчивой. Кроме того, водород является ключевым ингредиентом, необходимым для производства аммиака, который используется практически во всех синтетических удобрениях. Но вместо чистого извлечения водорода из воды в настоящее время заводы по производству аммиака используют ископаемое топливо для производства необходимого им водорода.
Так почему же мы до сих пор используем ископаемое топливо? Одна из причин заключается в том, что сам процесс извлечения водорода — электролиз — дорог и еще не устойчив.
«В первую очередь это связано с отсутствием хороших катализаторов», — говорит Накамура. «Помимо того, что катализатор может выдерживать суровую кислую среду, он должен быть очень активным. Если нет, то количество электроэнергии, необходимой для реакции, чтобы произвести заданное количество водорода, резко возрастает, а вместе с ней и стоимость».
В настоящее время наиболее активными катализаторами для электролиза воды являются редкие металлы, такие как платина и иридий, что создает дилемму, поскольку они дороги и считаются «исчезающими видами» среди металлов. Чтобы перевести всю планету на водородное топливо прямо сейчас, потребуется около 800 лет производства иридия, а такого количества может даже не существовать. С другой стороны, распространенные металлы, такие как железо и никель, недостаточно активны и имеют тенденцию немедленно растворяться в жесткой кислой среде электролиза.
В поисках лучшего катализатора исследователи изучили смешанные оксиды кобальта и марганца. Оксиды кобальта могут быть активны для необходимой реакции, но очень быстро подвергаются коррозии в кислой среде. Оксиды марганца более стабильны, но недостаточно активны. Объединив их, исследователи надеялись извлечь выгоду из их взаимодополняющих свойств. Они также должны были учитывать высокую плотность тока, необходимую для практического применения вне лаборатории. «Для производства водорода в промышленных масштабах нам нужно было установить целевую плотность тока нашего исследования примерно в 10–100 раз выше, чем то, что использовалось в прошлых экспериментах», — говорит соавтор Шуанг Конг. «Высокие токи привели к ряду проблем, таких как физическое разложение катализатора».
В конце концов, команда проб и ошибок преодолела эти проблемы и обнаружила активный и стабильный катализатор, вставив марганец в решетку шпинели Co 3 O 4 , в результате чего был получен смешанный оксид кобальта и марганца Co 2 MnO . 4 .
4 .
Тестирование показало, что Co 2 MnO 4 работает очень хорошо. Уровни активации были близки к уровням для современных оксидов иридия. Кроме того, новый катализатор проработал более двух месяцев при плотности тока 200 миллиампер на квадратный сантиметр, что может сделать его эффективным для практического использования. По сравнению с другими катализаторами, не содержащими редких металлов, которые обычно работают всего несколько дней или недель при гораздо более низких плотностях тока, новый электрокатализатор может изменить правила игры.
«Мы достигли того, что десятилетиями ускользало от внимания ученых», — говорит соавтор Айлонг Ли. «Производство водорода с использованием высокоактивного и стабильного катализатора, изготовленного из распространенных металлов. В долгосрочной перспективе мы считаем, что это огромный шаг к созданию устойчивой водородной экономики. Как и другие возобновляемые технологии, такие как солнечные батареи и энергия ветра, мы ожидаем, что стоимость технологии «зеленого» водорода в ближайшем будущем резко упадет по мере дальнейшего развития».
Следующим шагом в лаборатории будет поиск способов продлить срок службы нового катализатора и еще больше повысить уровень его активности. «Всегда есть возможности для улучшения, — говорит Накамура, — и мы продолжаем стремиться к катализатору, не содержащему редкого металла, который соответствует характеристикам существующих иридиевых и платиновых катализаторов».
Ссылка
Ли и др. (2022). Повышение устойчивости оксида кобальтовой шпинели к устойчивому выделению кислорода в кислоте. Nat Catal doi: 10.1038/s41929-021-00732-9
Contact Ryuhei Nakamura, Team Leader
Biofunctional Catalyst Research Team
RIKEN Center for Sustainable Resource Science
Adam Phillips
RIKEN International Affairs Division
Tel : +81-(0)48-462-1225
Электронная почта: adam.phillips [at] riken.jp
Устойчивое производство водорода. На этой схеме показана концепция устойчивого производства водорода.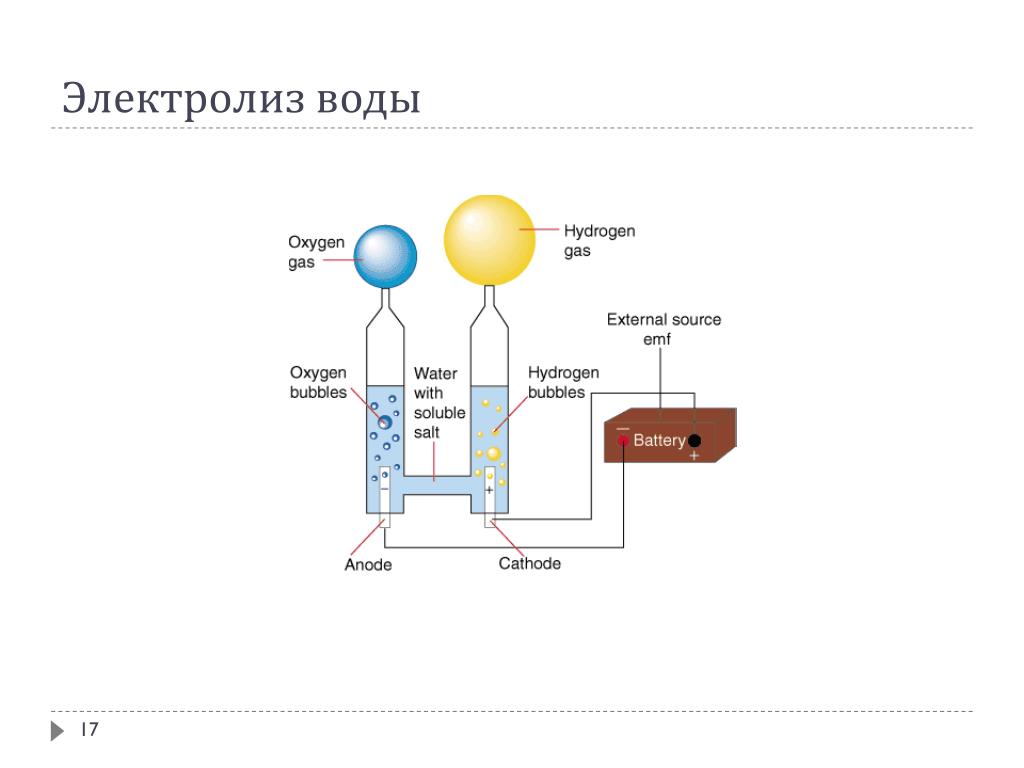 Электричество из возобновляемых источников (солнце, ветер) используется для расщепления воды на кислород и водород (электролиз). Затем водород можно использовать в качестве топлива, для производства удобрений из аммиака и в других отраслях промышленности.
Электричество из возобновляемых источников (солнце, ветер) используется для расщепления воды на кислород и водород (электролиз). Затем водород можно использовать в качестве топлива, для производства удобрений из аммиака и в других отраслях промышленности.
(слева) Структура смешанного оксида кобальта-марганца, Co 2 MnO 4 . (Справа) кадр из видеоролика, показывающий получение водорода путем электролиза при плотности тока 1000 миллиампер на квадратный сантиметр.
Новый метод разделения воды эффективно производит водородное топливо — ScienceDaily
Команда Университета Колорадо в Боулдере разработала радикально новый метод, использующий силу солнечного света для эффективного разделения воды на компоненты водорода и кислорода, прокладывая путь для широкого использования водорода в качестве экологически чистого топлива.
Команда CU-Boulder разработала солнечно-тепловую систему, в которой солнечный свет может концентрироваться с помощью множества зеркал в одной точке на вершине центральной башни высотой до нескольких сотен футов. По словам профессора Калифорнийского университета в Боулдере Алана Веймера, руководителя исследовательской группы, башня будет собирать тепло, выделяемое системой зеркал, примерно до 2500 градусов по Фаренгейту (1350 по Цельсию), а затем доставлять его в реактор, содержащий химические соединения, известные как оксиды металлов.
Когда соединение оксида металла нагревается, оно высвобождает атомы кислорода, изменяя свой материальный состав и заставляя новообразованное соединение искать новые атомы кислорода, сказал Веймер. Команда показала, что добавление пара в систему, которое может быть получено путем кипячения воды в реакторе с направленным на башню концентрированным солнечным светом, приведет к тому, что кислород из молекул воды прилипнет к поверхности оксида металла. освобождение молекул водорода для сбора в виде газообразного водорода.
освобождение молекул водорода для сбора в виде газообразного водорода.
«Мы разработали здесь что-то, что очень отличается от других методов и, откровенно говоря, что-то такое, о чем раньше никто не думал», — сказал Веймер из отдела химической и биологической инженерии. «Расщепление воды солнечным светом — это Святой Грааль устойчивой водородной экономики».
Статья на эту тему была опубликована в выпуске журнала Science от 2 августа. В состав команды входили соведущие авторы Веймер и доцент Чарльз Масгрейв, первый автор и докторант Кристофер Мюхич, научный сотрудник Жанна Мартинек, студентка Кайла Уэстон, бывший аспирант CU Пол Лихти, бывший исследователь с докторской степенью CU Синьхуа Лян и бывший исследователь CU Брайан Эванко. .
Одним из ключевых отличий метода CU от других методов, разработанных для разделения воды, является возможность проведения двух химических реакций при одной и той же температуре, сказал Масгрейв, также из отдела химической и биологической инженерии. Хотя рабочих моделей не существует, традиционная теория утверждает, что производство водорода с помощью процесса оксида металла требует нагревания реактора до высокой температуры для удаления кислорода, затем охлаждения его до низкой температуры перед введением пара для повторного окисления соединения для высвобождения. газообразный водород для сбора.
Хотя рабочих моделей не существует, традиционная теория утверждает, что производство водорода с помощью процесса оксида металла требует нагревания реактора до высокой температуры для удаления кислорода, затем охлаждения его до низкой температуры перед введением пара для повторного окисления соединения для высвобождения. газообразный водород для сбора.
Advertising
«Более традиционные подходы требуют управления как переключением температуры в реакторе с горячего состояния на холодное, так и введением пара в систему», — сказал Масгрейв. «Одним из больших нововведений в нашей системе является отсутствие колебаний температуры. Весь процесс управляется либо включением, либо выключением парового клапана».
«Точно так же, как вы использовали бы увеличительное стекло, чтобы разжечь огонь, мы можем концентрировать солнечный свет, пока он не станет действительно горячим, и использовать его для запуска химических реакций», — сказал Мухич. «Хотя мы можем легко нагреть его до более чем 1350 градусов по Цельсию, мы хотим нагреть его до минимально возможной температуры, чтобы эти химические реакции все еще происходили. материалы и сами реакторы».
материалы и сами реакторы».
Кроме того, традиционная двухэтапная идея разделения воды также приводит к потере времени и тепла, говорит Веймер, также являющийся преподавателем Института BioFrontiers при Калифорнийском университете в Боулдере. «Солнечных часов в день не так много», — сказал он.
Исследование проводилось при поддержке Национального научного фонда и Министерства энергетики США.
Благодаря новому методу CU-Boulder количество водорода, производимого для топливных элементов или для хранения, полностью зависит от количества оксида металла, который состоит из комбинации железа, кобальта, алюминия и кислорода, и сколько пара вводится в систему. Один из проектов, предложенных командой, состоит в том, чтобы построить трубы реактора диаметром около фута и длиной в несколько футов, заполнить их материалом из оксида металла и сложить друг на друга. Работающая система для производства значительного количества газообразного водорода потребует нескольких высоких башен для сбора концентрированного солнечного света с нескольких акров зеркал, окружающих каждую башню.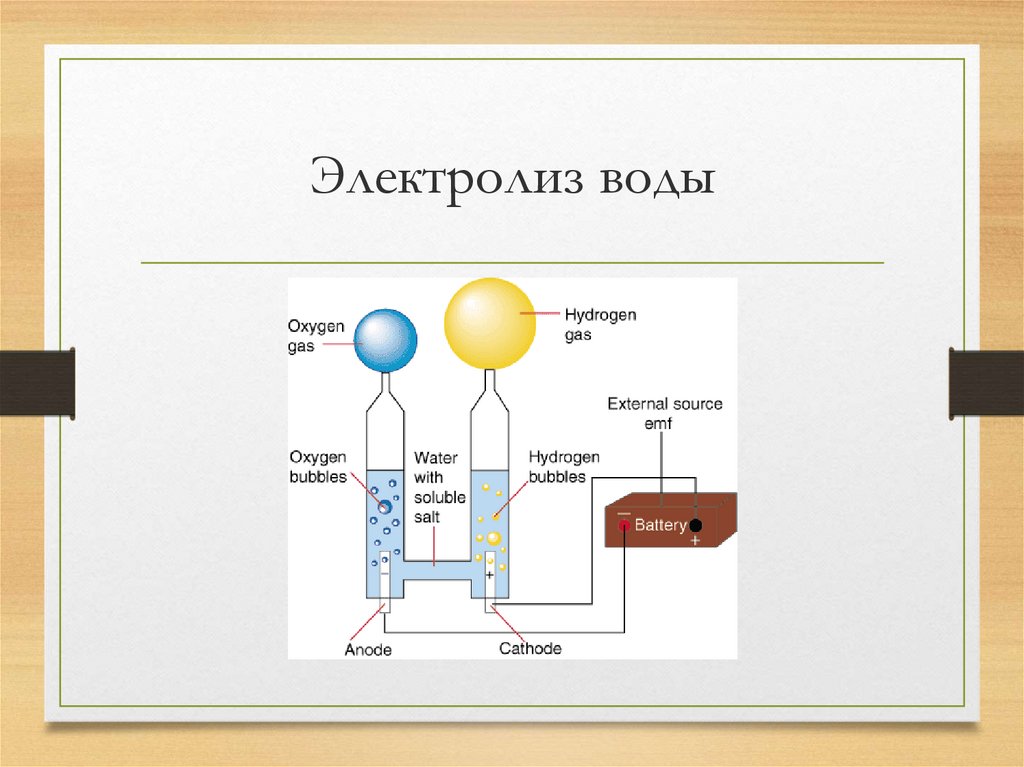
Веймер сказал, что новый дизайн начал проникать в команду около двух лет назад. «Когда мы увидели, что можем использовать этот более простой и эффективный метод, потребовалось изменить наше мышление», — сказал Веймер. «Нам пришлось разработать теорию, чтобы объяснить это и сделать ее правдоподобной и понятной для других ученых и инженеров».
Несмотря на открытие, до коммерциализации такого солнечно-теплового реактора, вероятно, еще далеко. «При такой низкой цене на природный газ нет стимула для сжигания экологически чистой энергии», — сказал Веймер, также исполнительный директор Колорадского центра биопереработки и биотоплива, или C2B2. «Должен быть существенный денежный штраф за выброс углерода в атмосферу, иначе цены на ископаемое топливо должны были бы сильно вырасти».
C2B2 является подразделением Коллаборатории энергетических исследований Колорадо, в которую входят CU-Boulder, Колорадская горная школа, Университет штата Колорадо и Национальная лаборатория возобновляемых источников энергии в Голдене. Сотрудничество работает с отраслевыми партнерами, государственными учреждениями и другими учреждениями для коммерциализации технологий возобновляемых источников энергии, поддержки экономического роста в штате и стране и обучения будущей рабочей силы.
Сотрудничество работает с отраслевыми партнерами, государственными учреждениями и другими учреждениями для коммерциализации технологий возобновляемых источников энергии, поддержки экономического роста в штате и стране и обучения будущей рабочей силы.
Производство водорода путем электролиза — бюллетень h3
Почти 95% водорода производится углеводородным путем из-за его более низких производственных затрат. Этот процесс называется термохимическим, в котором используются тепло и химические реакции для высвобождения водорода из органических материалов, таких как ископаемое топливо и биомасса. Одним из недостатков этого процесса является выброс углерода, особенно при отсутствии улавливания углерода.
Одной из экологически безопасных альтернатив производства водорода является использование воды в качестве исходного сырья. В настоящее время наиболее развитая коммерчески доступная технология получения водорода из воды называется электролизом. Электролиз воды – это разложение воды (H 2 O) на его основные компоненты, водород (H 2 ) и кислород (O2), при пропускании электрического тока. Благодаря этому процессу электрическая энергия может быть сохранена в виде химической энергии образующегося водорода. Вода является идеальным источником для производства водорода, потому что она выделяет кислород только как побочный продукт во время обработки. Водород, полученный в результате разложения воды при использовании возобновляемого источника энергии, называется зеленым водородом.
Благодаря этому процессу электрическая энергия может быть сохранена в виде химической энергии образующегося водорода. Вода является идеальным источником для производства водорода, потому что она выделяет кислород только как побочный продукт во время обработки. Водород, полученный в результате разложения воды при использовании возобновляемого источника энергии, называется зеленым водородом.
Электролиз преобразует электрическую энергию в химическую путем накопления электронов в виде стабильных химических связей. Новообразованная химическая энергия может быть использована в качестве топлива или преобразована обратно в электричество, когда это необходимо.
Электролизер (электролизная ячейка) состоит из двух электродов, называемых катодом и анодом. Катод представляет собой отрицательно заряженный электрод, а анод заряжен положительно. Оба катода разделены мембраной, называемой электролитом, и окружены водой. Существуют разные типы электролизеров, и они функционируют немного по-разному из-за использования электролита другого типа.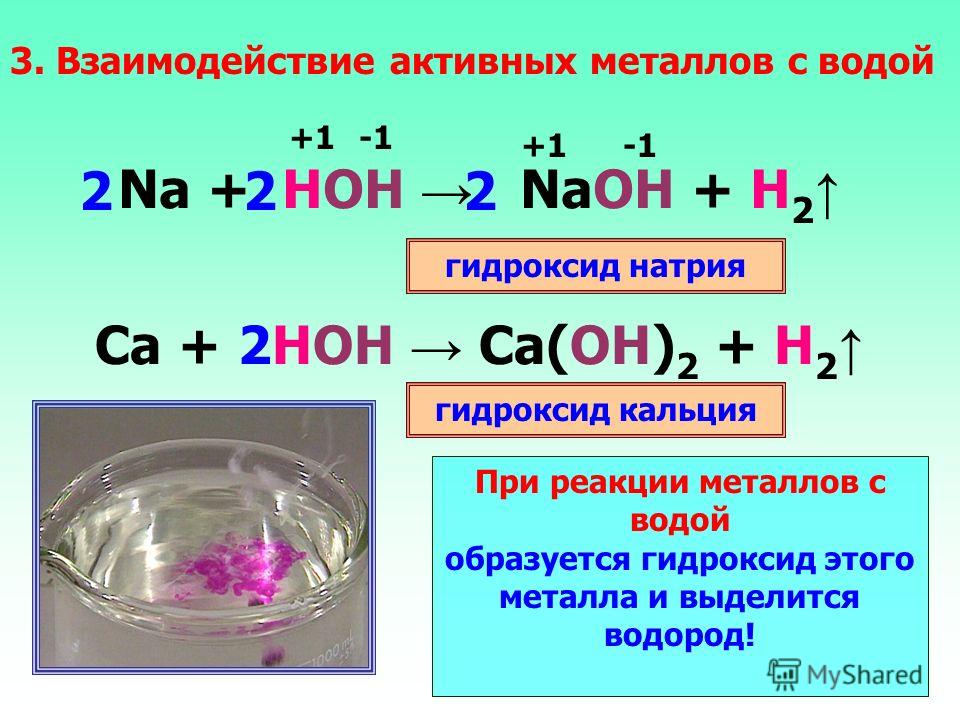
Есть два типа сепараторов, один используется в электролизере, а другой для топливного элемента. Сепаратор электролиза воды необходим при производстве водорода, который должен выдерживать высокие температуры и влажность. Сепаратор топливных элементов используется в топливных элементах и необходим для утилизации водорода.
Электролит является обязательной частью, так как чистая вода не может нести достаточный заряд из-за отсутствия ионов. На аноде вода окисляется до газообразного кислорода и ионов водорода. На катоде вода восстанавливается до газообразного водорода и ионов гидроксида.
В настоящее время существует три ведущих технологии электролиза.
Щелочной электролиз (AEL) Щелочной электролиз (AEL) является признанной технологией и используется в промышленных масштабах более 100 лет. Даже первая крупная установка щелочного электролиза была построена в Норвегии в 1927. Гидроксид калия (КОН) обычно используется в качестве электролита, сильного основания и щелочи. Электролит проводит электричество для электролиза.
Электролит проводит электричество для электролиза.
Анод и катод разделены диафрагмой, разделяющей газообразные водород и кислород и предотвращающей их повторное смешивание. На катоде вода расщепляется с образованием h3 и высвобождает анионы гидроксида, которые проходят через диафрагму и рекомбинируют на аноде с образованием O2. Коммерческие щелочные электролизеры работают при 100–150°C
Электролиз с протонообменной мембраной (PEM) Электролиз с протонообменной мембраной (PEM) является относительно новейшей технологией и используется в коммерческих целях уже несколько лет. Он имеет несколько преимуществ по сравнению с AEL, таких как чистота продуктового газа при частичной нагрузке. В электролизере PEM электролит используется в виде твердого специального пластика. На стороне анода вода разлагается с образованием кислорода и положительно заряженных ионов водорода (протонов). Кроме того, электроны проходят через внешнюю цепь, а ионы водорода проходят через ФЭУ к катоду. На катоде ионы водорода связываются с электронами, вытекающими из внешней цепи, и вместе они образуют газообразный водород. Технология протонного обмена устраняет необходимость в прочных и щелочных основаниях, необходимых для запуска процесса электролиза. Электролизеры PEM работают при 70°–90°С.
На катоде ионы водорода связываются с электронами, вытекающими из внешней цепи, и вместе они образуют газообразный водород. Технология протонного обмена устраняет необходимость в прочных и щелочных основаниях, необходимых для запуска процесса электролиза. Электролизеры PEM работают при 70°–90°С.
Щелочные электролизеры и электролизеры PEM известны как низкотемпературные электролизеры (LTE). Однако, с другой стороны, твердооксидный электролизер (SOE) известен как высокотемпературный электролизер (HTE) и использует твердый керамический материал в качестве электролита. Он объединяет воду на катоде с электронами из внешней цепи для получения водорода и отрицательно заряженных ионов кислорода. Затем он переносит ионы кислорода через твердую керамическую мембрану для реакции на аноде с образованием газообразного кислорода и генерацией электронов для внешней цепи.
Эта технология в настоящее время находится в стадии разработки и была использована на нескольких экспериментальных установках. HTC осуществляет электролиз водяного пара при высоких температурах, что приводит к более высокому КПД (80-90%) по сравнению с предыдущими вариантами. Кроме того, он также может использовать отработанное тепло и компенсировать необходимое электричество. По мере повышения температуры часть энергии, необходимой для расщепления воды, передается в виде тепла, в то время как потребность в электроэнергии или необходимое напряжение снижаются. Электролит представляет собой твердый ионопроводящий материал типа оксида иттрия, стабилизированного всасыванием, из диоксида циркония (YSZ). Поскольку ионная проводимость начинается только при температуре выше 700 °C, для этого типа электролиза рекомендуемая температура для правильной работы составляет от 700 до 800 °C.
HTC осуществляет электролиз водяного пара при высоких температурах, что приводит к более высокому КПД (80-90%) по сравнению с предыдущими вариантами. Кроме того, он также может использовать отработанное тепло и компенсировать необходимое электричество. По мере повышения температуры часть энергии, необходимой для расщепления воды, передается в виде тепла, в то время как потребность в электроэнергии или необходимое напряжение снижаются. Электролит представляет собой твердый ионопроводящий материал типа оксида иттрия, стабилизированного всасыванием, из диоксида циркония (YSZ). Поскольку ионная проводимость начинается только при температуре выше 700 °C, для этого типа электролиза рекомендуемая температура для правильной работы составляет от 700 до 800 °C.
Анионообменная мембрана (AEM) имеет структуру, аналогичную ячейке PEM, с основным отличием в том, что мембрана переносит анионы (OH–) вместо протонов (H+) . Таким образом, технология AEM использует в электродах тот же процесс, что и в традиционных щелочных элементах. Одним из ключевых преимуществ является то, что мембрана дешевле по сравнению с электролизером PEM. В электролизёрах также не используются катализаторы на основе металлов платиновой группы (PGM), такие как элементы PEM. По сравнению с традиционными щелочными электролизерами, AEM также обеспечивает получение водорода высокой чистоты при высоком давлении.
Таким образом, технология AEM использует в электродах тот же процесс, что и в традиционных щелочных элементах. Одним из ключевых преимуществ является то, что мембрана дешевле по сравнению с электролизером PEM. В электролизёрах также не используются катализаторы на основе металлов платиновой группы (PGM), такие как элементы PEM. По сравнению с традиционными щелочными электролизерами, AEM также обеспечивает получение водорода высокой чистоты при высоком давлении.
Вы ищете информацию о водороде? Бюллетень h3 может помочь в ваших исследованиях водорода. Пожалуйста, не стесняйтесь обращаться к нам по телефону [email protected] или по телефону: +44 (0) 208 123 7812.
Мы независимые и очень доступные эксперты, готовые оказать вам поддержку.
Производство водорода | Air Liquide Energies
Присутствующий в изобилии на Солнце газообразный водород почти отсутствует в нашей собственной атмосфере. Поэтому он должен быть извлечен из молекул, которые его содержат, таких как вода и органические соединения.
Сегодня несколько технологических областей производят водород из различных источников.
В основном используются органические соединения, состоящие в основном из водорода и углерода, такие как природный газ, уголь или биомасса. В настоящее время на его долю приходится более 90% производства водорода.
Второе месторождение производит водород путем разложения воды. Он использует либо электрический ток для электролиза, либо ряд химических реакций для термохимических циклов, позволяющих «разбить» молекулы воды для получения водорода.
Другое поле использует солнечный свет. Этот метод производства водорода все еще находится в стадии исследований: в лаборатории проводятся исследования по получению водорода с помощью микроскопических водорослей или бактерий.
Из органических соединений
Водород вместе с углеродом является основным компонентом всех органических соединений, включая углеводороды и биомассу.
Для извлечения водорода из органических соединений необходимо разрушить твердые связи между углеродом и водородом. Это, в свою очередь, требует использования ряда высокотемпературных химических реакций при высокой температуре, часто в присутствии катализаторов.
Одной из используемых технологий является риформинг, который заключается в проведении реакции между метаном и водой для получения синтез-газа, содержащего водород. Это основная технология, используемая в промышленном производстве водорода. Источниками являются природный газ и биогаз.
Future biogas, Spridlington, England
Газификация — это еще один процесс преобразования твердого соединения в газ, богатый водородом. Источниками в основном являются уголь и биомасса.
Эти технологии производства водорода приводят к выбросам CO2. Использование возобновляемых источников, включая биомассу и биогаз (из биомассы или отходов), или сочетание с технологиями улавливания и хранения CO2 может привести к уменьшению углеродного следа производства.
Риформинг природного газа
Природный газ, в основном состоящий из метана (Ch5), содержит серу, которую необходимо удалить на стадии гидрообессеривания. После очистки метан вступает в реакцию с паром с образованием синтез-газа, содержащего монооксид углерода (CO) и водород (h3). Затем водяной пар вступает в реакцию с монооксидом углерода синтез-газа с образованием диоксида углерода (CO2) и большего количества водорода. Эта смесь, богатая CO2 и h3 , затем очищается с получением примерно 99,9% водорода.
Энергия водорода
Путем разложения воды
Разделение молекул воды на компоненты позволяет производить водород. Молекулы воды (h3O) состоят из двух атомов водорода (H) и одного атома кислорода (O). Для получения водорода необходимо разорвать связи этой молекулы. Существуют различные процессы с использованием электрического тока или последовательности химических реакций.
На Земле самым важным источником водорода является вода, которая покрывает более 70% ее поверхности.
Электролиз воды
Электрический ток разлагает молекулу воды на ионы гидроксида (OH)- на катоде и на протоны H+ на аноде. Протоны принимают электроны в реакции окисления, образуя газообразный водород.
При электролизе CO2 не выделяется. Но в общем расчете необходимо учитывать производство электроэнергии. В случае, когда используемая электроэнергия производится из источников, которые не выделяют CO2 (возобновляемые источники энергии и т. д.), водород будет производиться без выделения парниковых газов. Этот метод обычно используется для производства небольших объемов водорода или вблизи недорогих источников электроэнергии (гидроэлектроэнергия). В настоящее время проводится множество исследований по повышению эффективности электролиза. Одной из областей усовершенствования является высокотемпературный электролиз водяного пара.
При высокотемпературном паровом электролизе используется меньше энергии, потому что, поскольку реакция происходит при температуре от 700 ° C до 1000 ° C, производительность элемента (кинетика) значительно улучшается. Эта технология может, например, сочетаться с набором солнечных зеркал, которые концентрируют солнечные лучи для достижения очень высоких температур, что позволит производить водород практически без парниковых газов.
Эта технология может, например, сочетаться с набором солнечных зеркал, которые концентрируют солнечные лучи для достижения очень высоких температур, что позволит производить водород практически без парниковых газов.
ch3ange – это инициатива группы Air Liquide в социальных сетях. Этот проект вращается вокруг той роли, которую водород может сыграть в энергетическом переходе. Станьте частью перемен. Присоединяйтесь к нам на ch3ange.
Присоединяйтесь к нам на Facebook Присоединяйтесь к нам на Medium
Термохимические циклы
Термохимические циклы связаны с явлением разложения воды на водород и кислород, которое происходит самопроизвольно при очень высокой температуре. Это разложение может осуществляться при более низких температурах посредством циклов химических реакций.
Этот метод производства водорода находится в стадии исследования. Это должно позволить производить водород, ограничивая выбросы парниковых газов.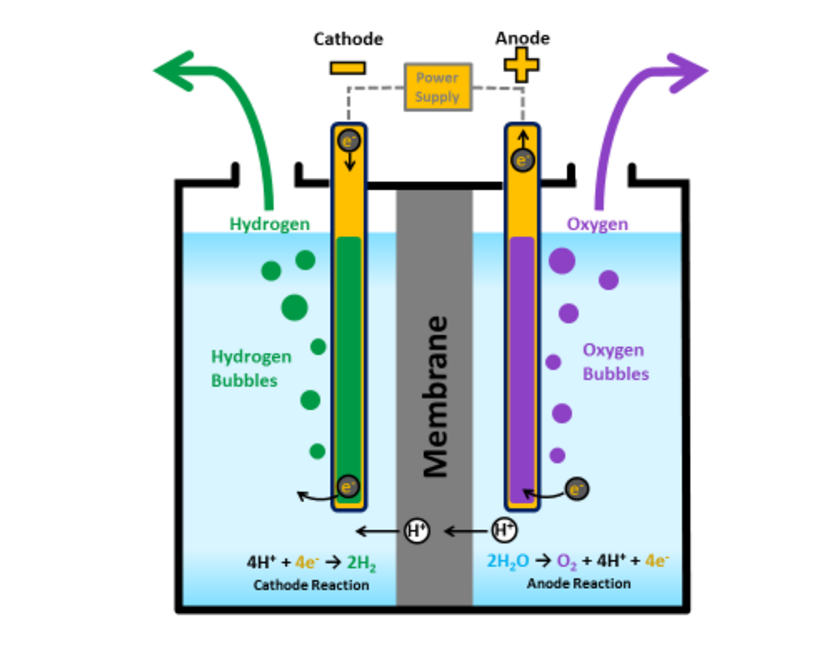
Путем фотосинтеза
Производство водорода с использованием только солнечного света и воды может показаться фантастикой. Но на самом деле многие микроорганизмы естественным образом производят водород с помощью света в процессе, известном как фотосинтез.
Это верно для различных одноклеточных зеленых водорослей и некоторых цианобактерий, преимущество которых заключается в том, что они производят водород из солнечной энергии, используя только воду.
Этот метод производства водорода не приводит к прямым выбросам парниковых газов. Сегодня он находится в стадии лабораторных экспериментов. Исследователи пытаются понять, скопировать и оптимизировать этот естественный процесс в надежде, возможно, индустриализировать его.
Химические реакции с выделением водорода
[Депозитные фотографии] Водород — широко распространенный в природе и во Вселенной элемент, занимающий первое место в Периодической таблице.
Например, водород присутствует в воде, практически во всех органических веществах, звездах и межзвездном газе, галактических планетах и т. д., поэтому значение этого элемента в мире и Вселенной трудно переоценить. В свободном виде встречается редко; объемное содержание водорода в воздухе составляет около 5∙10-5. Водород H₂ — это легкий газ, который не имеет запаха, цвета или вкуса.
Получение чистого водорода в лаборатории считается одним из самых опасных экспериментов, поскольку H₂ является взрывоопасным и горючим газом в сочетании с воздухом.
через GIPHY
Сам по себе водород безвреден для жизни человека и нетоксичен. Также следует отметить, что этот газ растворяется в этаноле и некоторых металлах, таких как железо, никель, титан и др.
История получения водорода
Что касается истории получения водорода, то этот газ добывали с тех пор, как химия стала отдельной наукой, а выделение горючего газа наблюдали при взаимодействии металлов и кислот.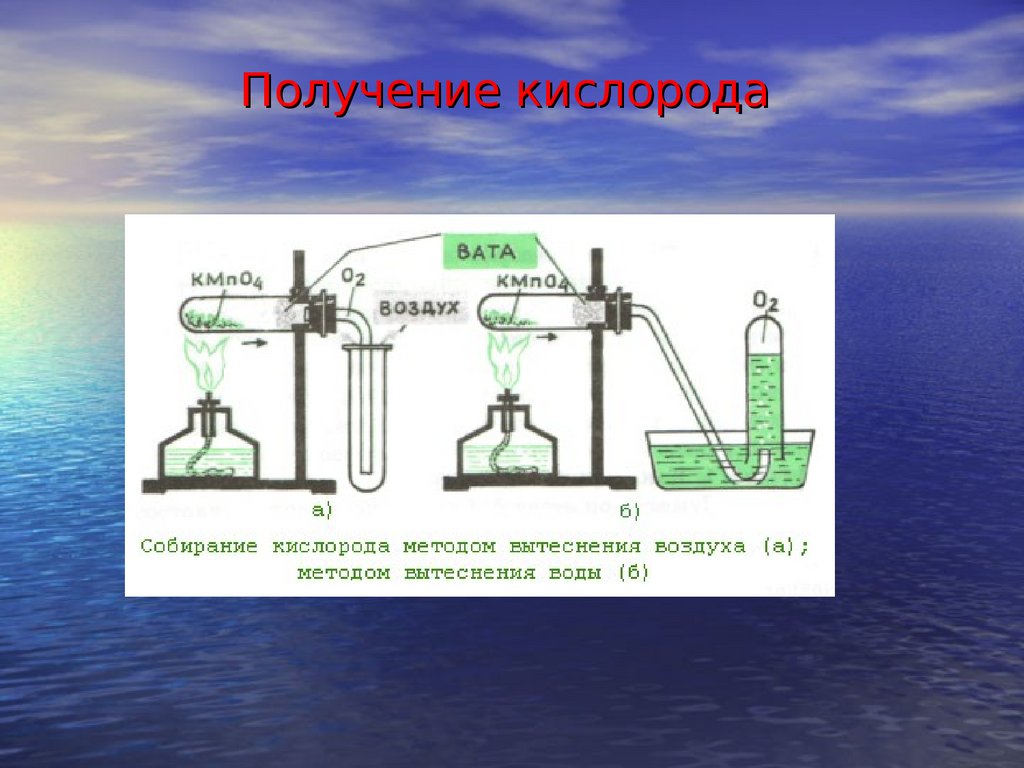
Ранее в алхимии выделяемый горючий газ был известен как флогистон, гипотетическая сверхтонкая субстанция из огня, которая наполняла все горючие вещества и выделялась из них в момент горения. Но известный русский эрудит Михаил Ломоносов показал, что в этих реакциях флогистон не выделяется. В 1766 году ученый Генри Кавендиш назвал этот газ горючим воздухом. В момент сгорания этот газ активно выделял воду, но вера Кавендиша в алхимические предания об огненном веществе мешала ему делать объективные выводы. Позднее в 1766 г. было установлено, что горючий воздух присутствует в воде и может быть извлечен из нее. К таким выводам пришли Антуан Лавуазье и Жан Менье.
Области применения
Водород активно используется в химической промышленности для производства многих веществ, например аммония, метанола, а H₂ используется также для изготовления мыла и пластмасс.
В пищевой промышленности маргарин производится с использованием водорода. Водород также используется в авиастроении для надувания дирижаблей, но из-за его взрывоопасности его заменили гелием.
В настоящее время ведутся исследования по замене традиционного топлива бензина на водородное топливо.
[Депозитные фотографии]Реакции с выделением водорода
В настоящее время наиболее распространенным методом получения водорода в промышленных масштабах является конверсия метана CH4 или природного газа. Метан — природный газ, простой углеводород. При нагревании метана с парами воды при высоких температурах (1000 °С) выделяется водород:
CH₄ + Н₂О→ C + 2H₂
В промышленности водород также получают пропусканием воды над раскаленным коксом.
Получение водорода с помощью аппарата Киппа.
Аппарат Киппа — самое известное устройство для получения газов, состоит из колбы, воронки и газовой трубки. С помощью этого аппарата водород получают с помощью цинка, соляной и серной кислот. Аппарат позволяет собирать газ в пробирку или другую емкость, но опыты с выделением H₂ можно проводить и без него, просто добавляя в пробирку кусочек цинка и соляной кислоты:
Zn + 2HCl → ZnCl₂ + H₂↑.
Реакция с выделением водорода из алюминия и щелочи позволяет получить более чистый водород. Этот опыт можно провести на открытом воздухе, наполнив водородом обычный баллон. Его нельзя проводить дома, так как эксперимент потенциально очень взрывоопасен.
2Al + 2NaOH + 6H₂O → 2Na[Al(OH)₄] + 3H₂↑
Здесь вы найдете безопасные эксперименты для проведения дома.
Вместо алюминия можно использовать алюминиевую фольгу: добавьте ее в раствор гидроксида натрия.
[Депозитные фотографии] Гидроксид натрия — это обычная жидкость для очистки труб, которую можно приобрести в хозяйственном магазине. Если вы наполните воздушный шар водородом, поместив его над колбой, из которой выпускается газ, воздушный шар поднимется в воздух.
Получение водорода этим способом довольно легко объяснить: поверхность алюминия покрыта особой оксидной пленкой, которая начинает разрушаться при взаимодействии со щелочью.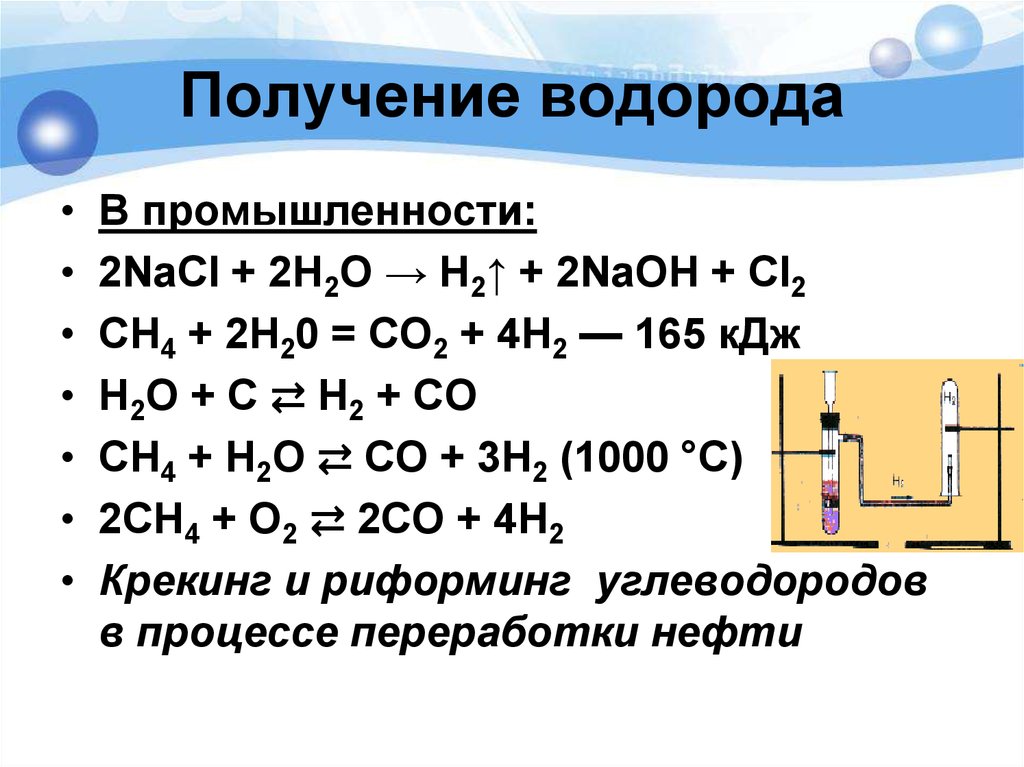
Реакция с выделением водорода с участием сульфата меди, алюминия и соли
Добавить в колбу поваренную соль (хлорид натрия) и сульфат меди CuSO₄∙5Н₂О. Затем добавьте воду. Полученная смесь должна стать зеленой, но если жидкость осталась прозрачной, добавьте еще соли и медного купороса. Затем добавьте в колбу свернутые в шар кусочки алюминия или фольги. Начнется реакция выделения водорода, так как образующийся в колбе хлорид меди снимет оксидную пленку с алюминия.
Реакция с выделением водорода с использованием щелочных и щелочноземельных металлов и воды.
Литий — легкий щелочной металл, не тонет в воде. Если в теплую воду добавить кусочек лития, то сразу пойдет реакция с выделением газа:
Li + h3O = LiOH + H₂↑.
Таким образом, при контакте щелочных металлов с водой образуется щелочь и выделяется водород.
Реакция выделения водорода с использованием кальция и воды
Кальций — мягкий щелочноземельный металл, и если добавить в воду очищенный металлический кальций, происходит бурная реакция с выделением водорода и гидроксида кальция:
Ca + 2H₂O → Ca(OH)₂↓ + H₂↑
Таким образом, при контакте щелочноземельных металлов с водой образуется основание и выделяется водород.

