- Расщепление воды – Наука – Коммерсантъ
- Новые технологии разложения воды в США и России | C.
- Электролизуем воду… а зачем?! — заказ воды для дома и офиса
- Химия для детей — Как разделить воду на водород и кислород с помощью электролиза
- Splitting Water — Scientific American
- Новый метод разделения воды для получения чистого водорода
Расщепление воды – Наука – Коммерсантъ
3K 1 мин. …
Опыт Карлайла и Николсона был простым, как все гениальное. Чуть раньше в том же 1800 году итальянец Вольта сделал первую в истории человечества химическую батарейку — вольтов столб из сложенных поочередно в столбик кружочков меди и цинка с прокладками между ними из сукна, смоченного в соленой воде. Карлайл и Николсон проводки от вольтова столба опустили в воду.
Предыдущая фотография
Фото: Henry Bone
Фото: T. Blood
Следующая фотография1 / 2
Фото: Henry Bone
Фото:
T. Blood
Blood
Оценить всю глубину своего открытия Карлайл и Николсон не смогли и, соответственно, не сумели извлечь из него все крывшиеся в нем научные дивиденды. Не потому что были химиками-самоучками (Карлайл был хирургом, а Николсон и вовсе самоучкой в буквальном смысле этого слова), а потому что вряд ли кто-нибудь другой, будь он семи пядей во лбу, смог бы это сделать, уж слишком широкое поле для научных и практических приложений открыл их опыт.
Поначалу все были загипнотизированы самим фактом того, что электричество способно менять природу материи, на детали опыта всеобщий восторг не распространялся. Эти детали исследовали уже другие ученые, и в отличие от Карлайла и Николсона они остались в истории науки авторами фундаментальных открытий.
Первым был химик Хэмфри Дэви, который, неоднократно повторяя опыт и каждый раз получая из воды только водород и кислород, стал первооткрывателем химического состава воды. Он же, пропуская ток через растворы разных солей, получил на электродах химические элементы калий, натрий, магний, стронций, барий, кальций, бор и хлор. Открыл их!
Он же, пропуская ток через растворы разных солей, получил на электродах химические элементы калий, натрий, магний, стронций, барий, кальций, бор и хлор. Открыл их!
Повторяя опыт Карлайла и Николсона, Гей-Люссак открыл закон объемных отношений газов, а Авогадро — свой «закон Авогадро». В конце концов, Берцелиус окончательно определил формулу воды Н2О. А Майкл Фарадей сформулировал законы электролиза — того явления, которое открыли Карлайл и Николсон в своем опыте и без которого немыслима современная промышленность.
О них же самих сегодня никто не помнит, хотя последние лет тридцать их опыт во всевозможных вариантах со всевозможными катализаторами с упорством маньяков воспроизводят тысячи химиков по всему миру, пытаясь экономически рентабельно разложить воду на водород и кислород, чтобы создать водородный двигатель для автомобиля. А когда эта задача будет решена, о Карлайле и Николсоне опять «первооткрыватели» топлива из воды вряд ли вспомнят.
Сергей Петухов
Картина дня
Новые технологии разложения воды в США и России | C.
 O.K. archive | 2017
O.K. archive | 2017Американские исследователи из Университета Хьюстона обнаружили катализатор, который активно ускоряет реакцию разложения воды на водород и кислород и, в отличие от аналогов, состоит из легкодоступных и недорогих материалов. Для его производства не используются драгоценные металлы, и работает он намного эффективнее, чем известные катализаторы. Такой материал позволил бы решить одну из основных проблем использования воды для производства водорода как одного из наиболее перспективных источников «чистой» энергии.
«Водород — это самый “чистый” энергоноситель, которым мы располагаем на Земле, — говорит Пол Чу (Paul Chu), профессор, заведующий кафедры физики Университета Хьюстона, директор-основатель и руководитель исследовательских работ Техасского центра исследований сверхпроводимости Университета Хьюстона (Texas Center for Superconductivity at UH, TcSUH). — Вода могла бы быть бесконечным источником водорода, если бы мы научились эффективно разрывать прочную химическую связь водорода с кислородом в воде с помощью электрического тока и соответствующего катализатора».
Новый катализатор был получен исследовательской группой Пола Чу при Университете Хьюстона, в которую также входят профессор физики Жифенг Рен (Zhifeng Ren) и доцент Шуо Чен (Shuo Chen), ведущие исследователи TcSUH, научные сотрудники Хайчин Чжоу (Haiqing Zhou) и Фанг Юй (Fang Yu), а также аспиранты Джинджинг Сан (Jingying Sun) и Ран Хей (Ran He).
Катализатор, состоящий из метафосфата железа, в кристаллическом виде выращенного на электропроводящей никелевой подложке, имеющей губчатую структуру, намного более эффективен и дёшев, чем любые аналоги.
«Наш материал позволяет отлично сэкономить, и он намного более эффективен, превосходя имеющиеся катализаторы», — говорит Жифенг Рен, профессор физики Онкологического центра имени М. Д. Андерсона при Университете Хьюстона и ведущий автор статьи о результатах работы исследовательской группы Пола Чу. Катализатор также долговечен, на испытаниях он успешно проработал более 20 часов и выдержал 10 тыс. рабочих циклов. «Некоторые катализаторы обладают выдающимися характеристиками, но они стабильны только один-два часа, — рассказывает Жифенг Рен.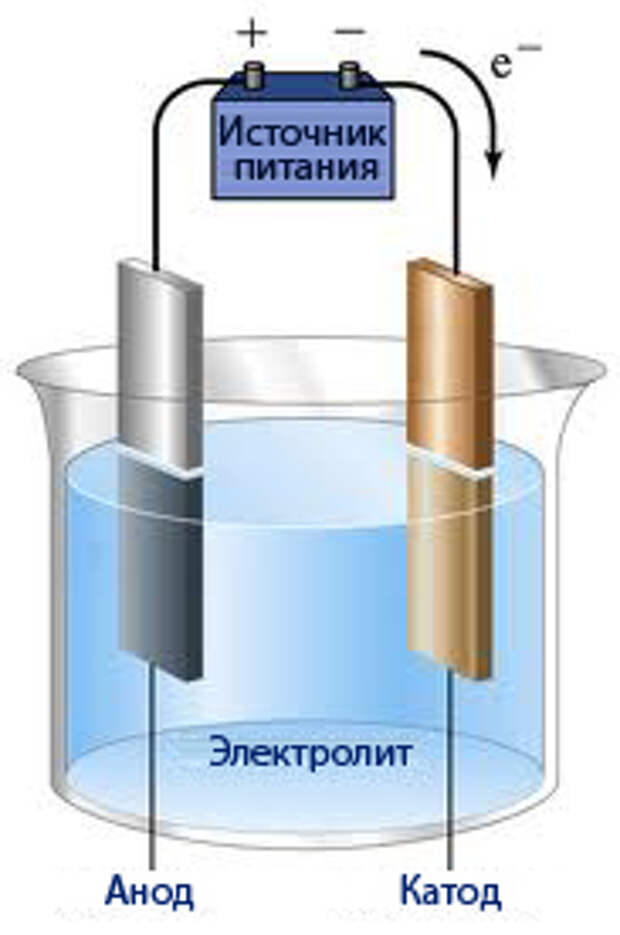 — Такие материалы практически бесполезны».
— Такие материалы практически бесполезны».
Реакция разложения воды на водород и кислород теоретически очень проста, но на практике она представляет из себя сложный процесс, требующий двух отдельных химических взаимодействий — реакции выделения водорода и реакции выделения кислорода, каждая из которых протекает на отдельном электроде. И, хотя эффективные водородные катализаторы доступны, отсутствие недорогого и действенного кислородного катализатора создаёт учёным значительные трудности в области водородной энергетики.
Водород имеет ряд значительных преимуществ. «Водород, полученный посредством разложения воды электрохимическим процессом “водного электролиза”, считается наиболее экологически безопасным энергоносителем, способным заменить ископаемое топливо и удовлетворить растущий спрос всего человечества на электроэнергию, поскольку вода является одновременно и единственным сырьём, и “продуктом сгорания” — ведь экологичная “водородная энергия” получается путём преобразования этого химического элемента обратно в воду», — поясняют исследователи. При этом, в отличие от солнечной энергии, ветра и других видов «зелёной» энергии, водород относительно легко хранить.
При этом, в отличие от солнечной энергии, ветра и других видов «зелёной» энергии, водород относительно легко хранить.
В настоящее время водород получают тремя основными промышленными способами: паровой обработкой угля в специальных газогенераторах, газопаровой конверсией природного газа и электролизом воды, особенно если нужен сверхчистый водород.
При первом способе над раскалённым добела коксом (углём, нагреваемым без доступа кислорода) пропускают водяной пар, при этом из-за высокой температуры атомы водорода в воде замещаются на атомы углерода — образуется смесь угарного газа (CO) и водорода (H2), которую затем разделяют или используют как есть. Во втором случае, также при высокой температуре (около 1000 °C), осуществляется превращение метана с водяным паром, углекислым газом (CO2) или смесью водяного пара и углекислого газа в присутствии катализатора на основе никеля с добавками оксидов магния, алюминия и других металлов, причём образующуюся смесь водорода и угарного газа нужно затем дополнительно обрабатывать водяным паром. Водород также получают как побочный продукт производства хлора и гидроксидов щелочных металлов, которое осуществляется электролизом растворов их хлоридов.
Водород также получают как побочный продукт производства хлора и гидроксидов щелочных металлов, которое осуществляется электролизом растворов их хлоридов.
Все эти методы сложны, крайне энергозатратны и связаны с выработкой вредного угарного газа, а также сажи, то есть имеют существенный «углеродный след», несмотря на то, что исходное сырьё в данных процессах сгорает относительно «чисто».
Исследовательница Шуо Чен отмечает, что известные на сегодняшний день катализаторы, ускоряющие реакцию выделения кислорода при электролизе воды, используют благородные металлы — иридий, платину или рутений. Но эти материалы дороги и недоступны.
«В своём исследовании мы обнаружили дешёвый, высокоэффективный и стабильный катализатор, основанный на широко распространённых химических элементах, который поразительным образом превосходит все благородные металлы, — подытоживает Шуо Чен. — Наше открытие может привести к гораздо более экономичному промышленному производству водорода простым электрохимическим разложением (электролизом) воды».
Отметим, что разложение воды на составные элементы может осуществляться и с помощью фотокатализа, который использует силу солнца. Однако прямое воздействие солнца на воду слишком неэффективно, так как вода поглощает лишь небольшую часть спектра солнечного излучения. Шуо Чен поясняет, что в идеале солнечные батареи будут использоваться для выработки электроэнергии, которая вместе с соответствующим катализатором позволит легко и эффективно разлагать воду для получения такого нужного человечеству химического элемента, как водород.
Рассказывает И. В. Мещерин, к.т.н., доцент кафедры газохимии РГУ нефти и газа им. И. М. Губкина, председатель Комитета по технологическому проектированию в НОПРИЗ, президент Национальной палаты инженеров:
— Известно, что производство водорода в основном осуществляется крупнотоннажными системами с единичной объёмной производительностью в диапазоне 10–100 тыс. Нм³/ч [1]. От 1 до 5 % получаемого водорода находит применение в малотоннажных, наукоёмких отраслях промышленности: электронной, электротехнической, стекольной, фармацевтической, пищевой; выплавке металлов и сплавов высокой чистоты; синтезе химически высокоактивных веществ и других отраслях. Водород является ценным химическим реагентом, и его получение и концентрирование из топливных, остаточных, сбросных газов позволяет значительно повысить экономическую эффективность производства. Водород почти не встречается в природе в чистом виде, но потребление данного газа во всём мире неуклонно растёт. Для производства водорода необходимо специальное оборудование, отличительной чертой которого является компактность и надёжность.
Водород является ценным химическим реагентом, и его получение и концентрирование из топливных, остаточных, сбросных газов позволяет значительно повысить экономическую эффективность производства. Водород почти не встречается в природе в чистом виде, но потребление данного газа во всём мире неуклонно растёт. Для производства водорода необходимо специальное оборудование, отличительной чертой которого является компактность и надёжность.
Децентрализованное (то есть малотоннажное) производство водорода требует создания высокоэффективных технологий с уровнем единичной объёмной производительности в диапазоне от 10 до 1000 Нм³/ч [2].
Данный аспект в сегодняшней ситуации может иметь существенное влияние на экономическую эффективность производств, в которых используется водород. В условиях экономического кризиса поиск технологий получения водорода с меньшими затратами является актуальной задачей. В настоящий момент внутрироссийские регулируемые цены на природный газ продолжают оставаться одними из самых низких в мире, даже с учётом более чем двукратного падения цен на природный газ на европейском рынке.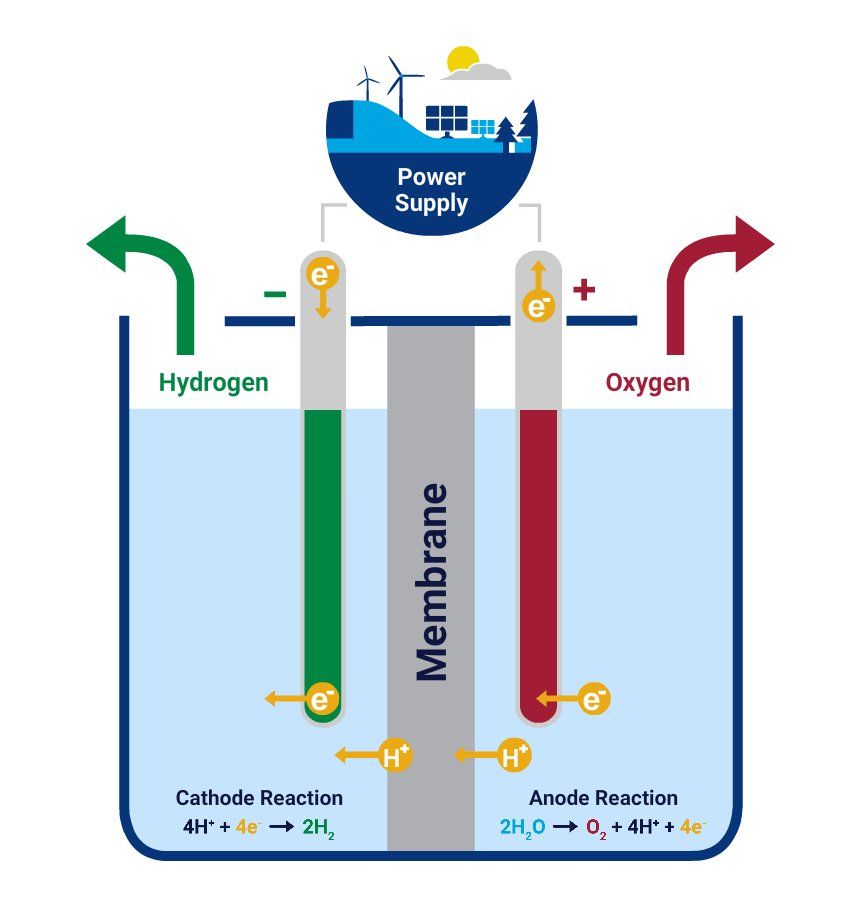 Одним из альтернативных решений могут быть технологии получения водорода из природного газа.
Одним из альтернативных решений могут быть технологии получения водорода из природного газа.
Изучение конкретной проблематики производилось сотрудниками кафедры газохимии РГУ нефти и газа (НИУ) имени И. М. Губкина в условиях завода по производству кварцевого стекла — ООО «Технокварц» в городе Гусь-Хрустальный.
Компания ООО «Технокварц» производит водород для производственных нужд с помощью блока электролизёров БЭУ-250, состоящий из шести электролизёров СЭУ-40. Этой производительности достаточно для обеспечения существующего объёма потребления водорода в технологии наплава кварцевого стекла. Целью работы являлся поиск экономически более эффективного метода получения водорода на базе ресурсов завода.
Промышленное производство кварцевого стекла связано с развитием экстремальных процессов со специфическими условиями, главным образом в космической и электронной технике, производстве чистых, особо чистых веществ, редких металлов, высокотемпературных неорганических соединений и т. п.
п.
В результате анализа существующих методов получения водорода был выбран, как наиболее целесообразный, метод паровой конверсии природного газа. При помощи д.т.н., профессора М. Х. Сосны был произведён технологический расчёт блока конверсии для установки получения водорода. Входными данными послужили составы входящих потоков, их объёмы, температуры, давления, доля водяного пара, а также длина реактора, его диаметр и толщина стенки (расчёт реактора в 2016 году выполняла Мария Давыдова, технолог газохимии и магистрантка РГУ нефти и газа им. И. М. Губкина). В результате обработки полученных данных получен материальный баланс процесса (табл. 1), конверсия метана составила 92,6 %. Был также проработан вопрос изготовления реактора из кварцевого стекла.
Ниже приводится эскиз гипотетического мини-, микрореактора проточного типа из кварцевого стекла в горизонтальном исполнении для проведения химических процессов. Основой реактора служит модуль, представленный на рис. 1. Зоны 1 и 2 служат для подачи исходных компонентов, реакционная зона 3 предназначена для размещения катализаторов, нагрева рабочей смеси до температуры реакции, воздействия ВЧ-, ВУФи СВЧизлучения или иного технологического воздействия.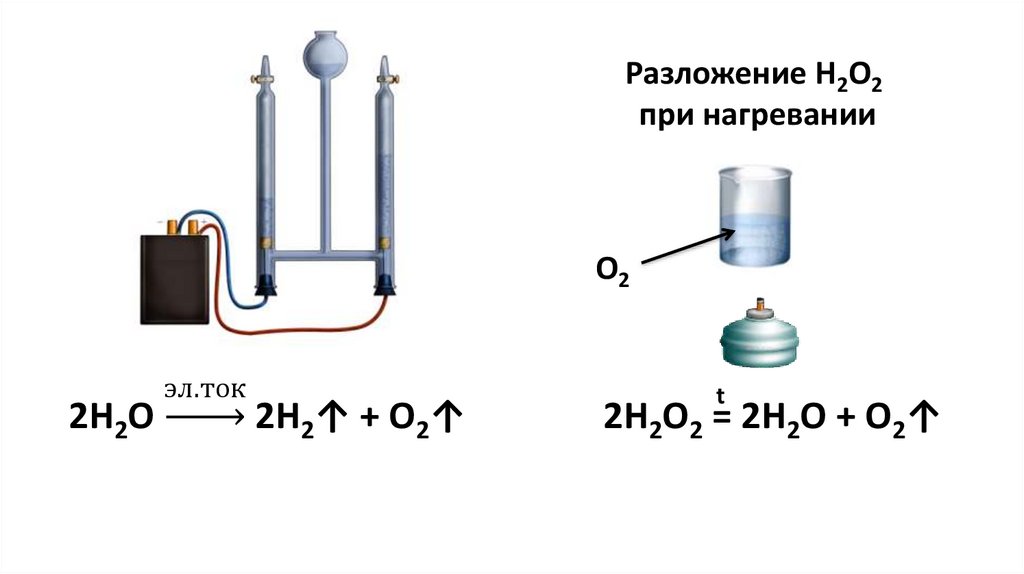 Конфигурация зоны 3 может формироваться по требованиям ведения химических реакций. Зона 4 организована как циклон для разделения и закалки продуктов реакции, в том числе и как газовая центрифуга. Единичные модули в расчётном количестве собираются в батарею, как показано на рис. 2. По усмотрению разработчиков промышленные модули могут быть спроектированы и в вертикальном исполнении цилиндрической или иной формы.
Конфигурация зоны 3 может формироваться по требованиям ведения химических реакций. Зона 4 организована как циклон для разделения и закалки продуктов реакции, в том числе и как газовая центрифуга. Единичные модули в расчётном количестве собираются в батарею, как показано на рис. 2. По усмотрению разработчиков промышленные модули могут быть спроектированы и в вертикальном исполнении цилиндрической или иной формы.
Экономическая эффективность достигается за счёт того, что используется относительно недорогой природный газ, по сравнению с дорогой электроэнергией, себестоимость оборудования из кварцевого стекла на 25–40 % меньше, чем из металла.
Возможность развития конкретной технологии и отладки её внутри предприятия открывает новый метод получения водорода для малотоннажных производств. Кроме того, появление нового перспективного ассортимента товарной продукции существенно усовершенствует технологии обработки кварцевого стекла, дополнительно будет способствовать улучшению экономических показателей кварцевого производства.
Поскольку паровая конверсия природного газа в комплексе с аппаратурным оформлением процесса является составной частью синтеза материалов по реакциям Фишера-Тропша, перед ООО «ТехноКварц» возникает перспектива нового направления — изготовление высокоэффективных минии микроканальных кварцевых реакторов для других сегментов отрасли газохимии.
Электролизуем воду… а зачем?! — заказ воды для дома и офиса
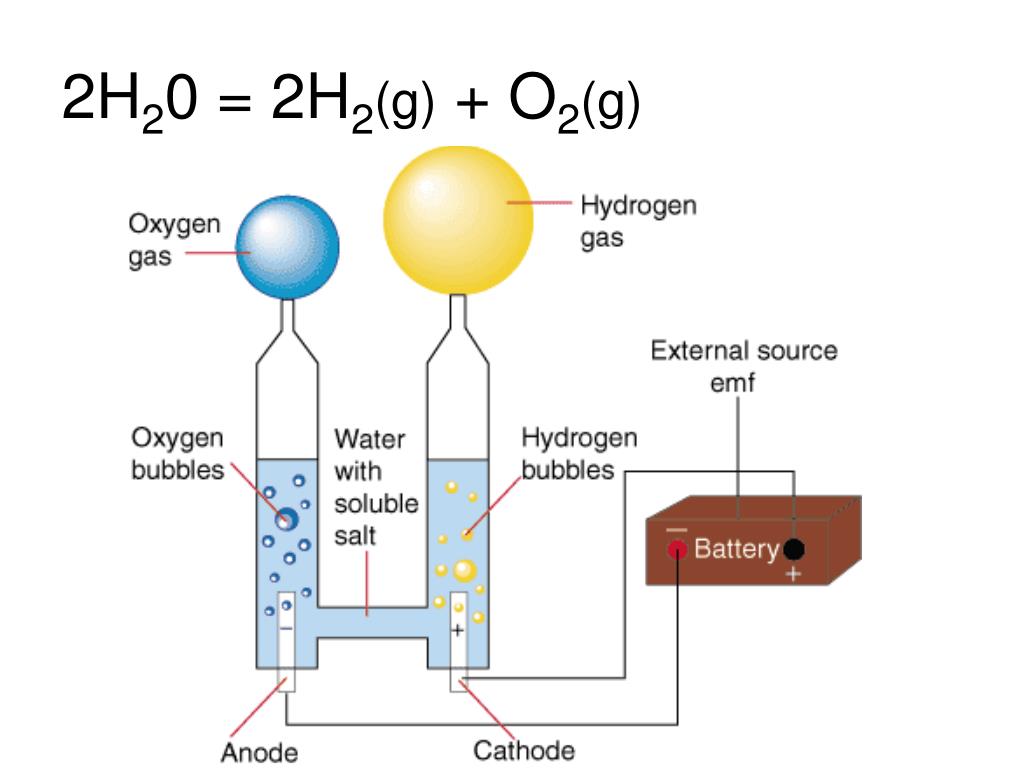
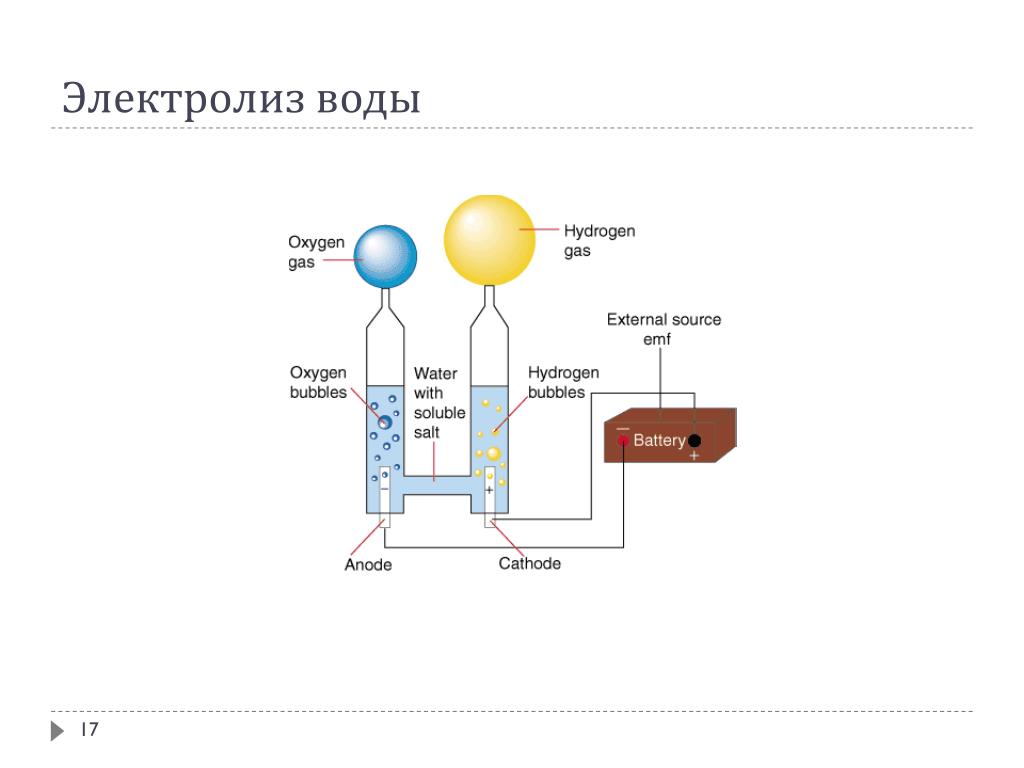
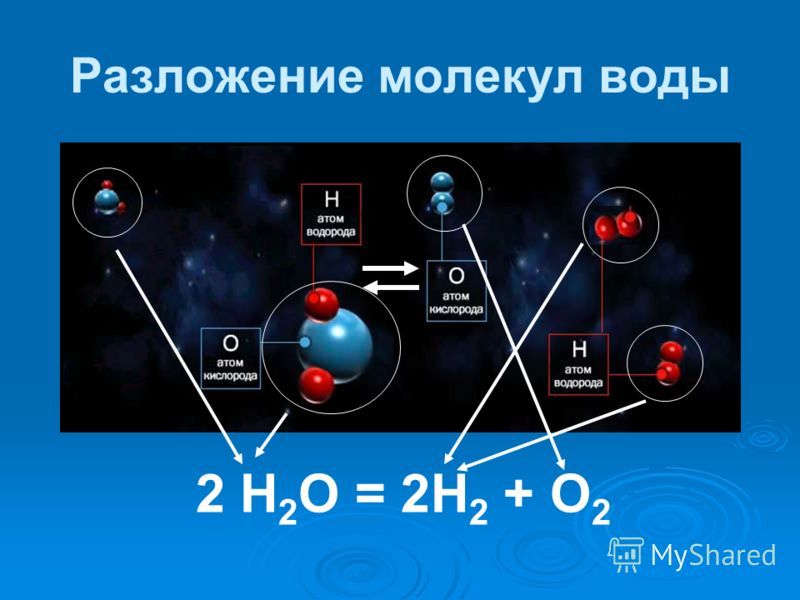
Физико-электрохимическим термином «электролиз воды» каждый из нас познакомился еще в 8 классе средней школы. Принцип электролиза прост: под действием постоянного электрического тока вода разлагается на кислород и водород: 2Н2О = 2Н2↑ + О2↑.
Сейчас в науке и технике электролиз воды нашел положительное применение. Например, в связи с глобальным энергетическим кризисом в прессе часто упоминают электролиз воды как альтернативу нефтепродуктам и основу водородной энергетики. Французы создали стиральную машину, в основу работы которой положен принцип очистки белья ионами H+ и OH-, генерируемыми в её недрах при электролизе воды, причем ионы H+ стерилизуют одежду, а OH- занимаются удалением грязи. Электролиз уже используется в некоторых странах для обеззараживания питьевых и сточных вод.
Электролиз уже используется в некоторых странах для обеззараживания питьевых и сточных вод.
Но, к сожалению, электролиз воды имеет отношение и к некоторым популистским «водным» теориям. И в связи с периодически подогреваемым к этим теориям интересом давайте обратимся к двум наиболее популярным.
Уже несколько десятков лет, не столько в науке, сколько в среде потребителей, с переменной интенсивностью обсуждается вопрос активированной воды, она же «живая», щелочная (pH – 8,0-10,5), или католит, и «мертвая», кислотная (pH – 2,5-5,5), или анолит, получаемая с помощью электролиза. Разработаны и продаются многочисленные приборы для получения такой воды в домашних и промышленных масштабах. Сторонниками теории «живой» и «мертвой» воды утверждается, что католит стимулирует биологические процессы, обладает повышенной растворяющей и экстрагирующей способностью, более абсорбционно-химически активен. А анолиту присущи выраженные угнетающие свойства, поэтому он замедляет биопроцессы и потому, якобы, является мощным антисептиком и консервантом, что позволяет рекомендовать его для борьбы с микроорганизмами. Утверждается, что, регулируя процесс электролиза (время, сила тока, исходный состав воды, исходное значение концентрации водородных ионов — рН) можно получить воду желаемых свойств, даже близкую по свойствам к крови и лимфе – основным жидкостям человеческого организма, а потому такая вода – якобы, панацея от всех болезней.
Утверждается, что, регулируя процесс электролиза (время, сила тока, исходный состав воды, исходное значение концентрации водородных ионов — рН) можно получить воду желаемых свойств, даже близкую по свойствам к крови и лимфе – основным жидкостям человеческого организма, а потому такая вода – якобы, панацея от всех болезней.
Сегодня также достаточно популярна другая теория — антиоксидантная — о необходимости защиты здоровой ткани от разрушительного окисления активным кислородом, постоянно производимым человеческим организмом. Вещества, предотвращающие окисление, называют антиоксидантами. Одним из таких веществ, по мнению сторонников этой теории, является ионизированная вода — водопроводная вода, преобразованная умеренным электролизом, в результате которого в ней образуется огромное количество электронов, которые могут быть доставлены активному кислороду в организме, чтобы прекратить нежелательное окисление нормальных клеток. И ведется безудержная реклама, и предлагаются приборы для производства такой воды…
Но о пользе различных теорий и изобретений для здоровья человека, имеют право рассуждать, утверждать в уважаемых научных и официальных изданиях, в серьезных рубриках только медики на основе длительных медицинских наблюдений, исследований, клинических испытаний на добровольцах и пр.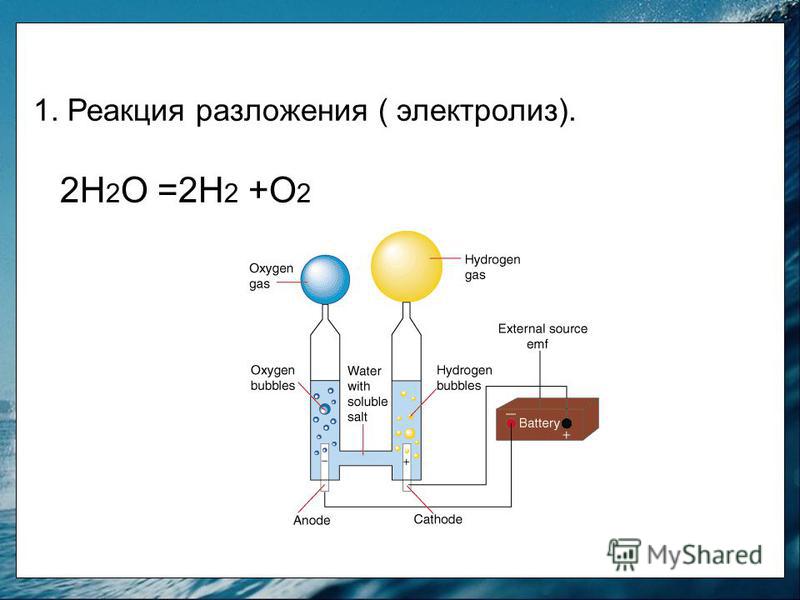 Вот, например, статистически достоверная новость: ученые Копенгагенского университета в 2006 году, используя методику, которую разработала ведущая международная группа Cochrane Collaboration, специализирующаяся на анализе эффективности применяемых в медицине средств, пришли к выводу, что антиоксиданты в таблетках, известные и употребляемые уже не одно десятилетие, причинили принимающим их людям больше вреда, чем пользы. Что тогда говорить о «новоявленном» антиоксиданте – обработанной электролизом воде?!
Вот, например, статистически достоверная новость: ученые Копенгагенского университета в 2006 году, используя методику, которую разработала ведущая международная группа Cochrane Collaboration, специализирующаяся на анализе эффективности применяемых в медицине средств, пришли к выводу, что антиоксиданты в таблетках, известные и употребляемые уже не одно десятилетие, причинили принимающим их людям больше вреда, чем пользы. Что тогда говорить о «новоявленном» антиоксиданте – обработанной электролизом воде?!
Кроме того, нет однозначной физиологической оценки результатов электролиза, при котором уменьшается количество солей (растворенных и нерастворенных) в питьевой воде, в том числе и необходимых для человека, поскольку эффект электролиза воды сродни процессу дистилляции: в обоих случаях умягчается вода. Но Всемирная Организация Здравоохранения — законодатель для всех экономически развитых стран в разработке требований к питьевой воде, — рекомендует очень осторожно умягчать воду. Известно, что излишне мягкая вода «вымоет» из организма без разбору и «шлаки», и нужные минералы, в результате чего начнутся сбои в работе сердечно-сосудистой системы и других систем организма из-за невозможности синтеза полноценных ферментов, гормонов, секретов и пр.
Доказано также, что затрудняется утилизация организмом некоторых компонентов воды при изменении их физико-электро-химического состояния из-за электролиза.
Далее, доказано, что обычная (протиевая) вода содержит наряду с обычными молекулами воды (Н2О) незначительное количество молекул тяжелой (дейтериевой) воды (D2O), в состав которой входит тяжелый изотоп водорода. При электролизе такой воды разложению подвергаются преимущественно обычные молекулы, а остаток постепенно обогащается молекулами дейтерия, небезопасного для человека. Зафиксированы даже случаи тяжелых отравлений дейтериевой водой.
Существует жесткое, но справедливое правило: в производстве питьевой воды только государством могут быть признаны и рекомендованы к употреблению и использованию методы, приборы, аппараты…
Теперь о некоторых рекламных трюках. Понятно, что процесс электролиза воды будет длиться до разложения последней ее молекулы. Поэтому, когда, например, не совсем компетентные или честные продавцы так называемых фильтров — приборов для доочистки воды — в емкость с дистиллированной водой вставляют электроды, то начинается электролиз, и вода меняет цвет (если добавлен индикатор, реагирующий на смену рН) или прозрачность. Но это значит, что нам всего лишь показывают фокус, основанный на изменении концентрации водородных ионов, а вовсе не демонстрируют огромные «очистные» возможности предлагаемого метода или фильтра. И тем более не убеждают нас в необходимости покупки и использования прибора, как правило, достаточно дорогого.
Но это значит, что нам всего лишь показывают фокус, основанный на изменении концентрации водородных ионов, а вовсе не демонстрируют огромные «очистные» возможности предлагаемого метода или фильтра. И тем более не убеждают нас в необходимости покупки и использования прибора, как правило, достаточно дорогого.
Существует жесткое, но справедливое правило: в производстве питьевой воды только государством могут быть признаны и рекомендованы к употреблению и использованию методы, приборы, аппараты и пр., прошедшие полноценную, длительную, разностороннюю проверку. А пока в Украине нет упоминаний о вышеназванных методах ни в одном официальном документе.
Поэтому берегите здоровье, взвешивайте все «за» и «против», прежде чем приобретать рекламируемый товар или продукт, безопасность употребления которого не гарантирует Министерство здравоохранения.
Химия для детей — Как разделить воду на водород и кислород с помощью электролиза
Нам всем говорили, что вода состоит из водорода и кислорода. Но как мы действительно знаем это? Может ли это влажное вещество, утоляющее нашу жажду и охлаждающее наши тела в жаркие летние дни, действительно состоять из двух газов ?
Но как мы действительно знаем это? Может ли это влажное вещество, утоляющее нашу жажду и охлаждающее наши тела в жаркие летние дни, действительно состоять из двух газов ?
Мы пытались разделить воду на кислород и водород с помощью электролиза. Нам удалось это сделать после серии экспериментов, которые оставили у нас еще больше вопросов, чем до того, как мы начали. Что не обязательно плохо — любопытство — отличное состояние обучения! (см. таинственный случай отсутствия кислорода, ниже.)
Вы можете воспользоваться нашими ошибками и провести электролиз быстрым способом. Вот как можно разделить воду на водород и кислород с помощью электролиза. Потом я расскажу вам о том, что мы сделали сначала, что произвело совсем другой газ.
Как разделить воду на водород и кислород
Что вам понадобится
- стеклянная или пластиковая ванна
- 2 резинки
- 2 пробирки (по возможности с крышками)
- двууглекислая сода (1 ст.
 л.)
л.) - графитовые грифели
- вода Батарейка
- (мы использовали 6В, примерно как эта)
- 2 пары зажимов типа «крокодил»
- водонепроницаемая лента
Чем вы занимаетесь
Подробные инструкции по установке смотрите в этом видео – расположение эластичных лент идеально удерживает пробирки на месте.
Если вы не можете посмотреть видео, вот его суть: Подсоедините один конец каждого зажима-крокодила к кусочку графита, а другой к батарее. Прикрепите концы графита ко дну ванны так, чтобы графит торчал вверх, и поместите перевернутую пробирку на каждый кусок графита (удерживаемый эластичными лентами). Растворите бикарбонат соды в воде и наполните ванну. Наконец, выньте каждую пробирку, наполните ее водой и осторожно поставьте на графит. Любые газы, собранные во время электролиза, заменят воду в трубках, поэтому убедитесь, что нет пузырьков воздуха.
Что происходит
На каждом электроде быстро начинают образовываться пузырьки газа. На отрицательном электроде (катоде) собирается больше газа, чем на положительном (аноде).
На отрицательном электроде (катоде) собирается больше газа, чем на положительном (аноде).
Как проверить свои газы
Когда вы соберете достаточное количество газа на каждом электроде, осторожно закройте пробирки крышками (пока они находятся под водой).
Для проверки на водород
Мы предположили, что газ на нашем (отрицательном) катоде был (положительно заряженным) водородом. Водород взрывоопасен. В таких количествах он не разрушит ваш дом, но будет издавать прохладный хлопающий звук в присутствии зажженной щепки. Вы можете услышать это в видео ниже.
Для проверки на кислород
Мы проверяем на кислород с помощью светящейся шины. Если кислорода достаточно, шина воспламеняется. Газ, который мы собрали на нашем аноде, дал кратковременное свечение, которое подтвердило, что это кислород, но после возбуждения от взрыва водорода мы были немного разочарованы. Позже мы произвели намного больше кислорода, используя другой метод — см. ниже видео о нашей повторно зажженной шине.
Если кислорода достаточно, шина воспламеняется. Газ, который мы собрали на нашем аноде, дал кратковременное свечение, которое подтвердило, что это кислород, но после возбуждения от взрыва водорода мы были немного разочарованы. Позже мы произвели намного больше кислорода, используя другой метод — см. ниже видео о нашей повторно зажженной шине.
Как работает электролиз?
Вода представляет собой ковалентную молекулу (h30), удерживаемую общими электронами в ковалентных связях.
Во время электролиза молекулы восстанавливаются на катоде до газообразного водорода и окисляются на аноде до газообразного кислорода.
Чистая вода не проводит электричество, поэтому нам нужно добавить электролит, например двууглекислую соду. (Вы не поверите, сколько веб-сайтов советуют использовать соль. Мы попробовали и получили совершенно другой газ. Подробнее об этом позже.)
Производится вдвое больше водорода, чем кислорода, что отражает молекулярный состав вода.
Credit – J Squish
Вот довольно простое объяснение электролиза воды.
Если вам нужно более подробное объяснение, см. Википедию.
{Большое спасибо, Сара, за то, что указали на мое прежнее недоразумение и сделали этот пост более точным!}
Загадочный случай отсутствия кислорода
(Или что происходит, когда вы используете соль в качестве электролита.)
Прежде чем мы успешно разделили воду на водород и кислород, используя описанный выше метод, мы пытались добавить соль, чтобы помочь нашей воде проводить электричество. И не только щепотку соли. Я решил, что если немного соли немного поможет, то много соли будет еще лучше. (В конце концов, это работает для кристаллов.)
Мы проводим наш электролиз, используя тот же аппарат, что и выше, но на этот раз с насыщенным раствором соли. И вот мы сидели, жадно выискивая наши пузыри водорода и кислорода.
Что случилось? Ну, много на нашем катоде. Газ быстро начал заполнять пробирку. Мы протестировали его и обнаружили, что это водород. А на положительном электроде? Ни единого пузырька газа! Что случилось с кислородом из наших молекул воды?
Ночью я провел небольшое исследование.
Похоже, что во время электролиза раствора хлорида натрия (соли) хлорид натрия распадается на положительном электроде с образованием газообразного хлора и раствора гидроксида натрия. (Нажмите на ссылку, чтобы получить более подробное объяснение.) Хлор легко растворяется в воде, поэтому не будет собираться в виде газа, пока раствор не станет насыщенным и не сможет больше поглощать хлор.
Итак, если наш положительный электрод был занят притяжением хлора, а на катоде собирался водород… что случилось с кислородом? Или в натрий из нашего хлорида натрия (NaCl), если уж на то пошло? По словам химиков, натрий и кислород объединяются, образуя раствор гидроксида натрия. Требовалось дальнейшее расследование.
Мы оставили наш аппарат настроенным — отключенным от батареи — на ночь. Мы решили изучить его на наличие зацепок.
Дальнейшие исследования
Какие изменения произошли в результате электролиза?
Наш солевой раствор приобрел коричневатый цвет. Был ли это растворенный хлор? Сломанный графит? Проржавел зажим-крокодил (который был прикреплен к аноду)?
Был ли это растворенный хлор? Сломанный графит? Проржавел зажим-крокодил (который был прикреплен к аноду)?
Фильтрация раствора .
Часть нашего положительного электрода (анода) сломалась, оставив в растворе черные частицы. Мы используем графит в электролизе, потому что это инертный (нереакционноспособный) металл, но, возможно, большое количество произведенного нами хлора вызвало его реакцию? Мы отфильтровали коричневый раствор, чтобы увидеть, остались ли какие-либо нерастворимые частицы. Они этого не сделали. Но мы заметили несколько белых пятен на фильтровальной бумаге — должно быть, хлор, образующийся на нашем положительном электроде, обесцветил бумагу!
Тестирование рН раствора
Мы предположили, что раствор будет слегка щелочным из-за гидроксида натрия. Но когда мы проверили его, мы обнаружили обратное. Он был слегка кислым — как хлор.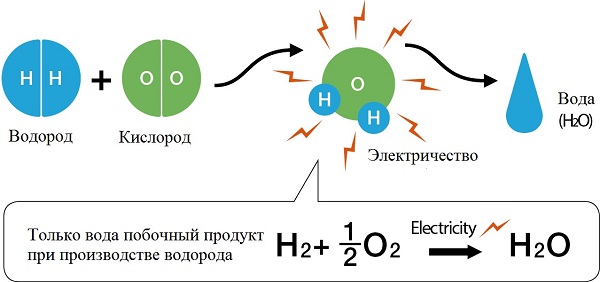 Мы предположили, что это означает, что раствор должен содержать больше хлора, чем гидроксида.
Мы предположили, что это означает, что раствор должен содержать больше хлора, чем гидроксида.
Больше удовольствия от кислорода
Здесь я немного отклоняюсь от темы, но обещал рассказать, как мы создали достаточное количество кислорода, чтобы успешно протестировать его. Идея пришла к нам после перехода к 9 0007 Магия кислорода Шоу в Королевском институте. Я хотел бы поделиться с вами одной из демонстраций, которые мы там видели.
Ведущие спросили, могут ли они одолжить у меня купюру в 10 фунтов, а потом подожгли ее! Вот видео моих пылающих денег.
Невредимая банкнота номиналом 10 фунтов стерлингов Магия кислорода Ученые также продемонстрировали, как сделать «зубную пасту для слонов», расщепляя перекись водорода.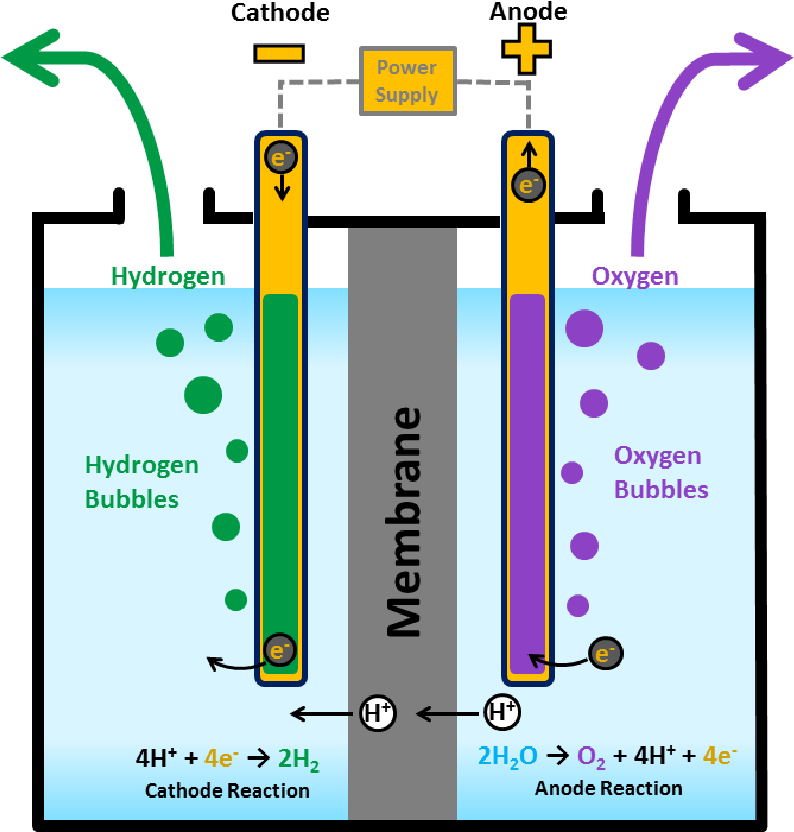 Мы вспомнили, как когда-то сами делали зубную пасту для слонов. Когда мы вернулись домой, мы решили снова сделать зубную пасту для слонов и использовать светящуюся шину для проверки на кислород.
Мы вспомнили, как когда-то сами делали зубную пасту для слонов. Когда мы вернулись домой, мы решили снова сделать зубную пасту для слонов и использовать светящуюся шину для проверки на кислород.
Когда вы помещаете светящуюся шину в кислород, она снова загорается.
Почему это мой любимый способ заниматься наукой на дому
Как вы понимаете, это была не та демонстрация науки на дому, где мама точно знает, что произойдет и почему. Я изучал химию до шестнадцати лет – почти тридцать лет назад! Я не знал ответов на многие вопросы, возникающие в результате этих экспериментов.
Я изучал химию до шестнадцати лет – почти тридцать лет назад! Я не знал ответов на многие вопросы, возникающие в результате этих экспериментов.
Но незнание того, что произойдет, вызвало у меня любопытство и вдохновило узнать больше, а дети определенно были увлечены моим волнением. И я рад, что мы совершили «ошибку», использовав сначала соль в качестве электролита, потому что иначе мы упустили бы очень интересную науку!
Занимались ли вы в последнее время какой-нибудь интересной наукой?
Вы когда-нибудь расследовали случай отсутствия кислорода?
***
С благодарностью присоединяюсь сюда:
Итоги недели – Странные несоциализированные домашние школьники
Пятница с коллажами – Доморощенные ученики
The Home Ed Link Up #16 – Приключения в домашнем образовании Adventures in Mommydom
Finishing Strong — начинается в восемь
The Hip Homeschool Hop — Hip Homeschool Moms
Splitting Water — Scientific American
Share on Facebook
Share on Twitter
-
Share on Reddit
Share on LinkedIn
Share via Email
Print
 Все, что нужно, это немного сока! Кредит: Джордж Рецек
Все, что нужно, это немного сока! Кредит: Джордж Рецек Ключевые понятия
Вода
Химия
Электричество
Молекулы
Введение
Пользуешься им каждый день и без него не выживешь — нет, это не интернет, а вода! Это одно из самых важных соединений в мире, и проблема становится все более важной во всем мире. Вы, наверное, слышали, что во многих местах засуха или загрязнение воды ограничивают запасы чистой питьевой воды, и эти запасы продолжают сокращаться. Размышляя об этом, задумывались ли вы когда-нибудь, почему мы не делаем воду сами? Из чего на самом деле состоит вода? В этой научной деятельности вы будете использовать энергию в виде электричества для расщепления воды на отдельные компоненты; так что соберите все материалы и приготовьтесь узнать, что это такое, — и разделите их сами!
Фон
Чтобы узнать, из чего состоит вода, полезно посмотреть на ее химическую формулу: h3O. Это в основном говорит нам о том, что молекула воды состоит из двух элементов: водорода и кислорода или, точнее, двух атомов водорода (h3) и одного атома кислорода (O). Водород и кислород являются газами при комнатной температуре. Значит ли это, что мы можем просто соединить оба газа и получить воду? Это не так просто. В уравнении отсутствует энергетическая составляющая химической реакции. Изготовление воды из ее элементов производит большое количество энергии. Химические реакции, в результате которых выделяется энергия, также называют экзотермическими реакциями. В случае водорода и кислорода выделяемая энергия настолько велика, что ее практически невозможно контролировать, и в большинстве случаев она приводит к взрыву. К счастью, эта реакция не происходит самопроизвольно, а происходит только при поджигании газовой смеси зажигалкой.
Водород и кислород являются газами при комнатной температуре. Значит ли это, что мы можем просто соединить оба газа и получить воду? Это не так просто. В уравнении отсутствует энергетическая составляющая химической реакции. Изготовление воды из ее элементов производит большое количество энергии. Химические реакции, в результате которых выделяется энергия, также называют экзотермическими реакциями. В случае водорода и кислорода выделяемая энергия настолько велика, что ее практически невозможно контролировать, и в большинстве случаев она приводит к взрыву. К счастью, эта реакция не происходит самопроизвольно, а происходит только при поджигании газовой смеси зажигалкой.
Если делать воду из ее элементов так опасно, то как насчет обратной реакции? Разделить воду на два компонента гораздо проще, и это называется электролизом воды. Получение водорода или кислорода таким способом кажется простым. Но, как вы, вероятно, подозревали, эта обратная реакция требует затрат энергии, поэтому ее также называют эндотермической реакцией. При электролизе воды источником энергии, используемой для протекания реакции, является электричество. Самый простой способ получения электричества — аккумулятор. Однако, поскольку чистая вода плохо проводит электричество, для электролиза требуется добавление электролита 9.0007,
При электролизе воды источником энергии, используемой для протекания реакции, является электричество. Самый простой способ получения электричества — аккумулятор. Однако, поскольку чистая вода плохо проводит электричество, для электролиза требуется добавление электролита 9.0007,
 Вы можете убедиться в этом сами в этом упражнении и даже зафиксировать оба газа!
Вы можете убедиться в этом сами в этом упражнении и даже зафиксировать оба газа!Материалы
- Водонепроницаемая рабочая зона
- Помощник для взрослых
- Графит для механического карандаша (достаточно толстый, чтобы не сломаться) или деревянный карандаш и нож, чтобы ваш взрослый помощник извлек графит
- Клей
- Play-Doh или другая глина
- Два или три одноразовых пластиковых стаканчика (лучше всего подходят прозрачные пластиковые стаканчики на 18 унций).
- Ножницы
- Перманентный маркер
- Две металлические кнопки
- Дистиллированная вода
- Пищевая сода
- Аккумулятор на девять вольт
- Две прозрачные соломинки (большой размер)
- Чайная ложка
- Медицинская капельница
- Таймер
- Бумажные полотенца
- Тест-полоски для определения pH (дополнительно)
- Поваренная соль (хлорид натрия — NaCl) (по желанию)
Подготовка
- Ваша рабочая зона должна быть водонепроницаемой; разливы воды могут произойти во время деятельности.
- Соберите свой прочный графитовый механический карандаш. Убедитесь, что у вас есть два куска длиной около 2,5 см (один дюйм). Если вы решите использовать деревянный карандаш, попросите взрослого взять нож и извлечь из карандаша графитовый грифель. (Для этого у вас также должно получиться два куска длиной примерно 2,5 сантиметра). Это будут ваши графитовые электроды.
- Аккуратно отрежьте ножницами (или отрежьте взрослым) открытый конец одного пластикового стаканчика так, чтобы он был на высоте девятивольтовой батареи. В нижней части чашки прорежьте отверстие, чтобы кончик батареи (с двумя полюсами) мог пройти через него.
- Возьмите другую чашку и держите дно этой чашки поверх девятивольтовой батареи. Несмываемым маркером на внутренней стороне чашки нарисуйте две точки внизу, где чашка соприкасается с двумя полюсами батареи.
- Снимите чашку с батареи и с помощью чертежной кнопки проделайте по одному отверстию в каждой отмеченной точке на дне пластиковой чашки.

- Аккуратно вставьте два графитовых (карандашных) штифта в два отверстия, по одному в каждое. Возможно, вам придется сделать отверстия немного больше, чтобы они подходили.
- Используйте клей, чтобы сделать уплотнение вокруг графитовых штифтов на внешней стороне чашки и дайте ему высохнуть. Это должно предотвратить просачивание воды. Убедитесь, что графитовые контакты не все покрыты клеем, иначе они больше не будут контактировать с батареей.
- Поместите вырезанную чашку открытой стороной вниз на батарею. Дно чашки и аккумулятор должны совпадать, образуя ровную поверхность, на которую можно поставить другую чашку.
- Поместите чашку с графитовыми штифтами на перевернутую обрезанную чашку сверху батареи. Он должен сидеть там прочно, и каждый из графитовых штифтов должен касаться одного из полюсов батареи.
- Заклейте один конец обеих соломинок для питья пластилином или пластилином.
Процедура
- Возьмите чашку с графитовыми штифтами и налейте в чашку около 300 миллилитров дистиллированной воды подальше от батареи.
 Убедитесь, что он не протекает. Если это так, вам может понадобиться добавить немного клея, чтобы сделать плотное соединение. Примечание. Не прикасайтесь к воде или электродам после того, как чаша будет помещена на батарею, так как вы можете почувствовать покалывание электричества в пальцах.
Убедитесь, что он не протекает. Если это так, вам может понадобиться добавить немного клея, чтобы сделать плотное соединение. Примечание. Не прикасайтесь к воде или электродам после того, как чаша будет помещена на батарею, так как вы можете почувствовать покалывание электричества в пальцах. - Как и раньше, поместите его на перевернутую обрезанную чашку сверху батареи так, чтобы каждый из графитовых штифтов касался одного из полюсов батареи. Возможно, вам придется немного прижать его, чтобы установить хорошее соединение. Обратите внимание на два графитовых электрода. Что ты видишь? Что-то происходит на электродах?
- Снимите чашу с дистиллированной водой с аккумулятора. Насыпьте одну чайную ложку пищевой соды и размешайте ее в дистиллированной воде, пока все не растворится. Как вы думаете, что изменит пищевая сода? Какую функцию он выполняет?
- Теперь снова поставьте чашку на батарею и соедините графитовые электроды с полюсами батареи.
 Что вы сейчас наблюдаете? На графитовых штифтах ничего не происходит? Как вы думаете, что является продуктом реакции? Сравните реакции, происходящие на каждом из графитовых электродов. Вы видите разницу между обеими сторонами? Есть ли один графитовый электрод, на котором реакция выражена сильнее? К какому полюсу батареи подключен этот графитовый штифт, к положительному или отрицательному?
Что вы сейчас наблюдаете? На графитовых штифтах ничего не происходит? Как вы думаете, что является продуктом реакции? Сравните реакции, происходящие на каждом из графитовых электродов. Вы видите разницу между обеими сторонами? Есть ли один графитовый электрод, на котором реакция выражена сильнее? К какому полюсу батареи подключен этот графитовый штифт, к положительному или отрицательному? - Засуньте нос в чашку и понюхайте продукты реакции. Есть запах? Если да, то как он пахнет?
- Снова снимите чашку с батареи. С помощью пипетки наполните обе закупоренные большие соломинки раствором пищевой соды из чашки с графитовыми штифтами. Когда они наполнятся, закройте каждую одним пальцем и переверните вверх дном. Опустите их в чашку с раствором пищевой соды и осторожно поместите их поверх графитовых штифтов (по одной соломинке на каждую), чтобы соломинки оставались полностью заполненными раствором пищевой соды. Если соломинки не стоят вертикально, вы можете прислонить их к краю чашки.
 Как вы думаете, что будет с соломинкой?
Как вы думаете, что будет с соломинкой? - После того, как соломинки будут помещены поверх графитовых штифтов, поставьте чашку обратно на батарею. Оставьте его там на 10 минут и немного нажмите на чашку, чтобы убедиться, что электроды остаются подключенными и электродные реакции происходят непрерывно в течение всего этого времени. Обратите внимание на огромные соломинки, которые вы надеваете на графитовые булавки. Что происходит с водой, которую вы туда заливаете? Вы замечаете разницу между двумя уровнями воды в обеих соломинках? Какой из них выше, какой ниже; к каким полюсам батареи подключен каждый из них?
- По истечении 10 минут отметьте уровень воды в каждой соломинке несмываемым маркером. Насколько больше воды было вытеснено продуктами реакции на отрицательном полюсе по сравнению с положительным полюсом? Одинаковые, двойные или тройные?
- Дополнительно: Если у вас есть тест-полоски для определения уровня кислотности или щелочности растворов, используйте их для измерения уровня pH в каждой большой соломинке после того, как уровень воды упадет примерно на 50 процентов.
 Осторожно снимите большие соломинки с электродов и сразу же запечатайте каждую из них пальцем, как только вы оторвете ее от электродов. Убедитесь, что вы не потеряли воду, которая находится внутри, окуните тест-полоску pH внутрь. Какой цвет показывает тест-полоска и какое значение рН она представляет? Есть ли разница между растворами в двух соломинках? Чем они отличаются и почему, на ваш взгляд, это так?
Осторожно снимите большие соломинки с электродов и сразу же запечатайте каждую из них пальцем, как только вы оторвете ее от электродов. Убедитесь, что вы не потеряли воду, которая находится внутри, окуните тест-полоску pH внутрь. Какой цвет показывает тест-полоска и какое значение рН она представляет? Есть ли разница между растворами в двух соломинках? Чем они отличаются и почему, на ваш взгляд, это так? - Дополнительно: Повторите эксперимент, но вместо пищевой соды в дистиллированную воду добавьте чайную ложку поваренной соли (хлорида натрия или NaCl) и дайте электролизу поработать пять минут. Изменяются ли электродные реакции? Что можно сказать о запахе продуктов реакции; Вы можете разобрать определенный запах на этот раз? Как вы думаете, почему это так?
- Дополнительно: Замените графитовые электроды металлическими кнопками. Для этого вам может понадобиться свежая чашка. Вставьте кнопки в дно чашки так, чтобы они не касались друг друга, но так, чтобы каждая из них касалась одного из полюсов батареи, как только вы поместите чашку на батарею.
 При использовании кнопок клеевое уплотнение не требуется. Повторите исходную процедуру, но на этот раз добавьте в дистиллированную воду одну чайную ложку поваренной соли. Наблюдайте за электродными реакциями. Что происходит на этот раз? Посмотрите внимательно на контакт, который подключен к положительному полюсу аккумулятора. Вы видите другие продукты реакции, кроме газа? Как вы думаете, что произошло? Как выглядят металлические кнопки после того, как вы их снова вытащите?
При использовании кнопок клеевое уплотнение не требуется. Повторите исходную процедуру, но на этот раз добавьте в дистиллированную воду одну чайную ложку поваренной соли. Наблюдайте за электродными реакциями. Что происходит на этот раз? Посмотрите внимательно на контакт, который подключен к положительному полюсу аккумулятора. Вы видите другие продукты реакции, кроме газа? Как вы думаете, что произошло? Как выглядят металлические кнопки после того, как вы их снова вытащите?
Наблюдения и результаты
Удалось ли вам разделить воду на водород и кислород? Вы видели много пузырьков на обоих графитовых штифтах? Первоначально, когда вы ставили чашку с дистиллированной водой на аккумулятор, вы, вероятно, не видели, что происходит на графитовых электродах. Это связано с тем, что дистиллированная вода не очень хорошо проводит электричество, поэтому электродные реакции отсутствуют или возможны лишь незначительные реакции. Однако, если вы добавите электролиты, такие как пищевая сода, добавленные ионы могут проводить электричество, и вы должны были увидеть пузырьки газа, появляющиеся на обоих графитовых штифтах. С одной стороны, на положительном полюсе образуется кислород, тогда как на отрицательном полюсе образуется водород.
С одной стороны, на положительном полюсе образуется кислород, тогда как на отрицательном полюсе образуется водород.
Присмотревшись, вы могли заметить, что на графитовом электроде, подключенном к отрицательному полюсу батареи, образовалось больше газа, чем на другой стороне. Сбор двух газов с помощью гигантских соломинок, вероятно, продемонстрировал это еще лучше. Через 10 минут уровень воды на отрицательном полюсе должен был быть примерно вдвое меньше, чем на положительном полюсе, а это означает, что вы собрали примерно вдвое больше газообразного водорода по сравнению с кислородом. Разница связана с тем, что на одну молекулу воды приходится два атома водорода на один атом кислорода, как объяснялось выше. Это означает, что для образования одной молекулы кислорода (O2) требуется две молекулы воды (2 ч3О). Однако в то же время из двух молекул воды (2 ч3О) можно получить две молекулы водорода (2 ч3). В то время как на электродах образуются водород и кислород, остаточными продуктами реакции из воды являются протоны (H + на стороне кислорода) и ионов гидроксила (ОН — на стороне водорода). Вы можете визуализировать это, поместив полоску pH в растворы в больших соломинках над каждым электродом. Раствор в соломинке, помещенной поверх электрода отрицательного полюса батареи, должен иметь щелочной pH (7 или выше), тогда как другой раствор должен быть кислым (pH менее 7).
Вы можете визуализировать это, поместив полоску pH в растворы в больших соломинках над каждым электродом. Раствор в соломинке, помещенной поверх электрода отрицательного полюса батареи, должен иметь щелочной pH (7 или выше), тогда как другой раствор должен быть кислым (pH менее 7).
Могут происходить и другие электродные реакции, если в растворе есть ионы, конкурирующие с образованием водорода или кислорода. Возможно, вы заметили, что после того, как вы добавили соль (хлорид натрия) в электролит, он начал пахнуть, как в бассейне. Вместо кислорода на положительном полюсе батареи вырабатывается хлор, который также используется для дезинфекции воды в бассейне. Если вы использовали металлические кнопки в качестве электродов вместо графитовых штифтов, металл (обычно сталь или латунь) будет растворяться или подвергаться коррозии на положительном полюсе батареи, и вместо (или в дополнение) к выделению газа вы должны увидеть, что металлическая кнопка становится красно-коричневой. Это свидетельствует о том, что электролиз — это не только способ расщепления воды на компоненты, но и способ запуска других реакций, которые в противном случае не происходили бы самопроизвольно.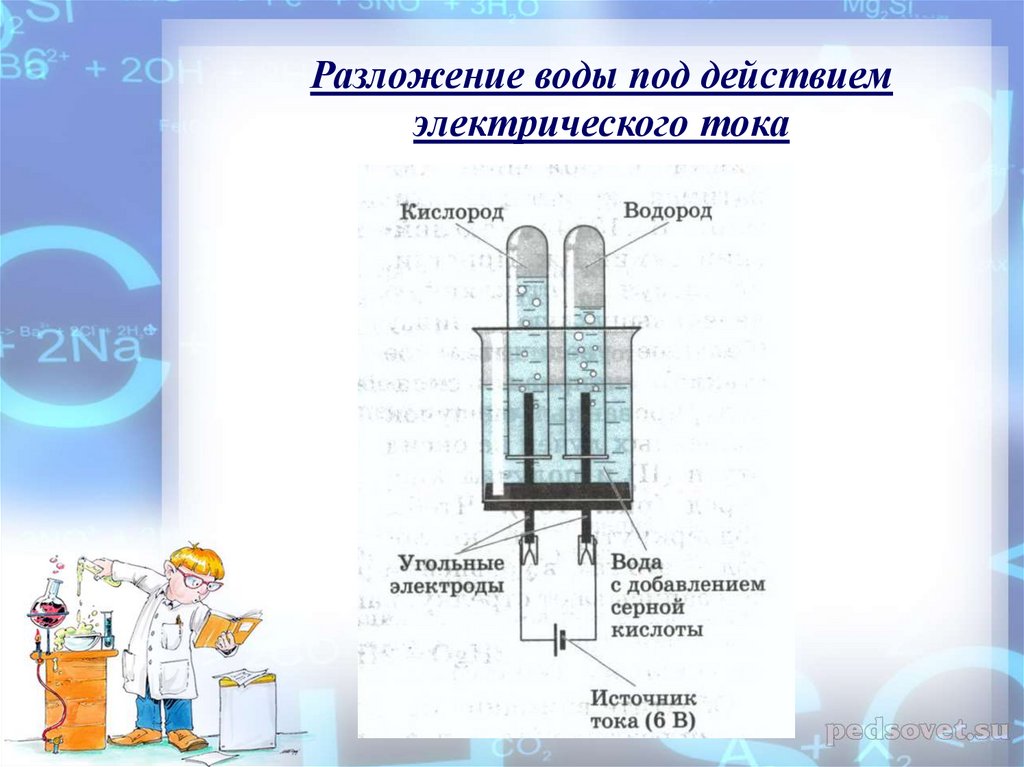
Очистка
Вытрите любые разливы полотенцем. Вылейте воду с электролитом (пищевой содой или солью) в канализацию. Выньте электроды (графитовые штифты или металлические кнопки) из чашек и выбросьте их в мусорное ведро. Выбросьте пластиковые стаканчики и запечатанные большие соломинки в мусорное ведро. Вы можете повторно использовать девятивольтовую батарею.
Еще для изучения
Почему мы не можем производить воду?, из книги «Как это работает»
Химия воды, из книги Джилл Грейнджер
«Электролиз воды — водород и кислород из воды», от «Альтернативное обучение»
«Топливные элементы — заправляя будущее!» от Science Buddies
Научная деятельность для всех возрастов!, от Science Buddies
Это задание было предложено вам в сотрудничестве с Science Buddies
ОБ АВТОРАХ
Новый метод разделения воды для получения чистого водорода
Ингрид Фаделли, Tech Xplore
Фотография исследователей, на которой изображены (слева направо): доктор Хен Дотан, Авигейл Ландман, профессор Авнер Ротшильд, профессор Гидеон Грейдер. Фото: Чен Галили, официальный представитель Техниона.
Фото: Чен Галили, официальный представитель Техниона.Электролитическое производство водорода предполагает получение водорода из воды с использованием электроэнергии, которая в идеале должна поступать из возобновляемых источников энергии, таких как солнечный свет и ветер. Хотя этот метод производства водорода может быть очень многообещающим решением для повышения устойчивости, исследователям придется преодолеть несколько ключевых проблем, чтобы он получил широкое распространение.
В недавнем исследовании, опубликованном в журнале Nature Energy , группа исследователей из Техниона — Израильского технологического института рассмотрела некоторые из этих проблем, представив новый метод расщепления воды, который может усовершенствовать существующие методы производства электролитического водорода. Их исследование черпает вдохновение из одного из их предыдущих исследований фотоэлектрохимического (PEC) расщепления воды, в котором они пытались объединить солнечную энергию и (фото)электролиз воды для получения водорода из солнечного света и воды.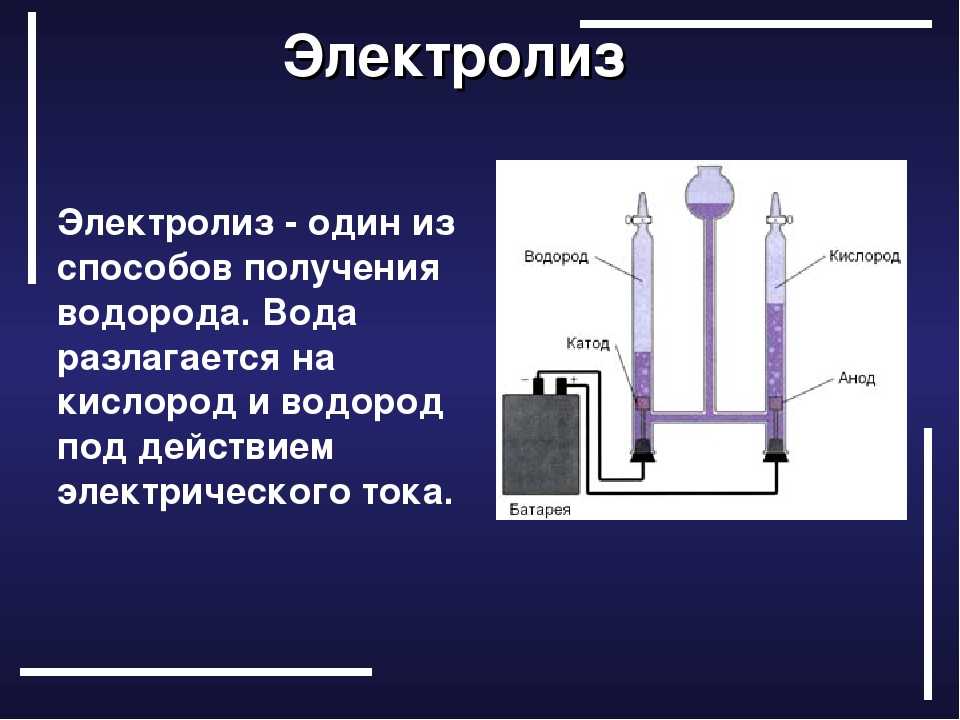
Одной из самых больших проблем, описанных в этой предыдущей работе, был сбор газообразного водорода из миллионов ячеек PEC, распределенных в солнечном поле. В своем исследовании исследователи из Техниона попытались разработать метод, который мог бы эффективно решить эту проблему.
«Взяв фотогальванические (PV) солнечные электростанции в качестве базового сценария, солнечная ферма состоит из миллионов отдельных фотоэлементов, где ток (и напряжение) собирается от каждого из них в металлическую сетку», Авнер Ротшильд, один из исследователей, проводивших исследование, сказал TechXplore. «Это легко с электричеством, но не так с газообразным водородом».
В идеальной солнечной электростанции будущего фотоэлементы должны быть заменены на фотоэлектрические элементы, которые могут производить водород в компоненте, известном как катодное отделение, и кислород в отдельной камере, называемой анодным отделением. Эти два отсека должны быть разделены хотя бы мембраной, чтобы водород и кислород не смешивались, так как это может привести к взрыву.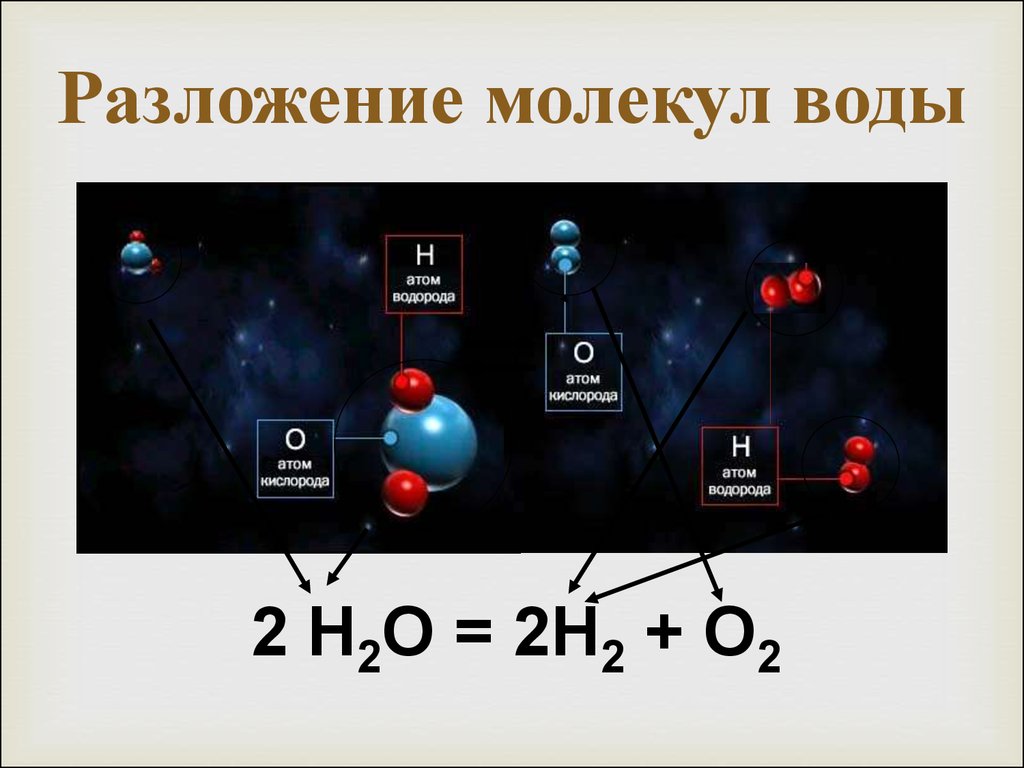 Кроме того, газообразный водород должен собираться из каждой отдельной ячейки.
Кроме того, газообразный водород должен собираться из каждой отдельной ячейки.
Создание этой установки до сих пор оказалось технически сложным и дорогим, так как требует очень дорогого трубопроводного коллектора. В конечном итоге это сделало нереалистичной реализацию решений по крупномасштабному производству водорода путем расщепления воды ПЭК.
«Мы искали выход из этой сложной ситуации и пришли к идее разделения кислородного и водородного отсеков в ячейке PEC на две отдельные ячейки, чтобы кислород вырабатывался в солнечном поле и выбрасывался в атмосферу. , тогда как водород вырабатывается в центральном реакторе в углу поля», — сказал Ротшильд. «Разделение на две ячейки стало возможным благодаря вставке другого набора из двух электродов, называемых вспомогательными электродами, которые заряжаются и разряжаются одновременно с помощью OH 9.0216 — ионы участвуют в реакции расщепления воды, опосредуя тем самым ионный обмен между двумя клетками (что необходимо для замыкания электрической цепи)».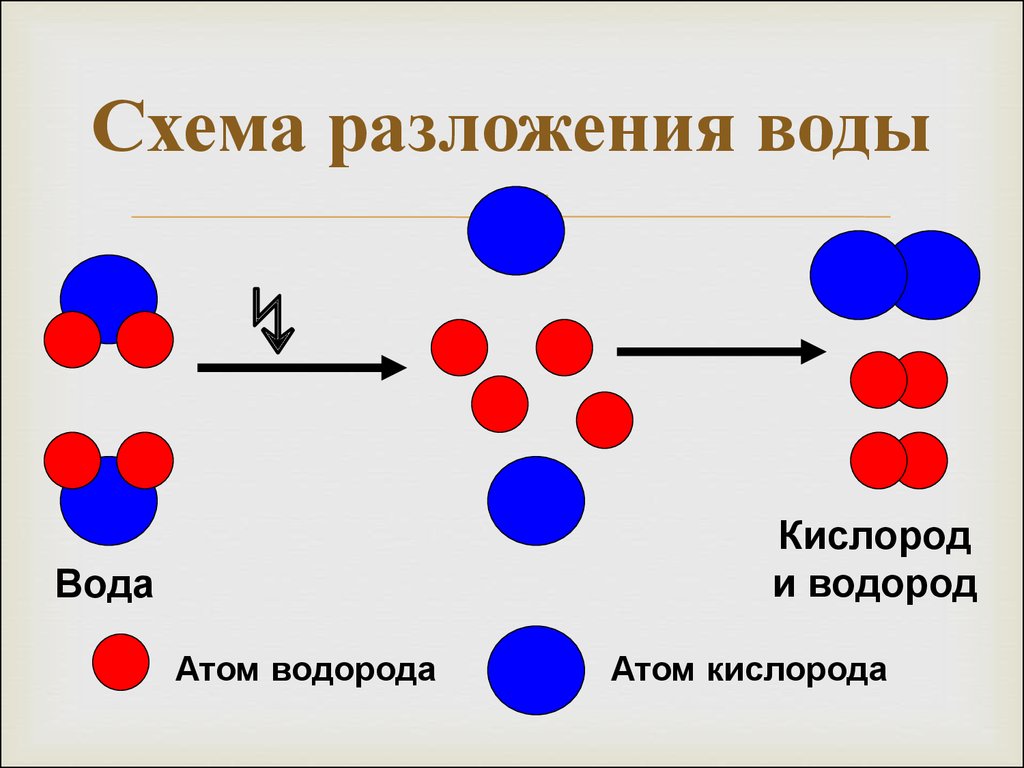
коллеги представили прорывной новый подход к архитектуре электролиза воды (электролизеры) и фотоэлектролиза (PEC).Однако этот многообещающий подход создал еще одну проблему регенерации вспомогательных электродов, когда они насыщаются в конце производственного цикла.Исследователи предположили, что электроды можно было менять местами в конце каждого цикла, но это было бы довольно обременительно, поэтому они продолжали искать альтернативные решения.
«Затем мы обнаружили, что когда вы нагреваете вспомогательный электрод в водородной ячейке, после того как он был заряжен (чтобы стать NiOOH), он самопроизвольно выпускает пузырьки газообразного кислорода и восстанавливается до своего исходного состояния (Ni(OH) 2 ), — сказал Ротшильд. «Это открытие привело к разработке процесса разделения воды E-TAC, который представлен в настоящей работе».
E-TAC, новый метод разделения воды, предложенный Ротшильдом и его коллегами, имеет высокую энергоэффективность 98,7 процента, следовательно, он значительно превосходит обычные электролизеры, которые обычно имеют энергоэффективность от ~ 70 до 80 процентов для современных устройств. Еще одним преимуществом E-TAC является то, что он производит водород и кислород последовательно, в то время как в большинстве других электролизеров они производятся одновременно. В конечном итоге это устраняет необходимость в мембране, разделяющей газообразные водород и кислород, что значительно упрощает конструкцию и сборку элементов, а также их эксплуатацию и техническое обслуживание.
Еще одним преимуществом E-TAC является то, что он производит водород и кислород последовательно, в то время как в большинстве других электролизеров они производятся одновременно. В конечном итоге это устраняет необходимость в мембране, разделяющей газообразные водород и кислород, что значительно упрощает конструкцию и сборку элементов, а также их эксплуатацию и техническое обслуживание.
«Потенциально это может привести к значительной экономии капитальных и эксплуатационных затрат, что приведет к разработке экономичной технологии разделения воды, которая может конкурировать с SMR (паровой конверсией метана), предлагая дешевый водород без выбросов CO 2 , при условии, что электричество поступает из возобновляемых источников, таких как гидроэнергетика, солнечная энергия или энергия ветра», — сказал Ротшильд.
При обычном электролизе воды водород и кислород всегда образуются одновременно в катодном и анодном отделениях соответственно. Отсеки расположены как можно ближе друг к другу, чтобы свести к минимуму электрические омические потери, и разделены мембраной во избежание создания взрывоопасной среды H 2 /O 2 смесь.
«Катод восстанавливает воду, генерируя водород (молекулы H 2 ) и ионы гидроксида (OH — ) посредством реакции, известной как HER (реакция выделения водорода)», — сказал Ротшильд. «Ионы ОН — мигрируют к аноду через электролит и через мембрану, где они окисляются посредством ОВР (реакции выделения кислорода). Вместе эти две реакции (ГВР и ОВР) завершают реакцию расщепления воды: 2Н 2 O 2H 2 + O 2 .»
При обычном электролизе воды две электрохимические реакции, описанные Ротшильдом, связаны как во времени, так и в пространстве, поскольку они происходят одновременно, в одной и той же ячейке и в непосредственной близости. , Более того, эти характеристики одинаковы независимо от того, применяется ли процесс к щелочным электролизерам или электролизерам с ПОМ.
Изображение, показывающее разницу между традиционным подходом к расщеплению воды (щелочной электролиз) и методом разделения воды E-TAC, предложенным исследователями. Кредит: Дотан и др.
Кредит: Дотан и др.
В отличие от этого традиционного подхода к электролизу воды, процесс разделения воды, разработанный исследователями, разделяет реакции HER и OER, которые вместо этого происходят в разное время и потенциально в разных частях устройства. Таким образом, вместо того, чтобы быть непрерывным, E-TAC можно описать как «периодический процесс» с двумя циклами, первый из которых генерирует водород электрохимически, а второй — кислород посредством спонтанной химической реакции.
«Мы помещаем катод (тот же самый катод, который используется в щелочном электролизе) и анод (который отличается от анода в обычном электролизе) в электролитическую ячейку и пропускаем ток между ними», — сказал Ротшильд. «Катод вырабатывает водород посредством реакции HER, точно так же, как это происходит в случае обычного электролиза воды, но анод делает совершенно другое. Анод, по сути, заряжается, поглощая OH — ионы, которые образуются на катоде и постепенно превращаются из Ni(OH) 2 (гидроксид никеля) в NiOOH (оксигидроксид никеля). на катод щелочных батарей (например, Ni-MH батарей) во время их зарядки Это говорит о том, что он может хорошо работать в течение многих циклов, как и в щелочных батареях
на катод щелочных батарей (например, Ni-MH батарей) во время их зарядки Это говорит о том, что он может хорошо работать в течение многих циклов, как и в щелочных батареях
Однако иногда зарядка анода в Процесс E-TAC необходимо прервать, потому что, если он будет перезаряжен, он может начать генерировать кислород.Поэтому, когда заряд превышает определенный уровень, исследователям необходимо ограничить напряжение, подаваемое на клетки, чтобы избежать возможных взрывов, вызванных когенерация кислорода и водорода
«Чтобы продолжить процесс E-TAC, нам необходимо регенерировать заряженный анод (NiOOH) обратно в исходное состояние (Ni(OH) 2 )», — объяснил Ротшильд. «Мы делаем это, повышая его температуру, тем самым увеличивая скорость спонтанной химической реакции между заряженным анодом и водой, которая высвобождает кислород и регенерирует анод обратно в исходное состояние».
Техника, разработанная Ротшильдом и его коллегами, предполагает использование тепла для управления химической реакцией, в результате которой образуется кислород, поскольку скорость реакции замедляется при низких температурах и увеличивается при высоких температурах. Генерация водорода происходит при низкой температуре или температуре окружающей среды, а генерация кислорода при высоких температурах около 95 градусов Цельсия. Вот почему исследователи решили назвать его процессом E-TAC, что означает электрохимически-термически активированный химический процесс.
Генерация водорода происходит при низкой температуре или температуре окружающей среды, а генерация кислорода при высоких температурах около 95 градусов Цельсия. Вот почему исследователи решили назвать его процессом E-TAC, что означает электрохимически-термически активированный химический процесс.
«В лабораторных испытаниях для проверки концепции, представленных в нашей статье, мы вручную перемещали анод из холодной камеры (т. е. стеклянного стакана, наполненного щелочным водным раствором при температуре окружающей среды) в горячую камеру (т. химический стакан, но нагретый до 95 градусов по Цельсию), так что разделение между генерацией водорода и кислорода было не только вовремя, но и на месте», — пояснил Ротшильд. «Однако в реальной промышленной системе мы предвидим другой сценарий, при котором два электрода (анод и катод) и неподвижны (не движутся), тогда как ячейка, в которой они находятся, последовательно заполняется холодными или горячими растворами электролита. »
Разделение производства водорода и кислорода, которое устраняет необходимость в мембране, разделяющей две разные камеры внутри электролитических ячеек, приводит к существенной экономии по сравнению с традиционными методами электролиза.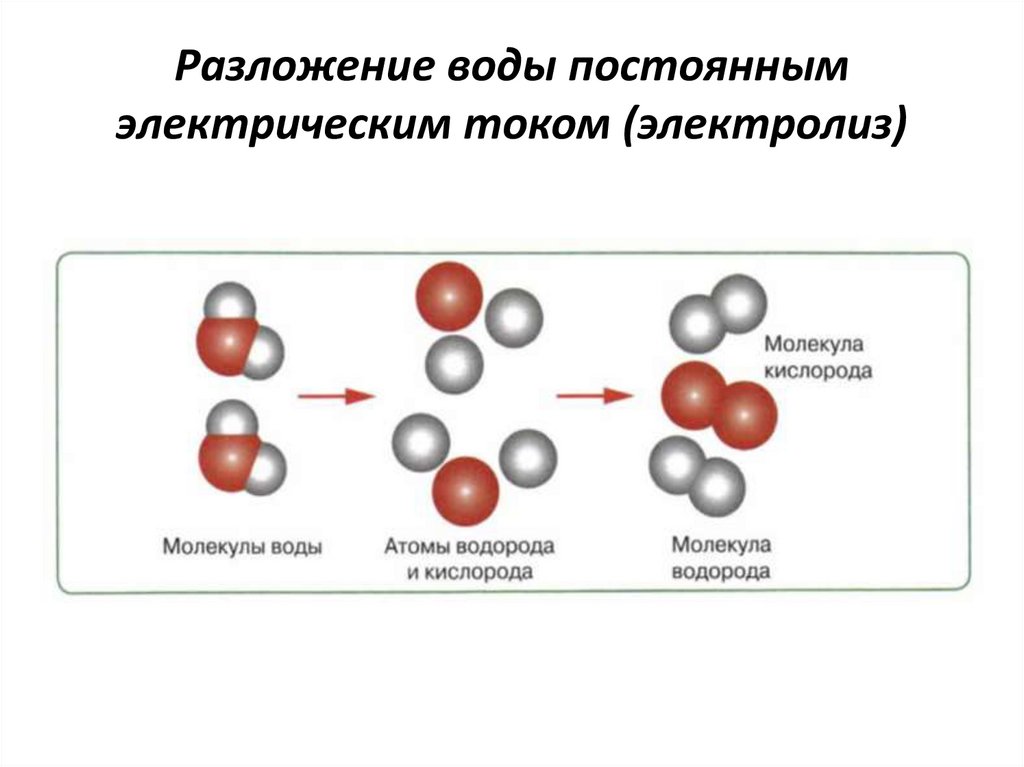 На самом деле герметизация мембраны, как правило, является дорогостоящей, а также усложняет общий производственный процесс. Мембрана в обычных системах требует воды высокой чистоты и постоянного обслуживания, в которых нет необходимости в E-TAC.
На самом деле герметизация мембраны, как правило, является дорогостоящей, а также усложняет общий производственный процесс. Мембрана в обычных системах требует воды высокой чистоты и постоянного обслуживания, в которых нет необходимости в E-TAC.
Кроме того, метод, разработанный Ротшильдом и его коллегами, полностью исключает риск летучих столкновений между кислородом и водородом, а также последующих взрывов. С другой стороны, в традиционных системах этот риск все еще присутствует, поскольку мембрана может порваться или ее уплотнение может сломаться.
«В настоящее время использование мембран также ограничивает давление при производстве водорода», — сказал Ротшильд. «E-TAC делает мембрану ненужной, что облегчает производство водорода при гораздо более высоком давлении и устраняет некоторые из высоких затрат на позднее сжатие водорода. Более того, в новом предложенном нами процессе кислород производится в результате самопроизвольной химической реакции между заряженными анод и вода, без использования электрического тока. Эта реакция устраняет потребность в электричестве при производстве кислорода и повышает энергетическую эффективность с ~70 до 80 процентов при использовании обычных методов до беспрецедентного 98,7 процента».
Эта реакция устраняет потребность в электричестве при производстве кислорода и повышает энергетическую эффективность с ~70 до 80 процентов при использовании обычных методов до беспрецедентного 98,7 процента».
Техника, разработанная Ротшильдом и его коллегами, может снизить эксплуатационные расходы на устойчивое производство водорода и затраты на оборудование. Исследователи подсчитали, что затраты на производство оборудования на основе E-TAC составят примерно половину затрат на существующие технологии.
«Изобретенный нами процесс представляет собой концептуальный прорыв в разделении воды, и, учитывая преимущества, которые он предлагает, он может изменить правила игры и привести к новой технологии производства водорода из воды без CO 2 выбросов, которые могли бы конкурировать с SMR в производстве чистого водорода и обеспечить переход от ископаемого топлива к чистому водородному топливу», — сказал Ротшильд. под названием H 2 Pro, с миссией разработки и распространения новой технологии разделения воды на основе метода E-TAC Они надеются вскоре коммерциализировать эту технологию, увеличивая электроды и ячейки, используемые в их исследованиях, конструировании и испытания генераторов водорода на основе процесса разделения воды E-TAC, оптимизация схемы их работы и исследование производства водорода под высоким давлением.
«Мы также планируем провести дальнейшие академические исследования для изучения новых электродных материалов и применения передовых аналитических методов для понимания корреляции между составом электрода и микроструктурой и его функциональными свойствами, чтобы разработать следующее поколение Ni(OH) 2 Электроды на основе для нашего процесса разделения воды E-TAC», — сказал Ротшильд. «Наша цель — повысить их производительность (чтобы мы могли запускать более длительные процессы) за счет быстрой зарядки и регенерации, чтобы обеспечить высокую скорость производства водорода».
Узнайте больше
Исследователи совершили прорыв в процессе производства водородного топлива
Дополнительная информация: Разделение выделения водорода и кислорода с помощью двухэтапного электрохимико-химического цикла для эффективного общего разделения воды.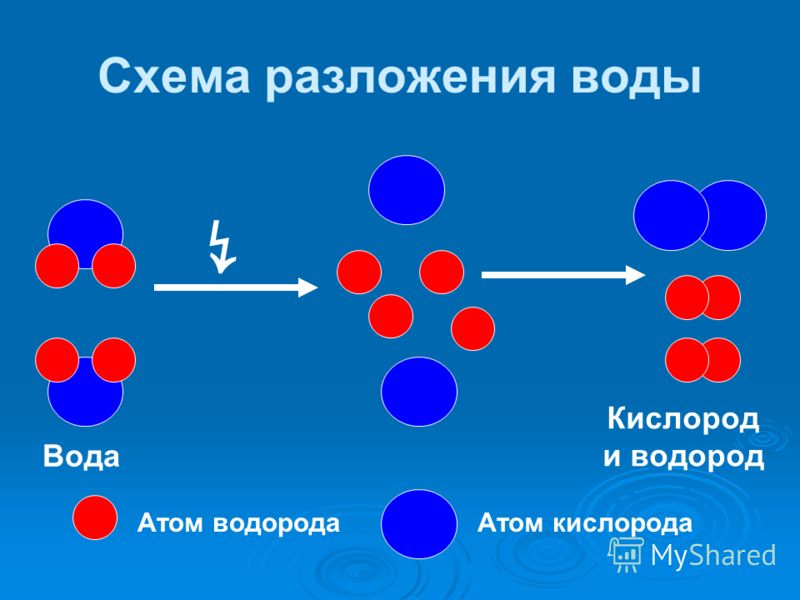 Nature Energy , DOI: 10.1038/s41560-019-0462-7
Nature Energy , DOI: 10.1038/s41560-019-0462-7
Avigail Landman et al. Фотоэлектрохимическое разделение воды в отдельных кислородных и водородных ячейках, Nature Materials (2017). DOI: 10.1038/nmat4876
Информация журнала: Природные материалы , Энергия природы
© 2019 Наука Х Сеть
Цитата : Новый метод разделения воды для получения чистого водорода (2 октября 2019 г.) получено 14 октября 2022 г. с https://techxplore.com/news/2019-09-water-splitting-technique-hydrogen.html
Этот документ защищен авторским правом. Помимо любой добросовестной сделки с целью частного изучения или исследования, никакие
часть может быть воспроизведена без письменного разрешения.
