- Гремучий газ — польза или вред? Состав, формула расчета, использование
- Safety First — https://www.hydrogen-severs.com
- Гремучий газ формула химическая
- Взрывоопасный газ Определение | Law Insider
- Объяснение НПВ и НПВ (взрывоопасный газ)
- Пределы концентрации взрывоопасности и воспламеняемости
Гремучий газ — польза или вред? Состав, формула расчета, использование
В начале изучения такого предмета, как химия, самое интересное — это проводить опыты, а если эти опыты еще и сопровождаются небольшим эффектным взрывом, то восторг вообще сложно сдержать. При слове «взрыв» возникают разные ассоциации, и одна из них — гремучий газ. Какая у него формула, где он применяется и, конечно же, правила безопасности при работе с ним — главные вопросы статьи.
Состав
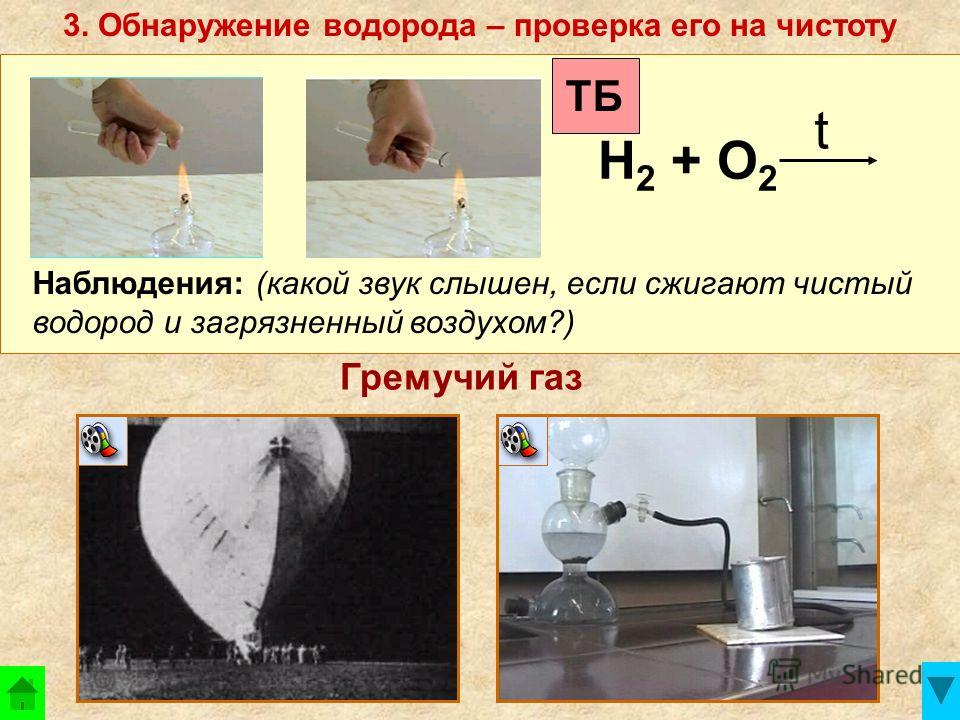
На самом деле в составе содержится водород, смешанный с кислородом. В определенной пропорции 1 : 2 они и образуют гремучий газ. Формула его будет выглядеть так: 2H2+O2.
Достаточно малейшей искры с энергией 14 мДж или нагревания до 510 °C (температура горения спички более 700 °C), чтобы пошла между ними реакция, которая сопровождается выделением большого количества энергии и взрывом.
А результатом такой реакции является обычная вода. Не зря же назван газ водородом, то есть рождающий воду. Но стоит ввести в смесь, например, губчатую платину, и взрыва не произойдет, а будет идти обычный процесс горения.
Но стоит ввести в смесь, например, губчатую платину, и взрыва не произойдет, а будет идти обычный процесс горения.
Еще одно название газовой смеси — газ Брауна, название свое получил в честь изобретателя, который разработал автомобиль, работающий на продуктах разложения воды путем электролиза. И выглядит формула газа в химии так: HHO.
История открытия
О том, что во время химической реакции между кислотами и некоторыми металлами образуется газ, который очень горюч, упоминается в трактатах 16 века. Его так и называли «горючий воздух». А вот собрать его в чистом виде, изучить свойства и описать их удалось лишь во второй половине 18 века. Так, химик А. Лавуазье, проводя опыты в 1784 году, сделал вывод, что газ является простым веществом, состоящим только из атомов одного вида.
А известному химику и физику Г. Кавендишу опытным путем удалось определить, что кислород + водород в результате моментального сгорания дает воду. Кстати, одна из лабораторий Кембриджа названа в его честь именно за то, что он смог определить качественный состав воды. Латинское название водорода Hydrogenium происходит от двух слов «гидро» — вода и «геннао» — рождение, то есть в нем (как и в русском варианте названия элемента) описывается главное его свойство — рождать воду.
Латинское название водорода Hydrogenium происходит от двух слов «гидро» — вода и «геннао» — рождение, то есть в нем (как и в русском варианте названия элемента) описывается главное его свойство — рождать воду.
Применение
Где используется?
Интерес к такому альтернативному виду топлива, как водород проявляется все больше. Но первым разработчиком, который представил автомобиль, работающий на таком топливе, был концерн Toyota. Однако его внедорожник FCHV так и остался выставочным экземпляром, серийно его выпускать не стали. Интерес к водородным двигателям не пропал, поэтому многие производители продолжают вкладывать большие деньги на внедрение такого движка.
Гремучий газ, точнее, водород с подачей кислорода, используется для сварки и пайки металлов в сложных условиях, таких как тоннели и шахты, коллекторы и монтажные колодцы, когда места для размещения баллонов с углеводородами просто нет. Температура горения смеси равна примерно 2235 °C, а продукты горения абсолютно безопасны для здоровья человека. Нашла свое применение водородная горелка в ювелирном и зубопротезном деле, ей обрабатывают стеклянные изделия, пластины из дорогих металлов разной толщины и другое.
Нашла свое применение водородная горелка в ювелирном и зубопротезном деле, ей обрабатывают стеклянные изделия, пластины из дорогих металлов разной толщины и другое.
Враг шахтеров
Иногда термин «гремучий газ» ошибочно используют в отношении метана. Способность этого углеводорода скапливаться в пустотах горных пород и при смешивании с воздухом становится взрывоопасной, она схожа со смесью настоящего газа, но на этом их схожесть и заканчивается. Формула газа в химии выглядит так: CH4.
Самая опасная концентрация в атмосфере метана составляет 9,5 %, но при разных условиях может варьировать от 5 до 16 %. При большей концентрации газ будет просто гореть. Спровоцировать взрыв может как искра, так и открытый огонь. Чтобы контролировать концентрацию метана в воздухе, шахтеры брали с собой канарейку, и знали, пока слышится песня маленького друга, работать можно спокойно. Но стоило птичке замолчать, это означало, что беда близко.
В начале 19 века певунов заменила шахтерская лампа Дэви, а сегодня контроль осуществляет автоматическая система, но и это не делает работу шахтеров полностью безопасной. Взрывы иногда случаются и сейчас. Вот такой он страшный — «рудничный газ».
Взрывы иногда случаются и сейчас. Вот такой он страшный — «рудничный газ».
Нажива для нечестных
Сколько счастья приносят воздушные шары, наполненные гелием. Мало есть детей, способных устоять перед разноцветным чудом. Да и праздники сейчас не обходятся без гелиевых шаров, которые тут же взмывают вверх, стоит на секунду отпустить нитку из рук.
Сегодня баллон гелия стоит приличных денег, а некоторые нерадивые продавцы решают сэкономить. Ведь заставить шарик летать может не только гелий, водород. Ацетилен тоже легче воздуха. Но так ли безопасна такая экономия для самих клиентов?
В последнее время все чаще слышатся новости о взрывах воздушных шаров:
- май, 2012 — Ереван;
- октябрь, 2017 — Кузбасс;
- октябрь, 2017 года — Кемерово.
Это лишь три известных случая, в одном из них, а именно на митинге в Ереване, шары были наполнены водородом, который мог выходить наружу и скапливаться в воздухе, смешиваясь с кислородом. А мы знаем, что такая смесь в определенной пропорции называется гремучим газом. В этой трагедии пострадали люди.
В этой трагедии пострадали люди.
Safety First — https://www.hydrogen-severs.com
Практические советы, техника безопасности, вопросы — ответы
Что такое гремучий газ?
Как правильно работать с водородной газовой горелкой,
при этом не допускать обратные хлопки гремучего газа?
Советы по использованию посуды для приготовления или хранения щелочных растворов.
При работе со щелочами не используйте алюминиевую и оцинкованную посуду или емкости из пластика ПЭТ! Алюминий и цинк бурно реагируют со щелочами. Реакция вызывает распад металлов с
выделением тепла. Пластик ПЭТ на первый взгляд может показаться абсолютно инертным по отношению к щелочам, но это не так. Реакция пластика ПЭТ на щелочи непредсказуема и проявляется хаотично. Как
правило ёмкость, в которой находится щелочной раствор, может треснуть, как каленое стекло, а щелочной раствор, хранящийся в ней, окажется на полу. Чаще всего это происходит в местах
утолщения стенок ёмкостей в нижней, донной части посуды.
На фото ниже показана трещина, появившаяся на дне пятилитровой канистры сделанной из пластика ПЭТ. Трещина появилась от воздействия щелочного раствора с очень низкой концентрацией. Конечно же весь щелочной раствор остался на полу.
Совет по применению щелочей для электролиза.
Для приготовления электролита можно использовать щелочи типа гидроксид натрия, химическая формула NaOH (каустическая сода, каустик, едкий натр) или гидроксид калия, химическая формула KOH (каустический поташ, калиевый щелок, едкий калий)
Внимание!
Гидроксид натрия NaOH и гидроксид калия KOH при приготовлении электролитов могут быть взаимозаменяемыми веществами, но смешивание щелочей между собой в любых пропорциях недопустимо, это чревато интенсивным вспениванием электролита.
При смене применяемых видов щелочей на другой вид обязательно промывайте заправочные емкости и электролизеры слабым раствором кислотосодержащих веществ (уксус,
лимонная кислота, и другие слабоконцентрированные виды кислот) Это необходимо для полной нейтрализации ранее использованной щелочи.
ВАЖНО ЗНАТЬ!
В процессе приготовления электролита и растворения щелочей в воде, во избежание получения опасных химических ожогов — постепенно сыпьте щелочь в большое количество воды и никогда не лейте воду в большое количество сухой щелочи, это опасно
Техника безопасности при работе с щелочными растворами (электролитами)
Щелочь является едким веществом, при контакте с кожным покровом человека способна вызвать серьезные ожоги и поражения. При приеме вовнутрь вызывает
фатальные поражения внутренних органов, возможен летальный исход. Кроме того, щелочи способны спровоцировать возникновение сильных очагов коррозии металлов, распада лакокрасочного покрытия и
полного уничтожения любых органических веществ. При работе со щелочами используйте защитные очки и резиновые перчатки. В случае попадания щелочи на кожу , для ее
нейтрализации , используйте водные растворы уксуса или лимонной кислоты. Стоит помнить, что остатки щелочи на руках гораздо легче смыть теплой или горячей
водой.
При работе со щелочами используйте защитные очки и резиновые перчатки. В случае попадания щелочи на кожу , для ее
нейтрализации , используйте водные растворы уксуса или лимонной кислоты. Стоит помнить, что остатки щелочи на руках гораздо легче смыть теплой или горячей
водой.
Химические ожоги считаются наиболее опасными, так как некоторые вещества могут впитаться в глаз уже в течение 15 секунд. Такие ожоги вызываются щелочами и кислотами.
- Если кислота или щелочь попали в глаз, нужно немедленно начать его промывание под проточной водой (над фонтанчиком, под краном, из чайника или из чашки и т. п.). При этом веки должны быть максимально открыты. Общее время промывания должно составлять 30 минут.
- Если у вас под рукой оказалась аптечка, то лучше промывать глаз специально приготовленным раствором. Для нейтрализации кислот это 2% раствор соды,
для нейтрализации щелочей 2% раствор борной кислоты (или 1% раствор уксусной кислоты).
 Такие растворы получаются при разведении 1 ст. л. соды (порошка борной кислоты) или 100 мл (треть
стакана) 9% уксуса на 1 литр теплой кипяченой воды и подаются под давлением при помощи груши или шприца без иглы. Если веки невозможно открыть широко, надеть на шприц тонкую трубку и заводить
ее под веки с наружного угла глаза.
Такие растворы получаются при разведении 1 ст. л. соды (порошка борной кислоты) или 100 мл (треть
стакана) 9% уксуса на 1 литр теплой кипяченой воды и подаются под давлением при помощи груши или шприца без иглы. Если веки невозможно открыть широко, надеть на шприц тонкую трубку и заводить
ее под веки с наружного угла глаза. - После промывания и обработки глаз обязательно обратитесь к врачу или в травматологический пункт!
При попадании щелочного раствора на одежду из хлопка, шерсти или льна в кротчайшее время необходимо снять одежду, замочить или обработать место контакта со щелочами водным раствором уксуса или лимонной кислоты. Если не остановить действие щелочи вовремя, на одежде останутся пятна выеденной краски, а в некоторых случаях возможно повреждение ткани и появление дыр.
Совет по использованию воды для приготовления электролитов.
Для приготовления электролитов используйте воду только с высокой степенью очистки.
Внимание!
При приготовлении электролитов или добавления воды в электролизер , категорически воспрещено использование обычной водопроводной воды, даже если она кипяченая. Недопустимо использование очищенной воды, предназначенной для питья или приготовления пищи, такая вода содержит минеральные и биологические включения, которые способны в значительной степени навредить электролизеру и снизить эффективность его работы. Подробно о выборе воды и её проверке на пригодность смотрите видео.
Видео 16+
Совет по режимам эксплуатационных температур для электролитов.
Электролиты, применяемые в электролизе, служат основой для проведения электрического тока между контактными электродами электролизера с нужной силой. Уровень силы тока определяется путем
изменения концентрации щелочи в воде, а также сила электрического тока может изменяться в зависимости от температуры электролита.
Осторожно! Огнеопасно, Взрывоопасно!
Электролизные газогенераторы, в классическом исполнении производят гремучий газ, то есть смесь водорода с кислородом, в пропорции
2:1. Смесь в таких пропорциях является идеальной для полного сгорания водорода. Горение водорода в среде чистого кислорода превращается в фактический взрыв, так как скорость горения
водорода при таких условиях составляет не менее 20 метров в секунду.
Огнепреградительный клапан (Flashback Arrestor)
Для предотвращения возможного появления реверсивного горения (обратного хлопка) гремучего газа, используйте огнепреградительный клапан (англ. Flashback
Arrestor) Такие клапаны используются при проведении работ с классическим газосварочным оборудованием, работающим с использованием баллона с кислородом в паре с баллоном пропана или
ацетиленовым генератором. Огнепреградительный клапан останавливает распространение фронта пламени в газовом трубопроводе и позволяет более безопасно использовать водородный газогенератор. При
работе с водородным газогенерирующим оборудованием используйте обычные огнепреградительные клапаны, предназначенные для работы с пропаном или ацетиленом. Клапан необходимо установить в
разрез рукава подачи газа и как можно дальше от газогенератора.
У Вас есть дополнительные вопросы?
Пожалуйста используйте форму обратной связи с нами.
или напишите на [email protected]
Гремучий газ формула химическая
Содержание
- Содержание
- Получение [ править | править код ]
- Применение [ править | править код ]
- Кинетическая схема горения водорода [ править | править код ]
- Критические явления при воспламенении [ править | править код ]
- Спорные теории [ править | править код ]
- Немного теории
- Целесообразность получения газа Брауна
- Как получить водород в домашних условиях?
- Заключение
Водород считается одним из наиболее перспективных топлив как эффективный и экологически чистый энергоноситель. С практической точки зрения горение водорода связано с его использованием в энергетических установках и топливных элементах и безопасностью соответствующих технологических процессов и устройств [1] . Удельная теплота сгорания водорода составляет примерно 140 МДж/кг (верхняя) или 120 МДж/кг (нижняя), что в несколько раз превышает удельную теплоту сгорания углеводородных топлив (для метана — около 50 МДж/кг).
С практической точки зрения горение водорода связано с его использованием в энергетических установках и топливных элементах и безопасностью соответствующих технологических процессов и устройств [1] . Удельная теплота сгорания водорода составляет примерно 140 МДж/кг (верхняя) или 120 МДж/кг (нижняя), что в несколько раз превышает удельную теплоту сгорания углеводородных топлив (для метана — около 50 МДж/кг).
Смеси водорода с кислородом или воздухом взрывоопасны и называются гремучим газом (название происходит от knallgas, нем. knall — громкий хлопок, резкий звук выстрела или взрыва). При зажигании искрой или другим источником смесь водорода с воздухом небольшого объёма сгорает чрезвычайно быстро, с громким хлопком, что субъективно воспринимается как взрыв. В физике горения такой процесс считается медленным горением, или дефлаграцией, однако гремучий газ способен и к детонации, при этом действие взрыва оказывается существенно более сильным.
Наиболее опасны околостехиометрические смеси, где на один моль кислорода приходится два моля водорода, то есть, с учётом того, что в воздухе соотношение кислорода и азота по объёму составляет примерно 1:3,76, объёмное соотношение водорода с воздухом в гремучем газе в стехиометрическом соотношении составляет 2:4,76 ≈ 0,4. Однако гремучий газ способен гореть в широком диапазоне концентраций водорода, от 4 — 9 объёмных процентов в бедных смесях до 75% в богатых смесях, приблизительно в этих же пределах он способен и детонировать [2] .
Однако гремучий газ способен гореть в широком диапазоне концентраций водорода, от 4 — 9 объёмных процентов в бедных смесях до 75% в богатых смесях, приблизительно в этих же пределах он способен и детонировать [2] .
Гремучий газ самовоспламеняется при атмосферном давлении и температуре 510 °C. При комнатной температуре в отсутствие источников зажигания (искра, открытое пламя) гремучий газ может храниться неограниченно долго, однако он способен взорваться от самого слабого источника, так как для инициирования взрыва достаточно искры с энергией 17 микроджоулей [3] . С учётом того, что водород обладает способностью проникать через стенки сосудов, в которых он хранится, например, диффундировать сквозь металлические стенки газового баллона, и не обладает никаким запахом, при работе с ним следует быть чрезвычайно осторожным.
Содержание
Получение [ править | править код ]
В 1766 г. водород получил Генри Кавендиш в реакции металла с кислотой: Fe + H2SO4 → FeSO4 + H2 (газ). В лабораторных условиях гремучий газ можно получить электролизом воды в реакции H2O → H2 + 0,5 O2.
В лабораторных условиях гремучий газ можно получить электролизом воды в реакции H2O → H2 + 0,5 O2.
Применение [ править | править код ]
В XIX веке для освещения в театрах использовался так называемый друммондов свет, где свечение получалось с помощью пламени кислород-водородной смеси, направленного непосредственно на цилиндр из негашёной извести, которая может нагреваться до высоких температур (белого каления) без расплавления. В пламени кислород-водородной смеси достигается высокая температура, и также в XIX веке это нашло применение в паяльных лампах для плавления тугоплавких материалов, резки и сварки металлов. Однако все эти попытки применения гремучего газа были ограничены тем, что он очень опасен в обращении, и были найдены более безопасные варианты решения этих задач.
В настоящее время водород считается перспективным топливом для водородной энергетики. При горении водорода образуется чистая вода, поэтому этот процесс считается экологически чистым. Основные проблемы связаны с тем, что затраты на производство, хранение и транспортировку водорода к месту его непосредственного применения слишком высоки, и при учёте всей совокупности факторов водород пока не может конкурировать с традиционными углеводородными топливами.
Основные проблемы связаны с тем, что затраты на производство, хранение и транспортировку водорода к месту его непосредственного применения слишком высоки, и при учёте всей совокупности факторов водород пока не может конкурировать с традиционными углеводородными топливами.
Кинетическая схема горения водорода [ править | править код ]
Горение водорода формально выражается глобальной реакцией H2 + 0,5 O2 → H2O. Однако эта глобальная реакция не позволяет описать разветвлённые цепные реакции, протекающие в смесях водорода с кислородом или воздухом. В реакциях участвуют восемь компонентов: H2, O2, H, O, OH, HO2, H2O, H2O2. Подробная кинетическая схема химических реакций между этими молекулами и атомами включает более 20 элементарных реакций с участием свободных радикалов в реагирующей смеси. При наличии в системе соединений азота или углерода число компонентов и элементарных реакций существенно увеличивается.
В силу того, что механизм горения водорода является одним из наиболее простых по сравнению с прочими газообразными топливами, такими как синтез-газ или углеводородные топлива, а кинетические схемы горения углеводородных топлив включают в себя все компоненты и элементарные реакции из механизма горения водорода, он изучается чрезвычайно интенсивно многими группами исследователей [4] [5] [6] . Однако, несмотря на более чем столетнюю историю исследований, этот механизм до сих пор изучен не полностью.
Критические явления при воспламенении [ править | править код ]
При комнатной температуре стехиометрическая смесь водорода и кислорода может храниться в закрытом сосуде неограниченно долго. Однако при повышении температуры сосуда выше некоторого критического значения, зависящего от давления, смесь воспламеняется и сгорает чрезвычайно быстро, со вспышкой или взрывом. Это явление нашло своё объяснение в теории цепных реакций, за которую Н. Н. Семёнов и Сирил Хиншелвуд были удостоены Нобелевской премии по химии 1956 года.
Кривая зависимости между критическими давлением и температурой, при которых происходит самовоспламенение смеси, имеет характерную Z-образную форму, как показано на рисунке. Нижняя, средняя и верхняя ветви этой кривой называются соответственно первым, вторым и третьим пределами воспламенения. Если рассматриваются только первые два предела, то кривая имеет форму полуострова, и традиционно этот рисунок называется полуостровом воспламенения.
Спорные теории [ править | править код ]
В 1960-е года американский инженер Уильям Роудс (William Rhodes) якобы открыл «новую форму» воды, коммерциализированную Юллом Брауном (Yull Brown), болгарским физиком, эмигрировавшим в Австралию. «Брауновский газ», то есть фактически смесь кислорода и водорода, получаемая в аппарате электролиза воды, объявлялся способным очищать радиоактивные отходы, гореть как топливо, расслаблять мышцы и стимулировать проращивание семян [8] . Впоследствии итальянский физик Руджеро Сантилли (en:Ruggero Santilli) выдвинул гипотезу, утверждающую существование новой формы воды в виде «газа HHO», то есть химической структуры вида (H × H — O), где «×» представляет гипотетическую магнекулярную связь, а «—» — обычную ковалентную связь. Статья Сантилли, опубликованная в авторитетном реферируемом журнале International Journal of Hydrogen Energy [9] , вызвала жёсткую критику со стороны коллег, назвавших утверждения Сантилли псевдонаучными [10] , однако некоторые другие учёные выступили в поддержку Сантилли [11] [12] .
Статья Сантилли, опубликованная в авторитетном реферируемом журнале International Journal of Hydrogen Energy [9] , вызвала жёсткую критику со стороны коллег, назвавших утверждения Сантилли псевдонаучными [10] , однако некоторые другие учёные выступили в поддержку Сантилли [11] [12] .
Уйти от сжигания ископаемых углеводородов и получить дешевый альтернативный источник энергии – было и остается мечтой многих предприимчивых людей. Да и кто из домовладельцев не хотел бы получить подобный источник в свое распоряжение, чтобы с минимальными затратами обогревать свое жилище? Один из таких источников – так называемый газ Брауна, получаемый из обыкновенной воды. Но как его добыть и насколько он дешев – вопросы, ответы на которые можно найти в данном материале.
Немного теории
Необходимо отметить, что резонансное разложение воды в газ Брауна – отнюдь не миф, а реальный химический процесс, призванный выделять газообразное горючее из воды. Этот газ получил свое имя в честь изобретателя, который первым попытался вывести эту технологию за рамки экспериментов. Другое название, бытующее в интернете – гремучий газ (гипотетическая формула ННО).
Другое название, бытующее в интернете – гремучий газ (гипотетическая формула ННО).
Горючий газ Брауна – это не что иное, как смесь свободного водорода и кислорода, выделяемого из воды путем электролитической реакции.
Вода, чью химическую формулу (Н2О) знают даже дети, — это водород, который полностью окислен. По отдельности данные химические элементы весьма активны, водород хорошо горит и считается энергоносителем, а кислород поддерживает горение. Вот почему расщепить воду, чья цена – копейки, на столь полезные составляющие стало очень популярной идеей.
В результате трудами разных людей на свет появился генератор для получения газа – электролизер. Глубоко не вдаваясь в тонкости процесса, отметим, что вышеозначенный аппарат методом электролиза выделяет из воды газ Брауна, а точнее, смесь кислорода с водородом. Для этого через погруженные в емкость с водой электроды пропускается ток оптимальной частоты. Полученный газ скапливается под водяным затвором и при достижении определенного давления выходит по трубке наружу и может быть использован в разных целях.
Целесообразность получения газа Брауна
Генераторы газа Брауна, чей принцип работы описан выше, нашли свое практическое применение в 2 сферах:
- производство водородного топлива для автомобилей;
- газопламенные работы (сварка и пайка металлов).
Ездить с электролизером на борту автомобиль не может, поскольку ему требуется внешний источник электроэнергии. Штатной батареи хватает ненадолго, потому что на получение газа Брауна необходимо израсходовать больше энергии, чем отдает само топливо при сжигании. Поэтому компании, всерьез разрабатывающие тему водородного горючего на авто, внедрили схему заправки машин топливом, полученным из отдельного генератора.
Со сваркой и пайкой металлов дело обстоит лучше, водородные горелки используются на многих производствах Западной Европы. Так как температура горения газа Брауна (2235 °C) ниже, чем ацетилена (2620 °C), а продуктом сжигания является водяной пар, то многие мероприятия по экологической безопасности стали излишними. Промышленные генераторы газа, что при этом используются, весьма дороги, поскольку для повышения эффективности в них применяются катализаторы из редких элементов, в том числе платины.
Промышленные генераторы газа, что при этом используются, весьма дороги, поскольку для повышения эффективности в них применяются катализаторы из редких элементов, в том числе платины.
Менеджеры одной из британских производственных компаний подсчитали, что общая стоимость выделения и использования газа Брауна равняется затратам на закупку и доставку ацетилена. Только сжигание водорода безопаснее и экологичнее. Другое дело, что на его получение расходуется электроэнергия, добытая путем сжигания тех же углеводородов.
На данный момент отопление газом Брауна крайне неэффективно, потому что энергии на производство горючего затрачивается больше, нежели получается при его сгорании. Существующие электролизеры пока что не в состоянии обеспечить высокий выход топлива при малых затратах. Чтобы в этом убедиться, стоит посмотреть видео:
На второй минуте отснятого материала четко видны показания приборов генератора при работающей водородной горелке. Напряжение – 250 В, сила тока – 14 А, соответственно, потребляемая мощность аппарата составляет 250 х 14 = 3500 Вт или 3.5 кВт. А теперь вопрос: сможет ли такой факел нагреть воду для обогрева комнаты площадью хотя бы 30 м2? Даже визуально заметно, что нет. А простой электрокотел мощностью 3.5 кВт легко обогреет помещение до 40 м2.
Напряжение – 250 В, сила тока – 14 А, соответственно, потребляемая мощность аппарата составляет 250 х 14 = 3500 Вт или 3.5 кВт. А теперь вопрос: сможет ли такой факел нагреть воду для обогрева комнаты площадью хотя бы 30 м2? Даже визуально заметно, что нет. А простой электрокотел мощностью 3.5 кВт легко обогреет помещение до 40 м2.
Вывод: Горючий газ Брауна в домашних условиях не может сравниться по отоплению с обычными электрическими нагревателями. Слишком много уходит энергии на его выделение из воды, а значит, использовать его для обогрева – нецелесообразно. Самостоятельным получением водорода можно заниматься как хобби либо в качестве эксперимента.
Как получить водород в домашних условиях?
На просторах интернета легко можно отыскать чертежи и схемы самых разнообразных самодельных установок, позволяющих выделять из воды газ Брауна. Если отфильтровать информационный мусор, относящийся к этой теме, то выяснится, что у себя дома вы сможете получить водород двумя путями. Первый – это приобрести готовый электролизер, таковые уже имеются в продаже. Одна беда – цена их слишком высока, а величина КПД неизвестна.
Первый – это приобрести готовый электролизер, таковые уже имеются в продаже. Одна беда – цена их слишком высока, а величина КПД неизвестна.
Покупая водородный генератор, надо понимать, что он не станет для вас панацеей в плане отопления. Цена оборудования и потребляемой электроэнергии получится выше, чем простой электрический нагрев воды, так что об окупаемости речи не идет.
Можно в качестве эксперимента сделать генератор газа Брауна своими руками, позволяющий выделить небольшое количество горючего. Использовать его для обогрева здания вряд ли получится, а вот на питание небольшой горелки для плавления металла вполне может хватить. Для начала надо изготовить электролизер, представляющий собой емкость с водой, куда погружены электроды. Чем больше площадь поверхности электродов, тем выше производительность установки. Подойдут стальные пластины произвольного размера, прикрепленные к основанию из диэлектрика. Рабочая схема аппарата показана на рисунке:
Электроды опускаются в герметично закрытую емкость с водой, куда для улучшения реакции добавлена обычная соль. Через крышку выводится трубка для газа, идущая во второй сосуд, являющийся водяным затвором, он наполняется водой на 2/3.
Через крышку выводится трубка для газа, идущая во второй сосуд, являющийся водяным затвором, он наполняется водой на 2/3.
Вторая трубка, выходящая из этой емкости, подключается к горелке. Напряжение на электроды лучше подавать с помощью автотрансформатора, контролируя его величину мультиметром. Как собрать мини-генератор газа Брауна своими руками, показано на видео:
Внимание! Если вам удалось добиться сколько-нибудь значительной производительности установки, горелку к трубке следует подключать через обратный клапан, чтобы избежать обратного удара и взрыва.
Заключение
На данный момент не существует недорогого и одновременно высокоэффективного оборудования для получения газа Брауна из воды. Пока первенство в отоплении остается за углеводородами, но технологии продолжают совершенствоваться и не исключено, что скоро водородные генераторы станут достойно конкурировать с традиционными источниками тепловой энергии.
Грем у чий газ, смесь двух объёмов водорода и одного объёма кислорода. При поджигании гремучий газ сильно взрывается, в присутствии губчатой платины горит спокойнее; реакция 2H2+O2=2H2O+ +572,5 кдж (136,74 ккал) позволяет получать высокие температуры (около 2800°C). Поэтому пламя гремучего газа служит для плавки кварца, платины и др., а также газовой сварки и резки металлов.
Взрывоопасный газ Определение | Law Insider
означает любое химическое соединение или механическую смесь, предназначенную для осуществления взрыва, содержащую любые окисляющие и горючие элементы или другие ингредиенты в таких пропорциях, количествах или упаковках, что воспламенение от огня, трения, сотрясения , ударом или детонатором любой части соединения или смеси может вызвать такое внезапное образование сильно нагретых газов, что возникающее давление газов способно оказывать разрушительное воздействие на прилегающие объекты или уничтожать жизнь или конечности.
означает химическое соединение, устройство или смесь:
означает химическое вещество, подпадающее под одну из следующих категорий: газом и теплом самопроизвольно или при контакте с искрами или пламенем.
означает соединения, которые содержат только водород, фтор и углерод.
означает все сорта керосина, включая, помимо прочего, 2 сорта керосина, № 1-К и № 2-К, широко известные как керосин К-1 и керосин К-2 соответственно, описанные в Американском обществе по испытаниям и спецификациям материалов D-3699, действующей с 1 января 1999 г., и керосиновое топливо для реактивных двигателей, описанное в Американском обществе по испытаниям и спецификациям материалов D-1655 и военным спецификациям MIL-T-5624r и MIL-T-83133d (марки jp-5 и jp- 8), а также любые последующие правила или положения налоговой службы в качестве спецификации для керосина и реактивного топлива на основе керосина. Керосин не включает исключенную жидкость.
означает любое вещество, которое при контакте с ним
означает преобразование нестабильных атомных ядер путем испускания радиации.
означает радиоактивный материал в газообразной, жидкой или твердой форме, дальнейшее использование которого не предусмотрено или не рассматривается государством-членом или юридическим или физическим лицом, решение которого принято государством-членом, и который регулируется как радиоактивные отходы. компетентным регулирующим органом в рамках законодательной и нормативной базы государства-члена;
означает химические вещества любой из следующих подкатегорий:
означает любое твердое вещество, жидкость или газ, которые самопроизвольно излучают излучение.
означает любые радиоактивные материалы, асбестосодержащие материалы, формальдегид мочевины, подземные или надземные резервуары, загрязняющие вещества, загрязняющие вещества, вредные вещества, опасные вещества или товары, опасные, коррозионные или токсичные вещества, опасные отходы, отходы, пестициды, дефолианты, или любое другое твердое вещество, жидкость, газ, пар, запах, тепло, звук, вибрация, излучение или комбинация любого из них, хранение, производство, обращение, утилизация, обработка, образование, использование, транспортировка, восстановление или выпуск в окружающая среда которой в настоящее время или в будущем запрещена, контролируется или регулируется законами об охране окружающей среды;
означает любой загрязнитель, загрязняющее вещество, опасное вещество, опасный материал, опасные отходы или токсичные отходы, как они определены в любом действующем федеральном, государственном или местном законе или любом постановлении, которое было обнародовано в соответствии с ним. Никакая часть какого-либо Арендованного участка не была указана или предложена для включения в список национальных приоритетов, составленный Агентством по охране окружающей среды США, или в любой другой соответствующий список, составленный властями штата или местными властями.
Никакая часть какого-либо Арендованного участка не была указана или предложена для включения в список национальных приоритетов, составленный Агентством по охране окружающей среды США, или в любой другой соответствующий список, составленный властями штата или местными властями.
означает любую жидкость, температура воспламенения которой составляет семьдесят градусов по Фаренгейту или ниже, как определено с помощью тальябуэ или эквивалентного испытательного устройства в закрытом тигле.
означает вещество, которое вызывает повышенную заболеваемость доброкачественными или злокачественными новообразованиями или существенно сокращает время развития новообразований у животных или людей. Классификация канцерогенов обсуждается в разделе 14(b)(1) этого правила.
означает и включает в себя любые опасные, токсичные или опасные отходы, жидкости, вещества или материалы (включая нефтепродукты и производные), производство, обработка, хранение, утилизация, переработка или выбросы которых подпадают под действие любого Закона об охране окружающей среды.
означает помещение, ограждение или территорию, в которой переносимые по воздуху радиоактивные материалы, полностью или частично состоящие из лицензированных радиоактивных материалов, существуют в концентрациях:
означает вещество, которое испускает ионизирующие вещества
означает полихлорированные дифенилы.
означает радиоактивность встречающихся в природе нуклидов.
означает любой радиоактивный материал, произведенный или любой материал, ставший радиоактивным в результате воздействия радиации, связанной с производством или использованием ядерного топлива, но не включает радиоизотопы, которые достигли конечной стадии изготовления, чтобы их можно было использовать для любой научной, медицинской, сельскохозяйственной, коммерческой или промышленной цели.
означает любой материал, который содержит более 1% асбеста по весу и который можно раскрошить, измельчить или превратить в порошок в сухом виде под давлением руки.
означает инструмент, приводимый в действие зарядом взрывчатого вещества и используемый для забивания болтов, гвоздей и аналогичных предметов с целью фиксации;
означает радиоактивный материал, который удовлетворяет следующим условиям:
означает радиоактивность в конструкциях, материалах, почве, грунтовых водах и других средах на объекте в результате деятельности, находящейся под контролем лицензиата. Это включает радиоактивность от всех лицензированных и нелицензированных источников, используемых лицензиатом, но не включает фоновое излучение. Он также включает радиоактивные материалы, оставшиеся на площадке в результате плановых или аварийных выбросов радиоактивных материалов на площадке и предыдущих захоронений на площадке, даже если эти захоронения были произведены в соответствии с положениями 641 — Глава 40 или любым предыдущим состоянием. или федеральные лицензии, правила или положения.
означает жидкий углеводород, отделенный от природного газа, который конденсируется из-за изменений температуры или давления и остается жидким при стандартных условиях.
Объяснение НПВ и НПВ (взрывоопасный газ)
Нижний предел взрываемости (НПВ) — это минимальная концентрация определенного горючего газа, необходимая для возгорания при контакте с кислородом (воздухом). Если концентрация газа ниже значения НПВ, смесь между самим газом и воздухом слишком слабая, чтобы воспламенить. Верхний предел взрываемости (ВПВ) — это максимальный уровень концентрации газа, который будет гореть при смешивании с кислородом; когда концентрация газа выше значения UEL для газа/пара, смесь слишком «жирная», чтобы загореться или взорваться.
LEL И UEL: ПОЧЕМУ ВАЖНЫ?
Диапазон между нижним и верхним пределом взрываемости (НПВ/ВПВ %) определяется как диапазон воспламеняемости конкретного взрывчатого и легковоспламеняющегося газа.
Примеры НПВ для обычных газов:
- НПВ для водорода: 4,0
- НПВ для метана: 5,0
Риск взрыва горючих газов должен тщательно контролироваться на любом производственном объекте, работающем с газами.
Чтобы произвести взрыв, должны одновременно произойти три условия:
- Наличие горючего газа, горючего элемента, в определенной концентрации
- Наличие кислорода
- Наличие искрового элемента (который воспламеняет два элемента)
Соотношение топлива и кислорода, необходимое для возникновения взрыва, зависит от типа горючего газа. Газы воспламеняются только при смешивании с воздухом в определенном диапазоне концентраций. Если газ смешать с кислородом слишком низкой или слишком высокой концентрации, газ не воспламенится и не взорвется.
Нижнее и верхнее значения взрываемости (НПВ и ВПВ) определяют требуемый уровень концентрации по типу газа .
Взрывы будут происходить при концентрациях газа в пределах НПВ и значения ВПВ, не выше и не ниже, а максимальная мощность взрыва будет при концентрации в средней точке диапазона воспламенения.
LEL UEL ТАБЛИЦА
(Примечание: значения LEL / UEL основаны на комнатной температуре и атмосферном давлении, воспламенение производится трубкой диаметром 2 дюйма.
По мере повышения температуры, давления и воспламенения пределы взрываемости по газу меняются.
Значения определены опытным путем и могут меняться в зависимости от источника информации). The lower and the upper explosive limits by gas are:
| LEL Gas | LEL % | UEL % | |
| Acetone | 2.6 | 13.0 | |
| Acetylene | 2.5 | 100.0 | |
| Acrylonitrile | 3.0 | 17 | |
| Allene | 1.5 | 11.5 | |
| Ammonia | 15.0 | 28,0 | |
| Бензол | 1,3 | 7,9 | |
| 15 | 2. 0 0 | 12.0 | |
| Butane | 1.8 | 8.4 | |
| n-Butanol | 1.7 | 12.0 | |
| 1-Butene | 1.6 | 10.0 | |
| Cis-2-Butene | 1.7 | 9.7 | |
| Trans-2-Butene | 1.7 | 9.7 | |
| Butyl Acetate | 1.4 | 8.0 | |
| Carbon Monoxide | 12.5 | 74.0 | |
| Carbonyl Sulfide | 12.0 | 29.0 | |
| Хлортрифторэтилен | 8,4 | 38,7 | |
| Кумол | 0,5 6 19 | 5||
| Cyanogen | 6. 6 6 | 32.0 | |
| Cyclohexane | 1.3 | 7.8 | |
| Cyclopropane | 2.4 | 10.4 | |
| Deuterium | 4,9 | 75,0 | |
| Диборан | 0,8 | 88,0 | 9 Дихлорсилан0111 | 4.1 | 98.8 |
| Diethylbenzene | 0.8 | – | |
| 1,1-Difluoro-1-Chloroethane | 9.0 | 14.8 | |
| 1,1-Difluoroethane | 5.1 | 17.1 | |
| 1,1-Difluoroethylene | 5.5 | 21.3 | |
| Dimethylamine | 2. 8 8 | 14.4 | |
| Dimethyl Ether | 3.4 | 27.0 | |
| 2,2-Dimethylpropane | 1.4 | 7.5 | |
| Ethane | 3.0 | 12.4 | |
| Ethanol | 3.3 | 19.0 | |
| Ethyl Acetate | 2.2 | 11.0 | |
| Ethyl Benzene | 1.0 | 6.7 | |
| Ethyl Chloride | 3.8 | 15.4 | |
| Ethylene | 2.7 | 36,0 | |
| этиленоксид | 3,6 | 100,0 | |
GASOLIN0170| 7.1 | |
| Gas | LEL | UEL | ||||||
| Heptane | 1. 1 1 | 6.7 | ||||||
| Hexane | 1.2 | 7.4 | ||||||
| Hydrogen | 4.0 | 75.0 | ||||||
| Hydrogen Cyanide | 5.6 | 40.0 | ||||||
| Hydrogen Sulfide | 4.0 | 44.0 | ||||||
| Isobutane | 1.8 | 8.4 | ||||||
| Isobutylene | 1.8 | 9.6 | ||||||
| Изопропанол | 2,2 | — | ||||||
| Метан | 5.0 | 169016. | ||||||
| 5,0165 | 17016.9016. | 5,0165 | 17016.9016 | 5,0165 | 16. | 5,0165 | 16. | .0165 |
| Methanol | 6. 7 7 | 36.0 | ||||||
| Methylacetylene | 1.7 | 11.7 | ||||||
| Methyl Bromide | 10.0 | 15.0 | ||||||
| 3- Метил-1-бутен | 1,5 | 9,1 | ||||||
| Метилцеллозольв | 2,5 | 6017020161Methyl Chloride | 7.0 | 17.4 | ||||
| Methyl Ethyl Ketone | 1.9 | 10.0 | ||||||
| Methyl Mercaptan | 3.9 | 21.8 | ||||||
| Methyl Виниловый эфир | 2,6 | 39,0 | ||||||
| Моноэтиламин | 3,5 | 95 95 | 9 14,00161 | Monomethylamine | 4.9 | 20. 7 7 | ||
| Nickel Carbonyl | 2.0 | – | ||||||
| Pentane | 1.4 | 7.8 | ||||||
| Picoline | 1.4 | – | ||||||
| Propane | 2.1 | 9.5 | ||||||
| Propylene | 2.4 | 11.0 | ||||||
| Propylene Oxide | 2.8 | 37.0 | ||||||
| Styrene | 1.1 | – | ||||||
| Tetrafluoroethylene | 4,0 | 43,0 | ||||||
| Тетрагидрофуран | 2,0 | – | ||||||
1. 2 2 | 7.1 | |||||||
| Trichloroethylene | 12.0 | 40.0 | ||||||
| Trimethylamine | 2.0 | 12.0 | ||||||
| Turpentine | 0.7 | – | ||||||
| Винилацетат | 2,6 | – | ||||||
| 9.0 | 14.0 | |||||||
| Vinyl Chloride | 4.0 | 22.0 | ||||||
| Vinyl Fluoride | 2.6 | 21.7 | ||||||
| Xylene | 1.1 | 6.6 |
СЧЕТЧИКИ НПВ/ВПВ
Для безопасной работы в опасных условиях, т. е. в закрытых помещениях с присутствием горючих газов, необходимо тщательно контролировать концентрацию газа.
Так как концентрация газа превышает 20% НПВ газа, считается небезопасным.
Для контроля значения концентрации газа в закрытых и опасных средах операторы могут использовать измерители НПВ (также называемые измерителями/детекторами НПВ), которые оснащены каталитическими шариками и инфракрасными чувствительными элементами для измерения нижнего предела взрываемости газов.
Эти газоанализаторы предупреждают операторов всякий раз, когда горючий газ присутствует в окружающей среде на уровне около 10 %.
Измерители НПВ представляют собой достаточно сложные устройства, имеющие модульную конструкцию на основе микропроцессоров с самокалибровкой и цифровым отображением информации.
Наиболее часто используемым измерителем НПВ является измеритель моста Уитстона, который эффективен для большинства применений и сред.
Однако детектор нижнего предела взрываемости с мостом Уитстона может оказаться неэффективным для определенных условий или газов, для которых требуются более чувствительные датчики. Детекторы ФИД («детекторы фотоионизации») — это вариант, когда требуется более точное измерение НПВ в опасных средах.
Детекторы ФИД («детекторы фотоионизации») — это вариант, когда требуется более точное измерение НПВ в опасных средах.
ФИД может измерять концентрацию легковоспламеняющихся и других токсичных газов даже при очень низких уровнях (от ppb, т.е. частей на миллиард, до 10 тыс. ppm, т.е. 1%).
ФИД являются гораздо более чувствительными приборами, чем обычные измерители НПВ, и, как правило, они дороже. ФИД подходят для измерения следующих органических соединений:
- Спирты
- Ароматические соединения
- Амины и амиды
- Хлорированные углеводороды
- Кетоны и альдегиды
- Sulfur compounds
- Unsaturated hydrocarbons
- Saturated hydrocarbons – like butane and octane
The inorganic compounds that can be measured by photoionization detectors are:
- Ammonia
- Bromine
- Iodine
- Hydrogen sulfide
- Nitric Oxide
- Полупроводниковые газы
Пределы концентрации взрывоопасности и воспламеняемости
Диапазон воспламеняемости (также называемый взрывоопасным диапазоном) представляет собой диапазон концентраций газа или пара, которые будут гореть (или взрываться) при введении источника воспламенения.
Для взрыва должны быть выполнены три основных условия:
- легковоспламеняющееся вещество — топливо
- окислитель — кислород или воздух
- источник воспламенения — искра или высокая температура слишком бедная, чтобы гореть, и выше верхнего предела взрывоопасности или воспламеняемости, смесь слишком богатая, чтобы гореть. Пределы обычно называются «нижним пределом взрывоопасности или воспламеняемости» (LEL/LFL) и «верхним пределом взрывоопасности или воспламеняемости» (UEL/UFL).
Нижний и верхний предел концентрации взрыва для некоторых широко используемых газов указаны в таблице ниже. Некоторые газы обычно используются в качестве топлива в процессах горения.
Внимание! Указанные пределы относятся к газу и воздуху при 20 o C и атмосферном давлении.

 9
9 6
6 3
3 1
1 3
3 4
4 32
32 5
5 4
4 5
5