Новый вид обмана: «проверка» качества воды электролизом
В последнее время участились жалобы от жителей города на представителей неких компаний, которые назойливо пытаются убедить в низком качестве употребляемой воды.
В гости ко многим жителям Ижевска по телефону напрашиваются некие «эксперты» с предложением бесплатно проверить качество питьевой воды.
Доверчивые горожане, согласившиеся на проверку у себя дома, становятся зрителями опыта, результаты которого многих удручают. «Исследователи» за несколько минут демонстрируют, что вода, которую они пьют, полна опасных примесей и перед употреблением нуждается в очистке. Легко догадаться, что эксперты на самом деле являются торговыми представителями, цель которых продать свой фильтр.
Так называемая «проверка» воды представляет собой демонстрацию определения степени минерализации и процесса электролиза воды.
Для опыта в стаканы наливают разные пробы воды, как правило, водопроводную, бутилированную и, конечно же, «свой» образец воды, полученный на выходе из рекламируемого фильтра. Что на деле является обычной дистиллированной водой.
Что на деле является обычной дистиллированной водой.
В первую очередь представитель опускает в воду TDS-метр, специальный прибор, который замеряет степень минерализации воды. Разумеется, измеритель показывает разные цифры, которые зависят от минерализации воды и ее температуры. В воде же, которую принес с собой «эксперт», данная цифра близка к нулю. Это объясняется тем, что дистиллированная вода практически лишена минеральных солей и микроэлементов. Тем более никто не станет уточнять, что минимальное наличие солей необходимо организму.
Для того, чтобы убедиться в наличии примесей в воде, применяется электролиз. Представители демонстрируют прибор (электролизер), который якобы может определить, какого качества исследуемая вода. В стакан с испытуемой водой помещают два противоположно заряженных электрода — катод, анод. С их помощью, пропускают через воду электрический ток. В результате этого процесса в воде наблюдается выпадение хлопьев от серого до зеленовато-коричневого цвета.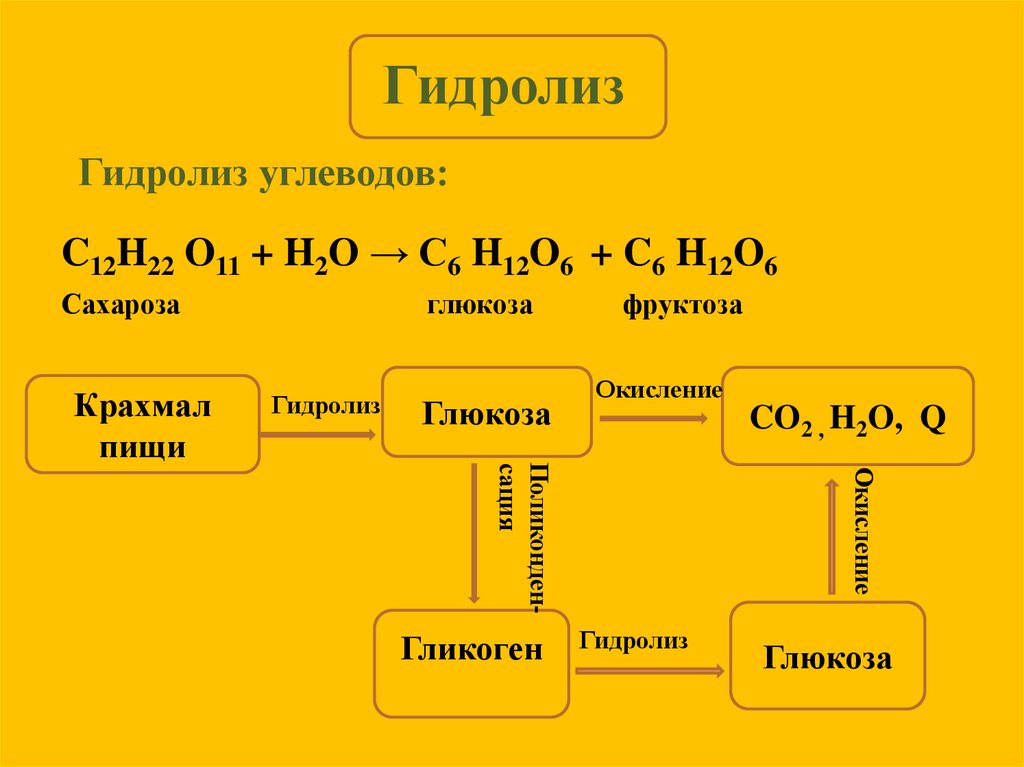 Во время такого химического процесса соли, содержащиеся в воде, выпадают в осадок, по цвету которого «исследователи» делают выводы о составе и «загрязненности» воды.
Во время такого химического процесса соли, содержащиеся в воде, выпадают в осадок, по цвету которого «исследователи» делают выводы о составе и «загрязненности» воды.
На самом деле, этот прибор показывает наличие или отсутствие в воде растворимых солей. Материал электрода под действием электрического тока растворяется. А продукты растворения в воде образуют хлопья. Для сравнения подобная процедура проводится с дистиллированной водой, которая, как известно, не содержит ничего, кроме молекул Н2О. Демонстрируя в ней работу электролизера, визуальные изменения практически не отмечаются, что, по словам «исследователей», говорит о «высоком» качестве воды. Это утверждение абсолютно не отвечает действительности. Дистиллированная вода не пригодна для употребления ни одним живым существом.
Говоря простыми словами, любая вода – это раствор солей, и за исключением химически чистой – дистиллированной, под действием электрического тока оставит осадок. Это признак физиологически полноценной воды.
Прибор электролизер применяют для этой «проверки» специально для тех, кто не верит в цифры, а верит своим глазам. Он не сертифицирован и не применяется ни в лабораториях, ни на производстве.
Существуют утверждённые и закреплённые в законодательном порядке методы контроля содержания в воде токсичных элементов и других веществ. Количественная и качественная оценка этих элементов может проводиться только компетентными инстанциями – аккредитованными лабораториями Роспотребнадзора, имеющими оборудование и полномочия для подобных исследований. Результаты этой оценки достоверно покажут, стоит ли пить эту воду. Качество воды невозможно определить «на глаз». Таким образом, эксперимент с электролизером нельзя воспринимать, как оценку качества воды.
Следует так же заметить, что любой порядочный производитель воды регулярно делает анализы по химическим и бактериологическим параметрам, на которые у лаборатории уходит от 2 до 5 дней. И результаты данных анализов всегда имеются у производителя в открытом доступе.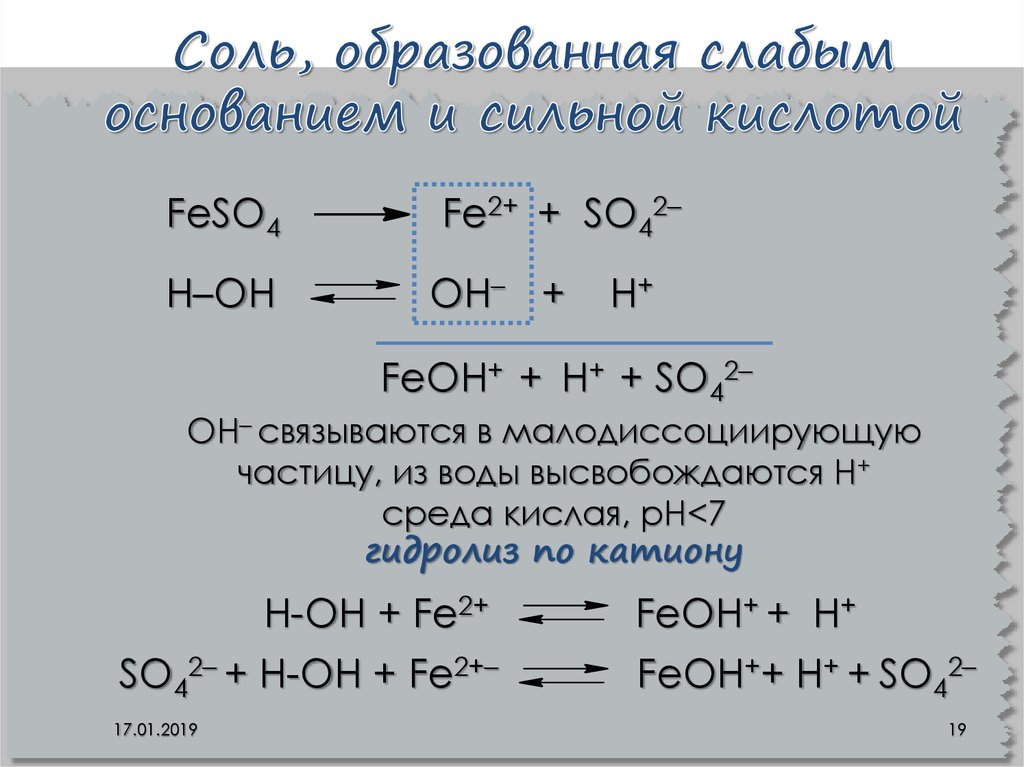
Напоследок хочется еще раз повторить: как бы убедительно ни звучали слова торговых представителей, не теряйте бдительности! Потому что «проверка» качества воды продавцов фильтрами на самом деле оказалась элементарной уловкой.
Вашему вниманию представляем видео, где подробно показывается и объясняется процесс электролиза воды: http://www.youtube.com/watch?v=gYAuiL-rBeM или http://vk.com/video3719088_165929653
Каким образом получается разный цвет осадка?
Согласно закону электролиза английского физика Фарадея, масса веществ, выделяющегося на электроде, прямо пропорциональна количеству электричества, прошедшего через электролит. Таким образом, окрашивание воды, вызвано растворением электрода. Цвет осадка зависит от материала электрода. А интенсивность окрашивания зависит от общей минерализации воды (концентрации солей) и длительности электротока.
Рассмотрим три вида электродов для описываемого опыта — стальные, алюминиевые, медные. При электролизе с железными электродами анод сразу начинает растворяться с образованием чёрно-зелёных хлопьев гидроокиси двухвалентного железа. Это расслоение получается за пару минут работы на хорошем постоянном токе. Со временем гидроокись железа меняет цвет от зелёного в сторону рыже-бурого. С разрушенного алюминиевого анода наблюдается смесь бело-серой окиси/гидроокиси алюминия. Ионы меди образуют в основном бурый осадок, с течением времени который тоже меняет цвет на более светлый.
При электролизе с железными электродами анод сразу начинает растворяться с образованием чёрно-зелёных хлопьев гидроокиси двухвалентного железа. Это расслоение получается за пару минут работы на хорошем постоянном токе. Со временем гидроокись железа меняет цвет от зелёного в сторону рыже-бурого. С разрушенного алюминиевого анода наблюдается смесь бело-серой окиси/гидроокиси алюминия. Ионы меди образуют в основном бурый осадок, с течением времени который тоже меняет цвет на более светлый.
Соответственно, основная масса полученных веществ — это продукты разрушения анода.
Проверка качества питьевой воды в домашних условиях
Алексей Кощеев 28 комментариев проверка воды, Электролиз, электролизер
Есть портативные приборы или мини-лаборатории, при помощи которых можно определить отдельные показатели качества питьевой воды.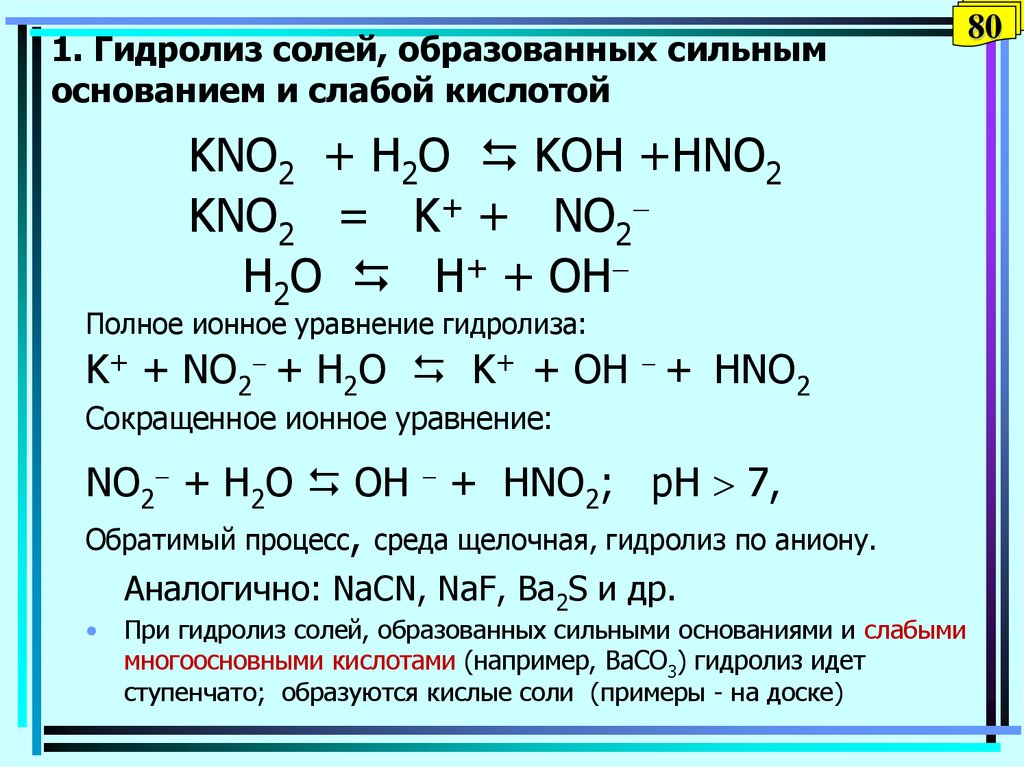 Но чтобы понять пригодна ли вода для питья, необходимо сделать анализ в сертифицированной лаборатории.
Но чтобы понять пригодна ли вода для питья, необходимо сделать анализ в сертифицированной лаборатории.
В домашних условиях можно дать оценку питьевой воде по цвету, запаху, осадку при кипячении или отстаивании. И чем более загрязнена вода для питья, тем хуже она выглядит, когда постоит некоторое время в прозрачном сосуде.
Так же можно провести экспресс-анализ воды при помощи портативного прибора, т.н.
- Чёрными хлопьями выпадают тяжелые металлы
- Cиний цвет дают нитраты, нитриты и пестициды
- Рыжий цвет говорит об избытке железа в воде
- Зеленый указывает на избыток органических веществ
Электролиз — это окислительно-восстановительный процесс, который протекает на электродах при прохождении постоянного электрического тока через питьевую воду. На отрицательно заряженном электроде — катоде происходит электрохимическое восстановление частиц (атомов, молекул, катионов), а на положительно заряженном электроде — аноде идет электрохимическое окисление частиц (атомов, молекул, анионов).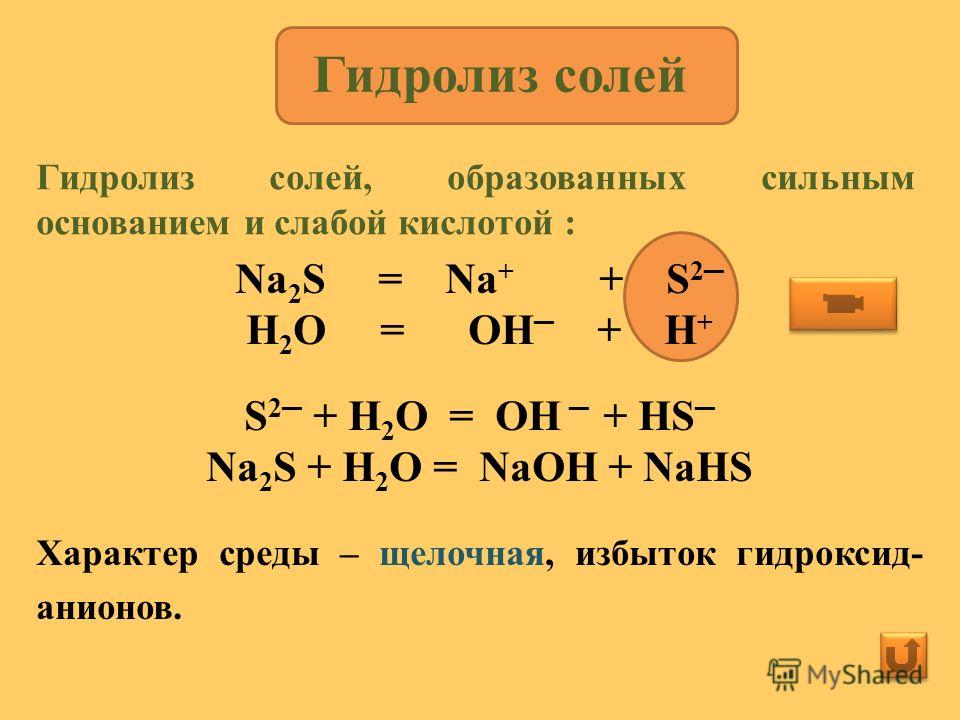
Визуальное определение наличия примесей в воде с помощью электролиза
Для того, чтобы убедиться в наличии примесей в воде, применяется визуальный метод определения — электролиз.
Электролиз — физико-химический процесс, состоящий в выделении на электродах составных частей растворённых веществ или других веществ, являющихся результатом вторичных реакций на электродах, которые возникают при прохождении электрического тока через раствор либо расплав электролита. В нашем случае раствор электролита – анализируемая вода с примесями, а электролиты (проводники) – растворённые в этой воде соли.
Для проведения электролиза используется прибор «электролизер» (например PR-2), имеющий две пары контактов для двух ёмкостей: в одной ёмкости находится анализируемая вода, в другой – эталон (например, чистая вода после фильтрации системой обратного осмоса).
Прибор включается в сеть 220В, и через воду в ёмкостях проводится электричество.
Прибор электролизер создан специально для тех, кто не верит в цифры, а верит своим глазам…
«Мы то, что мы пьём». Обзор питьевой воды с тестами
Полную версию тестов можно изучить на сайте доктора Тюрютикова, а для повышения интереса к теме просто покажу один из итогов
Использованы материалы с сайта http://тюрютиков.рф
Утащить к себе
Понравилось это:
Нравится Загрузка…
Гидролиз | Определение, примеры и факты
гидролиз сложного эфира
См. все СМИ
- Связанные темы:
- сольволиз процесс Доу омыление
См. все связанные материалы →
гидролиз , в химии и физиологии, двойная реакция разложения с водой в качестве одного из реагентов.
Гидролиз с участием органических соединений может быть проиллюстрирован реакцией воды с эфиром карбоновой кислоты; все такие сложные эфиры имеют общую формулу R CO―O R ′, в котором R и R ′ представляют собой объединяющие группы (например, если  На последующих стадиях, которые происходят очень быстро, углеродно-кислородная связь сложного эфира разрывается, и ионы водорода отделяются от исходной молекулы воды и присоединяются к зарождающейся молекуле спирта. Вся реакция представлена уравнением R CO―O R ′ + H 2 O → R CO―OH + R ′―OH, где R CO―OH обозначает молекулу карбоновой кислоты, R ――ОН обозначает молекулу спирта, тире обозначают ковалентные связи, которые разрываются или образуются в ходе реакции.
На последующих стадиях, которые происходят очень быстро, углеродно-кислородная связь сложного эфира разрывается, и ионы водорода отделяются от исходной молекулы воды и присоединяются к зарождающейся молекуле спирта. Вся реакция представлена уравнением R CO―O R ′ + H 2 O → R CO―OH + R ′―OH, где R CO―OH обозначает молекулу карбоновой кислоты, R ――ОН обозначает молекулу спирта, тире обозначают ковалентные связи, которые разрываются или образуются в ходе реакции.
Britannica Quiz
Типы химических реакцийМожете ли вы определить, какой тип химической реакции показан? Проверьте свои знания с помощью этого теста!
Раскройте науку о том, как пищеварительная система человека расщепляет углеводы, белки и жиры
Просмотреть все видео к этой статье основания, увеличивает скорость, с которой происходит химическое превращение. В биохимическом процессе пищеварения ферменты, выделяемые пищеварительным трактом, катализируют гидролиз сложных молекул в формы, которые могут усваиваться организмом организма. Белки разлагаются на аминокислоты, жиры — на жирные кислоты и глицерин, а крахмалы и сложные сахара — на глюкозу и другие простые сахара; ферменты, такие как липазы, амилазы и протеиназы, катализируют гидролиз жиров, углеводов и белков соответственно.
Белки разлагаются на аминокислоты, жиры — на жирные кислоты и глицерин, а крахмалы и сложные сахара — на глюкозу и другие простые сахара; ферменты, такие как липазы, амилазы и протеиназы, катализируют гидролиз жиров, углеводов и белков соответственно.Гидролиз с участием ионных соединений можно проиллюстрировать химическими изменениями, происходящими в водном растворе соли ацетата натрия. В растворе ионные составляющие соли (ион ацетата и ион натрия) разделяются; молекулы воды соединяются с ионами ацетата, образуя ионы уксусной кислоты и гидроксида. Уксусная кислота обратимо диссоциирует на ионы ацетата и ионы водорода, но только в очень небольшой степени, так что ионное содержание раствора состоит в основном из ионов натрия и гидроксида. Следовательно, раствор проявляет основные свойства (т. е. окрашивает красную лакмусовую бумажку в синий цвет).
Редакторы Британской энциклопедии Эта статья была недавно отредактирована и дополнена Эриком Грегерсеном.
23.9: Электролиз воды — Химия LibreTexts
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 53976
Поскольку ископаемое топливо становится все более дорогим и менее доступным, ученые ищут другие источники энергии. Водород долгое время считался идеальным источником, поскольку при горении он не загрязняет воздух. Проблема заключалась в том, чтобы найти способы экономичного производства водорода. Один из новых подходов, который изучается, — это фотоэлектролиз — производство электричества с использованием фотогальванических элементов для расщепления молекул воды. Этот метод все еще находится на стадии исследований, но, похоже, в будущем он станет очень многообещающим источником энергии.
Электролиз воды
При электролизе воды образуются газообразные водород и кислород. Электролитическая ячейка состоит из пары платиновых электродов, погруженных в воду, к которым добавлено небольшое количество электролита, такого как \(\ce{H_2SO_4}\). Электролит необходим, потому что чистая вода не несет достаточного заряда из-за отсутствия ионов. На аноде вода окисляется до газообразного кислорода и ионов водорода. На катоде вода восстанавливается до газообразного водорода и ионов гидроксида. 90_\text{cell} = -2,06 \: \text{V} \end{array}\nonumber \]
Чтобы получить общую реакцию, полуреакцию восстановления умножили на два, чтобы уравнять электроны. Ионы водорода и гидроксид-ионы, образующиеся в каждой реакции, объединяются, образуя воду. \(\ce{H_2SO_4}\) в реакции не расходуется.
Рисунок \(\PageIndex{1}\): Устройство для производства газообразного водорода и кислорода путем электролиза воды.Сводка
Эта страница под названием 23.
