Практическая работа «Получение водорода в лаборатории и изучение его свойств». 8-й класс
Место урока: 8 класс. Тема II: Кислород, водород, вода как растворитель.
Тип урока: практическая работа
Задачи:
- Образовательная – совершенствовать экспериментальные умения — приемы работы с лабораторным оборудованием и веществами; умения наблюдать, делать выводы, оформлять результаты практической работы в тетради.
- Развивающая – работа над развитием навыков умелого обращения с огнем, опасными веществами.
- Воспитательная – расширение кругозора обучающихся, формирование уважения к истории науки.
- Здоровьесберегающая – развитие представлений о здоровом образе жизни в блоках: «Химия в быту — безопасное поведение»
Планируемые результаты обучения:
- Уметь работать с автоматическим прибором Кирюшкина для получения газов
- Уметь собирать газ методом вытеснения воды
- Уметь проверять горючий газ на чистоту
- Уметь делать правильные выводы из наблюдаемых опытов и характеризовать свойства водорода
Оборудование:
- Мультимедийная презентация 2 (Microsoft Power Point)
- Спецодежда — халат
- Наполняемость лабораторного лотка для ученика (13 шт.
 )
)
- лабораторный штатив с лапкой, держатель для пробирок, штатив для пробирок, ложка-дозатор, фильтровальная бумага
- спиртовка, спички
- автоматический прибор Кирюшкина для получения газов, 3 пробирки, кристаллизатор с водой
- гранулы цинка, соляная кислота (разб.), оксид меди (II)
- Наполняемость лабораторного лотка для учителя:
- лоток для ученика
- тигельные щипцы, стакан, стеклянная пластинка, стеклянная палочка
- «результаты» нарушений правил техники безопасности
Методы и приемы:
- Словесные (рассказ учителя, беседа).
- Наглядные (просмотр слайдов презентации; демонстрация приемов работы с лаборатор-ным оборудованием и веществами).
- Самостоятельная отработка учеником экспериментальных умений.

- Проблемно-поисковый.
(курсивом описаны действия учеников и учителя, особенности методики урока; обычным шрифтом – речь учителя)
I. Организационный момент (1 мин.)отметить наличие халатов у всех учеников, проверить свободны ли от сумок проходы, убраны ли волосы у девочек. На столах оставить только ручки, калькуляторы и тетради.
II. Активизация знаний, необходимых для выполнения практической работы (13 мин.)Слайд 1:
На этом уроке мы получим водород в лабораторных условиях. Это газообразное вещество; является взрывоопасным, если загрязнено воздухом, и поэтому требует к себе повышенного внимания.
Ученики одновременно с обсуждением расписываются в журнале техники безопасности.
Слайд 2:
Ознакомление с планом урока. I.
На предыдущем уроке была проведена подготовка учеников к данной практической работе (Презентация 1) и задано домашнее задание:
Слайд 3:
Слайд проявляется постепенно, в соответствии с беседой
Вопросы:
- Какие исходные вещества будем использовать мы для получения водорода?
- Необходимо ли нагревать реакционную смесь?
- На что обратить внимание при записи наблюдений?
- Какой прибор будем использовать для получения водорода?
- Какими способами можно собрать водород, почему?
Слайд 4:
Слайд проявляется постепенно, в соответствии с беседой
Вопросы:
- Как доказать наличие водорода в пробирке-приёмнике?
- Какая химическая реакция происходит при этом?
- На что обратить внимание при записи наблюдений в данном пункте работы?
- Что из себя представляет гремучий газ?
Просмотр двух видеороликов.
Если взрыв произойдет в стеклянном сосуде, то осколки могут поранить окружающих и экспериментатора.
При проверке водорода на чистоту сжигают небольшой его объем (около 15 мл).
Возможный микровзрыв к травме привести не может.
Правило ТБ:
Слайд 5:
Демонстрация результатов нарушений правил ТБ: пробирка с растресканным дном
Правило ТБ: нагревать пробирку необходимо в том месте, где находится твердое вещество, а не выше – где воздух. От неравномерного нагрева пробирка треснет.
пробирка со следами соляной кислоты в смеси с оксидом меди (II)
Правило ТБ: при зарядке автоматического прибора соляной кислотой нужно следить, чтобы не перелить кислоту (max 2 мл), иначе избыток от экзотермичности и бурного течения процесса попадет в газоотводную трубку.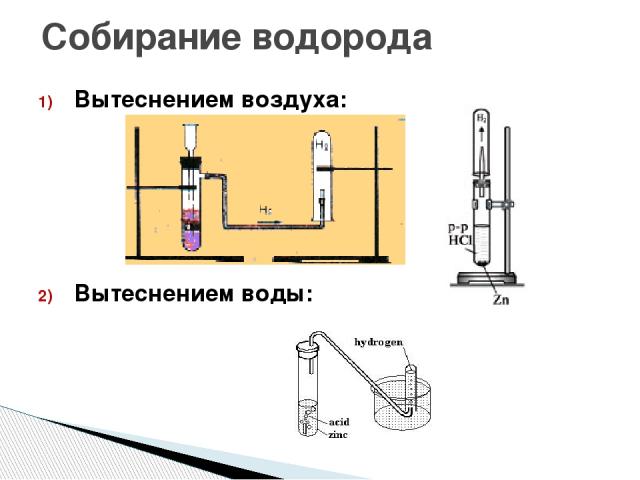
Слайд 6
Слово учителя с элементами беседы
1. Взять ложкой-дозатором небольшое количество черного порошка оксида меди (II), поместить в пробирку, оставить в штативе для пробирок до проведения опыта по изучению восстановительных свойств водорода.
2. Закрепить автоматический прибор для получения газов в лапке штатива. Зарядить прибор исходными веществами: 4-5 гранул цинка поместить на резиновый кружок, через воронку прилить соляную кислоту так, чтобы ее слой над цинком был не более 2 мл. Прибор закрыть максимально герметично.
3. Для проверки газа на чистоту, мне приходится приготовить спиртовку заранее. Вы работаете вдвоем и зажжете спиртовку после того, как наберете газ в пробирку- приемник.
Правила ТБ: работа со спиртовкой
а) прежде чем зажечь спиртовку, нужно проверить плотно ли диск прилегает к отверстию резервуара (иначе искра может попасть в резервуар и весь объем спирта воспламенится)
б) зажигать только спичкой (нельзя использовать зажигалку, другую спиртовку)в) спичку класть в лоток следует, убедившись, что она затушена (демонстрация нарушения правил ТБ – прожженный лоток)
г) чтобы погасить пламя, ее следует закрыть колпачком (задувать нельзя)
Выделяющийся водород собрать методом вытеснения воздуха, держа пробирку-приёмник вверх дном. Проверить газ на чистоту: зажать отверстие пробирки пальцем и поднести пробирку к пламени спиртовки, открыть ее.
Проверить газ на чистоту: зажать отверстие пробирки пальцем и поднести пробирку к пламени спиртовки, открыть ее.
4. Затем выделяющийся водород собрать методом вытеснения воды: набрать полную пробирку воды, перевернуть ее в кристаллизаторе и подвести к отверстию газоотводную трубку. Когда пробирка-приемник полностью заполнится водородом, зажать отверстие пальцем под водой. Убедиться в чистоте газа.
5. Закрепить пробирку с оксидом меди (II) в держателе.
Правила ТБ: закрепление пробирки в держателе
а) пробирку закрепляют в верхней третьей части ближе к отверстию
б) пробирка не должна выпадать, но проворачиваться (иначе при нагревании стекло расширяется и пробирка может лопнуть)
в) чтобы вынуть пробирку из держателя, нужно ослабить зажим.
Прогреть пробирку на пламени спиртовки 2-3 раза, далее нагревать ее в верхней части пламени, в том месте, где находится оксид меди (II). Внести газоотводную трубку с выделяющимся водородом.
Внести газоотводную трубку с выделяющимся водородом.
После окончания опыта дать пробирке остыть, затем поставить в штатив для пробирок.
6. Потушить спиртовку, перекрыть зажимом выделение водорода.
Основное правило ТБ: работать уверенными руками!
IV. Выполнение практической работы, оформление результатов, уборка рабочего места (23 мин.)Слайд 6
1. Ученики выполняют практическую работу самостоятельно. Учитель следит за правиль-ностью выполнения техники эксперимента и соблюдением правил ТБ.
2. Уборка рабочего места: после окончания опыта по изучению восстановительных свойств водорода:
1-й ученик: потушить спиртовку, дать пробирке-реактору остыть, затем поставить ее в штатив для пробирок.
2-й ученик: перекрыть выделение газа в автоматическом приборе, вынуть воронку, остатки цинка поместить на фильтровальную бумагу. Вынуть прибор из лапки штатива, слить отра-ботанный раствор в «СКЛЯНКУ ДЛЯ СЛИВА», сдать прибор учителю.
Вынуть прибор из лапки штатива, слить отра-ботанный раствор в «СКЛЯНКУ ДЛЯ СЛИВА», сдать прибор учителю.
учитель: собирает лотки и кристаллизаторы с водой.
3. Демонстрационный опыт: изучение продукта реакции цинка с соляной киcлотой
Отработанный раствор слить в стакан и несколько капель с помощью стеклянной палочки перенести на стеклянную пластинку. Укрепить пластинку в тигельных щипцах и упарить раствор на пламени
Что наблюдается?
4. Оформить результаты эксперимента: сформулировать и записать наблюдения, вывод (что узнали про газообразное вещество водород на практической работе), сдать тетрадь.
Проведение урока (Фото-фильм)
Использованные электронные пособия:
- Химия (8-11 класс). Виртуальная лаборатория. Лаборатория систем мультимедиа, МарГТУ, 2004.
- Химия для всех XXI.
 Химические опыты со взрывами и без. Ахлебинин А.К. и др., 2006.
Химические опыты со взрывами и без. Ахлебинин А.К. и др., 2006.
Оформление работы в тетради ученика:
Практическая работа 5: Получение водорода и изучение его свойств
1. Способ получения водорода – взаимодействие активных металлов с кислотами.
Zn + 2HCl = ZnCl2 + Н2↑ + Q — при обычных условиях
Наблюдения:
- реакция взаимодействия гранул цинка с соляной кислотой идет сначала медленно, затем очень бурно, пробирка разогревается
- из газоотводной трубки выделяется бесцветный газ
- при упаривании полученного раствора на стеклянной пластинке остается белый порошок
2. Приборы для получения и собирания водорода
Рис. Прибор для получения водорода – автоматический, который позволяет в любой момент остановить реакцию с помощью зажима (прибор Кирюшкина).
Собирание газа методом вытеснения воды – возможно, т.к. водород малорастворим в ней.
Рис. Собирание газа методом вытеснения воздуха – держа пробирку-приемник вверх дном, т.к.
– следовательно, водород легче воздуха
3. Обнаружение водорода – проверка его на чистоту
Наблюдения:
- при сжигании первой порции газа раздается резкий лающий звук
- при сжигании второй порции газа слышен легкий хлопок Рисунок 5 «п-пах»
4. Свойство водорода – активный восстановитель
Наблюдения:
- порошок меняет цвет с черного на медный
- на стенках пробирки появляются бесцветные капельки жидкости
Вывод:
Одним из способов получения водорода в лаборатории является взаимодействие цинка с разб. соляной кислотой, при этом образуется соль (хлорид цинка) и водород. Водород – бесцветный газ, без запаха, малорастворим в воде, легче воздуха, в смеси с воздухом взрывоопасен, восстанавливает металлы из их оксидов.
соляной кислотой, при этом образуется соль (хлорид цинка) и водород. Водород – бесцветный газ, без запаха, малорастворим в воде, легче воздуха, в смеси с воздухом взрывоопасен, восстанавливает металлы из их оксидов.
Водород, кислород — СУНЦ МГУ
♠ Техника безопасности
Водород горюч и в смеси с кислородом или воздухом образует взрывоопасную смесь. Все опыты с водородом разрешается проводить только в присутствии преподавателя, в очках или маске.
Если прибор, заполненный водородом, необходимо нагреть или поджечь водород на выходе из него, следует до начала нагревания вытеснить из прибора весь воздух водородом, затем проверить водород на чистоту.
Проверка водорода на чистоту. Для этого надо приготовить две маленькие пробирки. Надеть на газоотводную трубку прибора сухую пробирку, примерно через 5 секунд медленно снять ее, закрыв отверстие пробирки большим пальцем, и поставить на ее место вторую пробирку. Держа пробирку с водородом отверстием вниз, поднести ее к пламени зажженной горелки. Отнять палец и, чуть наклонив, быстро внести отверстие пробирки в пламя горелки. Следующую пробу проводят со второй пробиркой. * Почему? Проверку проводят до тех пор, пока проба водорода не будет загораться почти без звука.
Отнять палец и, чуть наклонив, быстро внести отверстие пробирки в пламя горелки. Следующую пробу проводят со второй пробиркой. * Почему? Проверку проводят до тех пор, пока проба водорода не будет загораться почти без звука.
Сбор водорода и его проверка на чистоту:
Только убедившись в чистоте выделяющегося водорода, можно поджечь его на выходе из прибора или начать нагревание прибора.
♣ Сборка прибора
Планирование. Готовясь собирать прибор, продумайте, какие узлы Вам понадобятся. Например: узел получения хлора; реакционная трубка; узел осушки и т. п. Прибор должен занимать как можно меньше места. Постарайтесь закрепить все детали на одном штативе, вот как здесь:
Нерационально сначала собирать прибор, а потом разбирать его, чтобы поместить внутрь реагенты. Если нет причин делать иначе, помещайте вещества сразу в нужное место.
Соединение узлов. Резиновые шланги и пробки, применяемые для соединения узлов и изоляции, могут подвергаться воздействию агрессивных сред (хлор и т. п.). Старая резина может пропускать газы, особенно водород. Поэтому надо использовать минимальные отрезки резиновых шлангов и стараться соединять части прибора «стык в стык».
п.). Старая резина может пропускать газы, особенно водород. Поэтому надо использовать минимальные отрезки резиновых шлангов и стараться соединять части прибора «стык в стык».
Края всех стеклянных трубок должны быть оплавлены. * Как это делается? Чтобы облегчить надевание тугого шланга на стеклянную трубку, смочите ее каплей воды или глицерина. * Всегда ли все равно, чем смачивать?
Резиновые пробки, как и шланги, присоединяют, не вдавливая, а вкручивая. Избегайте нажимать на тонкие части стеклянной посуды.
Соединения на шлифах. Шлифы – это притертые стеклянные соединения. Шлиф с внешней поверхности трубки называется керн, внутренний шлиф – муфта. Соединять их следует, вставляя керн в муфту круговым движением. Шлифы обязательно надо смазывать. При работе с пониженным давлением пользуются вакуумной смазкой. Не нужно наносить много смазки: достаточно нанести тонкую полоску на керн; когда Вы соедините шлифы круговым движением, она размажется по всей поверхности. Перед соединением рекомендуется слегка обогреть шлифы горячим воздухом над горелкой.
Перед соединением рекомендуется слегка обогреть шлифы горячим воздухом над горелкой.
Шлифы могут быть не только коническими. * Какие еще виды шлифов Вы встречали в лаборатории?
При работе с агрессивными газами или легколетучими жидкостями при атмосферном давлении в качестве смазки применяют фосфорную кислоту, при работе с неагрессивными соединениями без нагревания – вазелиновое масло или глицерин.
Закрепление прибора на штативах. Между металлической лапкой и стеклянной посудой, закрепляемой в штативе, надо поместить резиновую или термостойкую прокладку. * В каких случаях резиновая прокладка не годится? Сначала лапку с посудой зажимают рукой – плотно, но без усилия; потом закручивают винт лапки.
Обязательно должны быть закреплены колбы, реакционные трубки. Пример закрепления прибора:
Нет смысла располагать прибор четко «слева направо» и «строго по прямой». Расположение следует согласовывать с соседями (не помещать узел охлаждения рядом с горелкой соседа и т. п.). Чтобы прибор был компактен и занимал один штатив, изогните соединяющие резиновые трубки или используйте изогнутые стеклянные трубки (если это возможно).
п.). Чтобы прибор был компактен и занимал один штатив, изогните соединяющие резиновые трубки или используйте изогнутые стеклянные трубки (если это возможно).
Проверка на герметичность. Если пузырьки газа проходят через две промывалки с разной скоростью или не проходят совсем, это говорит о негерметичности прибора. Необходимо проверить соединения и пробки заново!
Когда промывалок в реакционном приборе нет, нужно закрыть выход прибора. Если прибор герметичен, то жидкость, находящаяся в колбе Вюрца, начнет быстро подниматься по воронке с длинной трубкой. Если же нет, можно найти место утечки, поочередно зажимая соединения частей прибора.
Проверка на герметичность:
Проверка на герметичность обязательна при работе с водородом и СО!
♥ Опыты
1. Получение водорода действием металла на кислоту и изучение свойств водорода
В пробирку или небольшую колбу Вюрца поместить гранулы цинка.
Прилить через воронку с длинной трубкой 20% раствор H2SO4 (* почему именно такая концентрация?) и пропустить выделяющийся газ через реакционную трубку из тугоплавкого стекла с 0,5 г оксида металла (например, меди (II)).
Помещение оксида металла в реакционную трубку:
Выходное отверстие реакционной трубки должно быть закрыто согнутой стеклянной трубочкой, сужающейся на конце, для отвода непрореагировавшего водорода (рис. 11). В эту трубочку необходимо поместить медную спираль. * Зачем?
Рис. 11. Газоотводная трубка
Внешний вид прибора:
Прилить через воронку с длинной трубкой несколько капель раствора CuSO4. * Что изменилось и почему?
(фото А.Сычевой)
Проверить прибор на герметичность. * Как это сделать? Добиться герметичности подгонкой соединений или заменой узлов.
Проверить водород на чистоту. * Почему вначале выходящий из трубки водород не является чистым? Дождавшись, когда водород станет чистым, поджечь его на выходе.
Поместить над пламенем водорода холодную стеклянную воронку. * Объяснить наблюдения.
Прогреть реакционную трубку горелкой по всей длине, затем сильно нагреть ту часть трубки, где лежит оксид металла. Фото В.В. Загорского:
Фото В.В. Загорского:
Если пламя погаснет (* почему это может произойти?), прекратить нагревание. Вновь поджечь водород можно после новой проверки на чистоту.
Если на стенках реакционной трубки оседает вода (* почему это может произойти?), удалить ее нагреванием.
Когда реакция закончится (* как это определить?), охладить прибор в токе водорода. * Почему нельзя сразу разбирать прибор?
** Оксиды каких металлов можно восстановить водородом? Дайте общий ответ.
2. Получение водорода
А) Действие металла на щелочь
В пробирку поместить 1-2 гранулы алюминия и 1-2 мл 40% раствора NaOH. Если реакция вначале идет медленно (* почему?), подогреть пробирку горячей водой. * Объяснить динамику реакции. Почему скорость реакции со временем возрастает?
Б) Действие металла на воду
Заполнить пробирку объемом 10-15 мл до краев водой. Закрыть отверстие большим пальцем, опрокинуть пробирку в кристаллизатор с водой и в таком положении закрепить в лапке штатива. Взять пинцетом или щипцами кусочек кальция и быстро подвести его под пробирку.
Взять пинцетом или щипцами кусочек кальция и быстро подвести его под пробирку.
Убедиться в том, что в пробирке собран водород. * Как это сделать?
В) Действие кремния на щелочь
Поместить в пробирку небольшой кусочек кремния и прилить 40% раствор NaOH. * Как ускорить эту реакцию?
** Какой процесс лежит в основе методов получения водорода в лаборатории?
3. Получение кислорода
Наполнить несколько (* сколько? – см. опыт 4) баночек кислородом из кислородной подушки. Для этого нужно налить в баночку до краев воду, закрыть стеклянной пластинкой, перевернуть и погрузить в кристаллизатор с водой. Опустить газоотводную трубку подушки в кристаллизатор и, открыв кран, отрегулировать скорость подачи кислорода (чтобы можно было легко считать пузырьки газа). Подвести газоотводную трубку под отверстие баночки. Когда баночка будет почти наполнена кислородом, закрыть ее под водой пластинкой и вынуть.
* Какими еще способами получают кислород в лаборатории?
** Какой процесс лежит в основе этих способов?
4. Изучение свойств кислорода
А) Поместить немного серы в железную ложечку, поджечь серу и внести ее в баночку с кислородом. После прекращения горения серы влить в баночку несколько капель индикатора (на фото справа). * Какие индикаторы можно использовать? * Как меняется характер горения веществ при внесении их в кислород? Почему?
Б) Скрутить в спираль железную проволоку, вставить в нее спичку. Взять проволоку щипцами, поджечь спичку и внести проволоку в баночку с кислородом. * Горит ли железо на воздухе? Если да, то какие для этого нужны условия?
** Какие химические свойства характерны для кислорода?
5. Свойства пероксида водорода
А) Налить в пробирку около 1 мл 10% раствора Н2О2. Всыпать немного порошка MnO2. * Какую роль играет MnO2? Доказать, что за газ выделяется. * Как это сделать?
* Какую роль играет MnO2? Доказать, что за газ выделяется. * Как это сделать?
Б) Реакции в кислой среде
Прилить раствор Н2О2 к 1 мл раствора KMnO4, подкисленного 1 М раствором H2SO4.
Прилить по каплям раствор KI к 1 мл раствора Н2О2, подкисленного 1 М раствором H2SO4 (на фото слева). Экстрагировать образовавшийся иод (на фото справа). * Как это сделать? Какой растворитель для этого требуется?
Редкий случай: достигнута стехиометрия, иод выпал в осадок:
В) Реакции в щелочной среде
К 1 мл раствора соли хрома (III) (фото 1) прилить 20% раствор NaOH до растворения (фото 3) выпадающего вначале осадка (фото 2). Затем добавить 1 мл 10% раствора Н2О2 (фото 4). При необходимости нагреть пробирку на водяной бане.
На фото 5 – в избытке пероксида образовалось перекисное соединение хрома (VI). На фото 6 — перекисное соединение при подкислении.
На фото 6 — перекисное соединение при подкислении.
1 2 3 4 5 6
К 1 мл раствора Н2О2 добавить немного иодной воды и 1 М раствора аммиака.
** Какие химические свойства проявляет пероксид водорода?
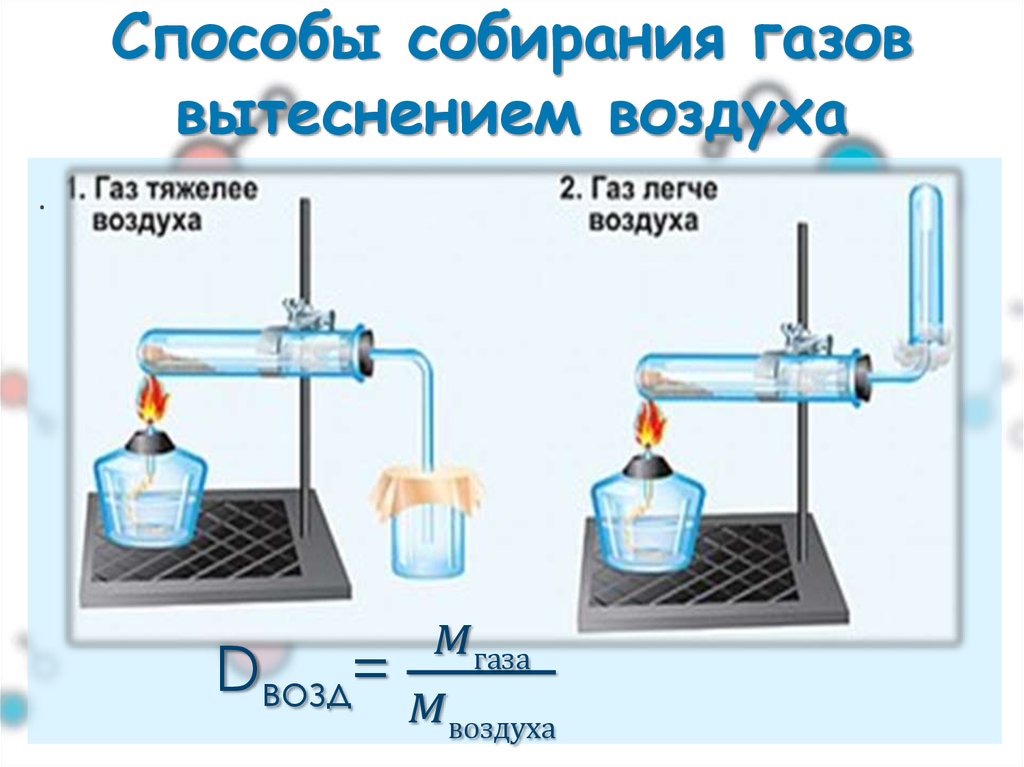
♣ Методы сбора газов
* С какими методами сбора газов Вы познакомились?
Собирать газы вытеснением воздуха можно в двух вариантах (рис. 12). * Приведите примеры газов, которые собирают по первому и второму вариантам. Каким критерием Вы пользуетесь, определяя, как собирать газ?
Рис. 12. Сбор газа вытеснением воздуха
Эффективные генераторы водорода для доступного производства водорода
Компактная и эффективная технология производства водорода Element 1 обеспечивает доступное производство водорода на месте и по запросу.
Компания Element 1 Corp, расположенная в Бенде, штат Орегон, США, является мировым лидером в разработке генераторов метанола в водород для доступного производства водорода на месте и по запросу. Опираясь на более чем 140-летний опыт производства водорода, очистки водорода и топливных элементов, техническая группа Element 1 создала самый компактный и высокоэффективный генератор водорода, доступный сегодня.
Опираясь на более чем 140-летний опыт производства водорода, очистки водорода и топливных элементов, техническая группа Element 1 создала самый компактный и высокоэффективный генератор водорода, доступный сегодня.
Подход Элемента 1
Признавая, что производство водорода несложно, но транспортировка водорода (сжатого или жидкого) является дорогостоящей и сложной задачей, подход, используемый Элементом 1, заключается в преобразовании смеси метанола и воды в водород высокой чистоты при точка использования. Полученный водород соответствует или превышает требования стандарта ISO 14687-2019 по чистоте для низкотемпературных топливных элементов с мембраной из полимерного электролита (PEM), а также сжатый водород для подачи в бортовые баллоны для хранения транспортных средств на топливных элементах. Типичная чистота водорода продукта составляет >99,997 % водорода с содержанием CO <0,2 ppm (на сухую основу). Примесью является метан с концентрацией <30 частей на миллион, а содержание водяного пара составляет от 40 до 70 частей на миллион.
С тремя моделями продуктов, производящими от 4 кг водорода в день до 390 кг водорода в день, генератор водорода Element 1 работает с использованием высокоэффективного термохимического процесса и достигает энергоэффективности до 84%, что приводит к низкой стоимости водорода при точка использования. Например, при цене метанола в 400 долларов за метрическую тонну стоимость произведенного водорода составляет менее 3 долларов за кг водорода. Требуемая электрическая мощность незначительна, менее 1 кВт при максимальном выходе водорода на самых больших генераторах водорода или около 0,1 кВтч/кг водорода, доставляемого пользователю. Это в 500 раз меньше электроэнергии по сравнению с типичными электролизёрами воды.
Более того, даже самые крупные генераторы водорода имеют небольшие физические размеры и полностью автономны. Например, M/L18 рассчитан на поставку 235 кг водорода в день, а его размеры составляют всего 879 мм (Ш) на 2080 мм (Г) на 1380 мм (В), что делает его практичным для установки на транспортное средство (например, среднее транспортное средство). -грузовой или большегрузный автомобиль) или морское судно. Генератор водорода M/L18 хорошо сочетается с модулем топливных элементов номинальной мощностью от 140 до 150 кВт (обозначение L указывает на стационарное применение, а обозначение M указывает на мобильное применение).
-грузовой или большегрузный автомобиль) или морское судно. Генератор водорода M/L18 хорошо сочетается с модулем топливных элементов номинальной мощностью от 140 до 150 кВт (обозначение L указывает на стационарное применение, а обозначение M указывает на мобильное применение).
L18 и его более крупные варианты также демонстрируют потенциал для распределенной выработки электроэнергии (основной и резервной) для приложений, включая зарядные станции для электромобилей (BEV), центры обработки данных, торговлю, автономные разработки, временную или переносную энергию, и критическая инфраструктура. Все эти приложения выигрывают от простоты и низкой стоимости транспортировки жидкого метанола с использованием существующей инфраструктуры, которая была разработана для распределения нефтяного топлива (бензина, дизельного топлива, авиационного топлива).
Рис. 2: Автономная зарядная станция BEV с генератором метанола в водород L18
Предлагает оптимальную мощность
Архитектура автономного продукта для производства электроэнергии проста, с небольшими отличиями от обычного топлива генератор водорода на ячейках, использующий подачу сжатого водорода. Рис. 1 представляет собой 3D-модель демонстрационной системы на Элементе 1, используемой для зарядки электромобилей (см. также рис. 2 и 3). Основные компоненты установлены в модифицированном десятифутовом транспортном контейнере и включают в себя один водородный генератор L18, один модуль топливных элементов PowerCell PS200 и блок никель-цинковых батарей Zinc Five (96 кВтч). Силовая электроника и охлаждение (для топливного элемента) являются внешними.
Рис. 1 представляет собой 3D-модель демонстрационной системы на Элементе 1, используемой для зарядки электромобилей (см. также рис. 2 и 3). Основные компоненты установлены в модифицированном десятифутовом транспортном контейнере и включают в себя один водородный генератор L18, один модуль топливных элементов PowerCell PS200 и блок никель-цинковых батарей Zinc Five (96 кВтч). Силовая электроника и охлаждение (для топливного элемента) являются внешними.
Рис. 3: Противоположная сторона зарядной станции BEV с аккумуляторной батареей (справа) и модулем топливных элементов (слева)
При максимальном номинальном выходе водорода для L18 (235 кг водорода в день) чистая около 143кВт. Этой мощности более чем достаточно для одновременной работы трех зарядных кабелей BEV уровня 2, а также зарядного кабеля Tesla уровня 3. Чтобы продемонстрировать все возможности генератора энергии, он также оснащен трехфазным выходным напряжением 480 В переменного тока, что соответствует мощности, необходимой для многих применений в зданиях. Химический состав никель-цинковых батарей был выбран вместо литий-ионных из-за присущей никель-цинковым батареям безопасности — они не подвержены тепловому разгону и возгоранию.
Химический состав никель-цинковых батарей был выбран вместо литий-ионных из-за присущей никель-цинковым батареям безопасности — они не подвержены тепловому разгону и возгоранию.
Этот демонстрационный генератор водорода предназначен для работы в сочетании с электрической сетью или полностью независимо от сети. Более высокие выходные мощности могут быть реализованы путем размещения нескольких генераторов водорода и нескольких топливных элементов в одном корпусе. Размер стандартного 20-футового транспортного контейнера позволяет вместить достаточное количество модулей для выработки около 450 кВт регулируемой электроэнергии.
Безвреден для окружающей среды
Как уже упоминалось, процесс превращения метанола в водород является термохимическим по своей природе, а не электрохимическим. Следовательно, имеется выхлопной поток сгорания. Тем не менее, выхлоп очень чистый по отношению к регулируемым выбросам, без оксидов серы (SOx), оксидов азота (NOx) и твердых частиц (PM). Выбросы угарного газа очень низкие и составляют < 1 г/кВтч. Кроме того, если в качестве сырья используется возобновляемый метанол, углеродоемкость будет очень низкой или даже отрицательной для большинства типов биогенного возобновляемого метанола (рис. 4), что обеспечивает как экологические преимущества, так и вклад в энергетическую безопасность. По данным Института метанола, в мире реализуется более 80 проектов по производству возобновляемого метанола, которые, по прогнозам, будут производить более восьми миллионов метрических тонн зеленого метанола ежегодно к 2027 году (это в дополнение к более чем 35 коммерчески действующим заводам по производству возобновляемого метанола по всему миру). .
Выбросы угарного газа очень низкие и составляют < 1 г/кВтч. Кроме того, если в качестве сырья используется возобновляемый метанол, углеродоемкость будет очень низкой или даже отрицательной для большинства типов биогенного возобновляемого метанола (рис. 4), что обеспечивает как экологические преимущества, так и вклад в энергетическую безопасность. По данным Института метанола, в мире реализуется более 80 проектов по производству возобновляемого метанола, которые, по прогнозам, будут производить более восьми миллионов метрических тонн зеленого метанола ежегодно к 2027 году (это в дополнение к более чем 35 коммерчески действующим заводам по производству возобновляемого метанола по всему миру). .
Рис. 4: Углеродоемкость водорода, полученного различными способами для получения возобновляемого метанола
Конструкция генератора метанола в водород (в любом масштабе) такова, что у нас есть уникальная возможность экономично улавливать двуокись углерода гораздо более экономично. чем попытка захвата углекислого газа из выхлопных газов. Удаление двуокиси углерода из выбросов, даже частичное, снизит углеродоемкость традиционного «серого» метанола и может довести углеродоемкость водорода из возобновляемого метанола до сильно отрицательных значений.
Удаление двуокиси углерода из выбросов, даже частичное, снизит углеродоемкость традиционного «серого» метанола и может довести углеродоемкость водорода из возобновляемого метанола до сильно отрицательных значений.
Поток отходящих газов, обедненных водородом, внутри генератора водорода (отбракованных в очистителе водорода) содержит более 80% общего объема выбросов углерода в виде двуокиси углерода. Кроме того, этот газовый поток находится под повышенным давлением (от 240 фунтов на кв. дюйм до 290 фунтов на кв. дюйм изб.) и его состав составляет 45-50% углекислого газа. Element 1 и Aramco участвуют в совместной программе сотрудничества с 2021 года для оценки технических и экономических аспектов применения улавливания углерода в этом потоке отходящих газов. Сейчас мы начинаем закупать компоненты и планируем до конца этого года собрать первый прототип системы, рассчитанный на производство 235 кг водорода в день.
Хотя улавливание углерода нецелесообразно для всех коммерческих применений, оно имеет смысл в некоторых случаях (таких как морские применения и более крупная стационарная генерация водорода и распределенная электроэнергия), когда улавливаемый углекислый газ имеет рыночную стоимость или может быть изолирован с экономической точки зрения.
Таким образом, экономичное производство водорода высокой чистоты в месте использования с помощью генератора метанола в водород использует привлекательные характеристики водорода как энергоемкого и возобновляемого топлива, в то же время в значительной степени смягчая проблемы хранения и транспортировки, которые препятствуют водород от достижения широкого использования как в стационарных, так и в мобильных приложениях.
Обратите внимание, что эта статья также появится в четырнадцатом выпуске нашего ежеквартального издания.
Перейдите на страницу профиля этого партнера, чтобы узнать больше о них
Де : [email protected]
Веб-сайт: Посетите веб-сайт
Электролизеры воды / генераторы водорода
Электролизеры воды / генераторы водорода
Имея более 3500 надежных и экономичных электролизеров, установленных по всему миру, компания Nel Hydrogen является признанным лидером в области электролиза воды на щелочных и протонообменных мембранах (PEM).
С момента нашего основания в 1927 году непрерывные исследования и разработки способствовали постоянному совершенствованию технологии электролизеров, устанавливая эталон на рынке. Наша технология электролиза сегодня пользуется большим уважением за ее прочность, надежность и энергоэффективность.
Наши электролизеры воды — превосходный выбор для промышленности, транспорта и приложений Power-to-X. Многочисленные, масштабируемые, гибкие, модульные линейки продуктов предназначены для удовлетворения любых требований клиентов.
Чтобы узнать больше о рынках, которые мы обслуживаем, нажмите здесь:
Контейнерные серии M
В ситуациях, когда производственные площади ограничены, клиенты могут захотеть разместить свои электролизеры снаружи. В других случаях клиенты могут захотеть настроить электролизер для работы под ключ. Электролизеры MC поставляются с платформой серии M в контейнерной форме для легкой установки на открытом воздухе. Типичные области применения включают хранение возобновляемой энергии, промышленный технологический газ и водородное топливо.
Серия A
Самые энергоэффективные в мире электролизеры серии A потребляют всего 3,8 кВтч/Нм3 произведенного газообразного водорода, до 2,2 МВт на блок. Электролизеры серии A могут производить до 3880 нм3/ч водорода или чуть более 8 тонн в день.
Серия M
Серия M отличается малым временем отклика и производственной гибкостью, что делает ее идеальной для производства водорода с использованием возобновляемых источников энергии. При минимальных требованиях к техническому обслуживанию и размещению электролизеры серии М могут производить до 4,920 Нм³/ч газообразного водорода чистотой 99,9998 % по запросу. Благодаря масштабируемой модульной конструкции, которую можно разместить в контейнере, эти системы предлагают решения, которые хорошо подходят для различных промышленных, топливных и возобновляемых источников энергии.
Серия C
Электролизеры серии C идеально подходят для различных промышленных применений. Производя до 30 Нм³/ч газообразного водорода с чистотой 99,9998%, эти установки заменяют потребность в трейлерах с водородными трубами или хранилищах жидкого водорода.
