- Водород / Хабр
- Как получить водород из воды. Водород из воды
- Отопление наших домов водородом
- Самодельный водород
Водород / Хабр
Начало
По революционным праздникам в СССР проводились торжественные демонстрации. Для взрослых участие нередко было обязательным. Ну а детям — им, что ни праздник, всё в радость. Торжественная обстановка, можно помаршировать со взрослыми в стройных колоннах, покричать «ура», поразмахивать красными флажками и надувными шариками…
Шарики. Кажется, именно с них-то всё и началось.
Согласно советским открыткам, демонстрация должна была выглядеть как-то так:
[Image source: https://открытки.kz/poisk-демонстрация/otkritki-2-Открытка-картинка-ретро-1-мая-демонстрация.html]В общем и целом, где-то так оно и было. За одним исключением: наши шарики в воздух не поднимались. Они тупо свисали на своих ниточках, и чтобы участвовать в празднике, приходилось непрерывно размахивать поднятыми руками. Что мне, что другим детям. Ни у кого во всей колонне шарики не тянулись вверх.
— Почему? — спросил я у мамы.
— Потому что их нужно надувать специальным газом — объяснила она.
Сегодня я знаю, что этот газ — гелий. Тогда не было смысла даже начинать размышлять о том, как его раздобыть. Слово «отсутствует» не вполне передаёт безнадёжность затеи, особенно для тех, кто вырос в наше время. В мелком городке на окраине СССР, далёком от культурных и индустриальных центров, «гелий» относился не к физическому миру, а к ярким картинкам из телевизора, книг, открыток, и научной фантастики. С равным успехом можно было мечтать раздобыть выдох единорога или грибы с Плутона.
Однако ж мне хотелось летающий шарик. Есть нечто гипнотизирующее в предмете, который сначала лежит в ладонях, а потом соприкасается с облаками за пару километров пространства над головой. Э, да что там «километров»! Во всём городе трудно было найти здание выше нашей четырёхэтажки, и крыша её олицетворяла для нас линию Кармана, отделяя пространство земное от недостижимого. А были над ней ещё и макушки близлежащих гор, и редкие самолёты Як-40, и перистые облака на границе со стратосферой. И до всего этого в принципе можно было «дотянуться» простым шариком.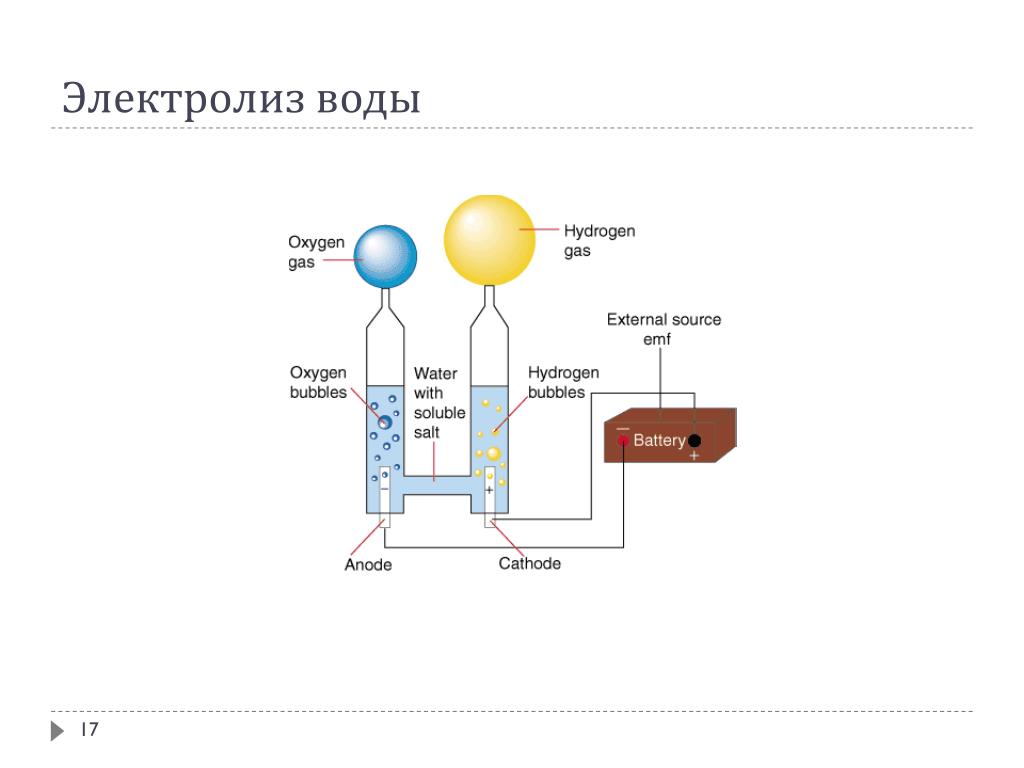
Довольно скоро я вычитал название подходящей замены гелию: водород. Самый лёгкий из всех газов, легче даже гелия, он вполне годился на роль наполнителя аэростата. Водород легко получить из простых химикатов. Берём бутылку. Накидываем в неё кусочков цинка или даже алюминия. Заливаем разбавленной соляной кислотой. Надеваем на горлышко шарик, ждём полчасика, и…
…только вот соляной кислоты у меня не было. И равноценной замены тоже. И купить её было негде. Во всяком случае, не в тех магазинах, что наблюдались вокруг. В них ни черта не было. На закате СССР люди не «покупали» вещи, они «доставали» их через правильных знакомых. У меня таких знакомых не было. Я был всего лишь ребёнком.
В 1989-м мама, убедившись, что я знаю химию достаточно, чтобы быть осторожным, обратилась к знакомому автолюбителю. Тот отлил полстакана серной кислоты прямо из аккумулятора в мою бутылку, и я отвёз её домой в трясучем автобусе через полгорода в обычной авоське. Такие вот простые были нравы.
На тринадцатилетие я пригласил троих друзей. Мы накидали цинка из старых батареек в бутылку, залили разбавленной кислотой, надели поверх шарик и наддули его до заранее вычисленного диаметра. Прицепили к нитке записку с моим телефонным номером и вышли на улицу. Было уже темно. Стоял поздний январский вечер. Брюхо облаков проползало в каких-то десятках метров над нами. Шарик на верёвочке тянулся к ним. Мы его выпустили. Кто-то подпрыгнул, пытаясь схватить его, но не смог. За какие-то секунды красное пятно поднялось в воздух, достигло тёмных облаков и растворилось в них.
На другой день областная газетка «Ленинский Путь» опубликовала заметку про «НЛО красного цвета» над Сулейман-горой, что торчала из центра города. Слабый ветер в ту ночь действительно дул к центру. Мог ли наш доморощенный аэростат оказаться тем самым НЛО? Маловероятно, конечно. Но время от времени я хихикаю, размышляя об этой комичной возможности.
Шарик взлетел, но это не было достижением. Это было чудом. Ведь кислоту для него «достали», и я не мог воспроизвести это чудо. Поэтому я продолжал искать. Для подростка я выучил химию — ну или некоторые её разделы — весьма даже недурно. Я знал с десяток способов получения водорода. К сожалению, все они требовали недоступных химикатов или оборудования, либо же были настолько опасны, что даже в тогдашнем своём энтузиазме я не рисковал затевать нечто подобное. Моя задача выглядела как попытка сложить слово СЧАСТЬЕ из букв Ж, П, и О. То есть, приборов и материалов со свалок и стремительно пустеющих полок позднесоветских магазинов. То было время падения СССР. Советская экономика, не слишком эффективная и в лучшие-то годы, загибалась в последних конвульсиях:
Это было чудом. Ведь кислоту для него «достали», и я не мог воспроизвести это чудо. Поэтому я продолжал искать. Для подростка я выучил химию — ну или некоторые её разделы — весьма даже недурно. Я знал с десяток способов получения водорода. К сожалению, все они требовали недоступных химикатов или оборудования, либо же были настолько опасны, что даже в тогдашнем своём энтузиазме я не рисковал затевать нечто подобное. Моя задача выглядела как попытка сложить слово СЧАСТЬЕ из букв Ж, П, и О. То есть, приборов и материалов со свалок и стремительно пустеющих полок позднесоветских магазинов. То было время падения СССР. Советская экономика, не слишком эффективная и в лучшие-то годы, загибалась в последних конвульсиях:
Самое обидное, что решение той задачи у меня в руках было. Более того, оно физически следовало за мной почти всю мою жизнь, путями иногда странно переплетёнными с моими. Но узнал я об этом только много десятилетий спустя.
Как так получилось?
За что точно можно хвалить СССР, так это за популяризацию научного и технического знания. Тысячи книг и брошюрок по физике, математике, химии, инженерным вопросам печатались громадными тиражами и продавались по копеечным ценам. Нередко они объясняли весьма нетривиальные концепции в простых и ясных терминах. Многие старались дать читателю систему взаимосвязанных знаний, нежели гору фактиков. А потому, если часть выученного забывалась, её иногда удавалось восстановить по «перекрёстным ссылкам» из сохранившегося в памяти.
Разумеется, барахло тоже печаталось. Тоннами. Но и высококачественные книги среди него встречались. Их искали и ценили.
Вот одна из них, за авторством Н. П. Агафошина[20]:
Брошюрка доходчиво излагает основы физики и химии металлов и сплавов. Напечатанная в 1967-м году в Смоленске, за тысячи километров от нашего города, она каким-то образом оказалась в Средней Азии и была куплена отцом. К сожалению, он не успел отдать её мне сам. Но это сделала бабушка. Я прочёл книжку с великим интересом, и если я что-то помню сегодня про слова «электрохимия», «солидус-ликвидус» и «комплексы металлов», то в основном благодаря этому изданию.
К сожалению, он не успел отдать её мне сам. Но это сделала бабушка. Я прочёл книжку с великим интересом, и если я что-то помню сегодня про слова «электрохимия», «солидус-ликвидус» и «комплексы металлов», то в основном благодаря этому изданию.
А потом в 1989-91-м годах по Средней Азии прокатилась волна погромов. Заявленная цель была благородна: устранение расовой несправедливости. Результат предсказуемо непригляден: трупы в городской реке и страх ещё худших притеснений. Почти все белые люди уехали. Я сел на поезд и отправился в Новосибирск изучать физику, а мама двинулась на другой конец России в Смоленск. Книги мы, разумеется, не бросили.
Так брошюрка Агафошина вернулась в свой родной город. Навещая маму на летних каникулах, я иногда прогуливался по улице Гагарина, где располагалась типография. В те дни, однако, я занимался физикой, и проблема получения водорода в домашних условиях мало меня волновала.
Тем не менее, ответ на неё в книге содержался. Ну как «ответ», скорее намёк. Подсказка. Но достаточная. Заметил я её, однако, много, много позже, когда жил уже в США.
Подсказка. Но достаточная. Заметил я её, однако, много, много позже, когда жил уже в США.
Решение
В 2016-м году мама, приехав в гости, привезла с собой «Металлы и сплавы». Под наплывом воспоминаний я принялся их перечитывать, и наткнулся вот на это:
Сноску видите? Про «ионы хлора и других галогенов»?
Как сказано, это ещё не решение. Но намёк прямейший. Химическая интуиция моя подпрыгнула и сказала: а что если долить раствор медного купороса (CuSO4) к раствору поваренной соли (NaCl), и кинуть туда алюминиевой проволоки? Ионы хлора разрушат защитную плёнку оксида на алюминии. «Голый» алюминий начнёт реагировать с водой, выделяя водород. А осаждающаяся на алюминии медь поддержит реакцию, создав окисляющий электрохимический потенциал на алюминии!
Ошибочные идеи могут вести к рабочим результатам. Реакция, на самом деле, протекает существенно иначе (об этом ниже). Но она идёт! Она производит водород из букв Ж, П, и О. Всё потребное для этого было вполне доступно в моём детстве:
Стеклянная бутылка.
 Из магазина или просто с улицы.
Из магазина или просто с улицы.Алюминиевая проволока. Из восхитительного мусорного ассорти на тротуарах любимого (не шучу!) города детства.
Вода, из крана.
Поваренная соль. Из магазина.
Медный купорос. По непонятной причине десятки его мешков валялись в любом хозмаге, среди по большей части пустых полок.
И шарик. Каковыми советская индустрия продолжала исправно снабжать население, несмотря ни на что.
Всё. Я мог сотворить это чудо ещё пацаном. Собрать друзей и запустить сколько угодно шариков в стратосферу.
Когда я понял это, то одновременно ржал от радости, и чуть не плакал. Потому что ничего изменить уже было нельзя. Не осталось ни того времени, ни тех людей, которым бы дорого было это чудо.
Но я решил: всё равно запущу. Пусть из всей нашей тусовки увижу это только я один — шарик должен полететь. Такие вопросы надо закрывать в физической реальности, независимо от срока давности. Если не для себя, то хотя бы для того ребёнка внутри, что хотел этого 30 лет назад.
Если не для себя, то хотя бы для того ребёнка внутри, что хотел этого 30 лет назад.
Поэтому к одному из загородных выездов с друзьями я подготовился особо.
Я купил химикаты, проволоку, рассчитал всё и взвесил:
Намешал растворов:
Слил всё в бутылку и нацепил поверх шарик:
Подождал (осторожно — реакция экзотермична, и бутылка греется так, что трудно держать в руках):
Дождался наполнения, вышел на улицу, выпустил шарик, и долго глядел вслед красному пятнышку, покуда оно не исчезло в облаках.
Шарик улетел, но вопрос остался: зачем я всё это написал?
Разумеется, не ради того, чтобы поделиться рецептом. Что в США, что в России сегодня можно получить водород множеством способов более надёжных и удобных, нежели описанный.
Заявить, что решения всех наших проблем — рядом, надо только смотреть внимательнее? В это я не верю. Масса жизненных ситуаций не имеют решений простых, и зачастую не имеют решений даже сложных. Или же решаются такими объездными кругалями, что лучше и не начинать.
Возможно, чтобы лишний раз показать: для осуществления некоторых желаний необходимо такое изменение сознания, которое делает неважными сами эти желания. Это похоже на правду. Будучи подростком, я ведь водил глазами по строчкам с подсказкой — но никакая химическая интуиция на неё тогда не отозвалась. А сегодня мне легко придумывается ещё несколько чертовски простых вещей, которые вполне можно и нужно было попробовать, но о которых я тогда и не подумал.
Или, быть может, всё проще, и когда закрываешь вопрос такой длительности, решение немного принадлежит… всем.
Делюсь.
Техническое приложение 1. Сеанс магии с разоблачением.
Так что же происходит в той бутылке?
Сама реакция известна давно и описана неоднократно. Но, к моему удивлению, её объяснения в массе своей не выдерживают даже поверхностной критики.
Чаще всего они сводятся к фразе «ионы хлора разрушают защитный слой алюминия, далее алюминий реагирует с водой». Однако как они его разрушают, и почему именно и только его? Эти вопросы обходятся. Хуже, данное описание очевидно неполно. Потому как если бы им всё ограничивалось, то алюминиевая вилка растворялась бы в обыкновенном огуречном рассоле! Чего, как мы знаем, не происходит.
Хуже, данное описание очевидно неполно. Потому как если бы им всё ограничивалось, то алюминиевая вилка растворялась бы в обыкновенном огуречном рассоле! Чего, как мы знаем, не происходит.
Более продвинутые гипотезы учитывают оседание меди на алюминии. Они справедливо отмечают, что это создаёт потенциал для гальванической коррозии и, таким образом, способствует реакции. Примерно так я исходно представлял механизм себе. Он почти наверняка имеет место, но его одного тоже недостаточно. Ибо тогда кусок алюминия, обёрнутый медной проволокой, и помещённый в солёную воду, принялся бы растворяться. А этого тоже не происходит.
Ряд источников предполагает, что ответ таится в образовании комплекса [CuCl4]2- и взаимодействии его с алюминием. Последнее действительно нетривиально, но не является необходимым. Ибо алюминий растворяется — с выделением водорода! — даже в разбавленном хлориде меди CuCl2, где комплекса [CuCl4]2- практически нет.
На чём я перейду, наконец, к тому, что мне лично кажется правильным объяснением. Или, по крайней мере, соответствующим всем наблюдаемым реакциям и их опробованным вариациям. Disclaimer: я не химик, за возможные ошибки не отвечаю.
===
Первым делом, конечно же, в смеси происходит реакция обмена. Я сознательно записываю её не в ионной, а в молекулярной форме, ибо так понятнее, хоть и не совсем корректно:
CuSO4 + 2NaCl <-> CuCl2 + Na2SO4 [1]
Косвенно это можно подтвердить, влив в смесь избыток NaCl и получив интенсивно-зелёный раствор, окрашенный ионами CuCl42-, которые не образовались бы без наличия CuCl2.
Дальше CuCl2 частично диссоциирует и реагирует с водой:
CuCl2 + H2O <-> CuOHCl + HCl [2]
Реакции способствует то, что гидроксиды и гидроксохлориды меди плохо растворимы. Поэтому, хотя равновесие в целом смещено влево, небольшие количества HCl из правой части всё-таки присутствуют.
Однократная диссоциация (CuCl2 -> (CuCl)+ + Cl—), вероятно, протекает легче, чем полная (CuCl2 -> Cu2+ + 2Cl—), что объясняет, почему серная кислота не возникает аналогичным образом с простым CuSO4.
Следующий шаг прост. Крошечные количества HCl атакуют оксидную «шкурку» алюминия и растворяют её:
Al2O3 + 6HCl -> 2AlCl3 + 3H2O [3]
Отметим, что соляной кислоты (HCl) в системе мало и на растворения всего алюминия не хватит. Однако это не нужно. Потому что дальше «обнажённый» алюминий просто реагирует с водой напрямую:
2Al + 6H2O -> 2Al(OH)3 + 3H2 [4]
Именно здесь образуется нужный нам водород!
Параллельно с этим разворачиваются вторичные процессы, делающие балансировку реакции весьма затруднительной:
2Al + 3Cu2+ -> 2Al3- + 3Cu [5] // Выпадение меди в осадок
2Al(OH)3 + 3Cu2+ -> 3Cu(OH)2 + 2Al3+ [6] // Образование тёмного осадка медных гидроксидов
Al(OH)3 + 3HCl -> AlCl3 + 3H2O [7] // «Выедание» HCl вторичными продуктами, из-за чего процесс водородообразования замедляется до черепашьей скорости задолго до исчерпания реагентов
Почти наверняка тут упущены тонкие детали. Так, на шаге [2] может образовываться несколько разных гидроксохлоридов меди. А при реакции алюминия со смесью реагентов должен возникать целый спектр гидроксидов, гидроксохлоридов, и гидрированных хлоридов. Но всё это на итог уже мало влияет. Водород выделяется.
Так, на шаге [2] может образовываться несколько разных гидроксохлоридов меди. А при реакции алюминия со смесью реагентов должен возникать целый спектр гидроксидов, гидроксохлоридов, и гидрированных хлоридов. Но всё это на итог уже мало влияет. Водород выделяется.
Дабы проверить свои догадки, я провёл несколько опытов.
1. Алюминий легко растворяется, с выделением водорода, в голубом разбавленном хлориде меди CuCl2, тем самым подтверждая, что комплексы CuCl42- не являются необходимыми для реакции:
Реакция алюминия с хлоридом меди. Камера смотрит сверху вниз на дно пробирки.2. Исходя из вышеприведённой логики, можно ожидать, что алюминий будет реагировать с выделением газа и с раствором FeCl3, ибо гидроксиды железа тоже плохорастворимы. Это действительно так:
3. Однако железо в растворе CuCl2 или его смеси с NaCl (практически) не растворяется:
То есть, кислотного агента, «раздевающего» алюминий, там столь мало, что на металл в целом он не влияет. Делает это вода. Которая хорошо взаимодействует с алюминием, но почти нет — с железом.
Делает это вода. Которая хорошо взаимодействует с алюминием, но почти нет — с железом.
4. По мере протекания реакции между Al и CuCl2 раствор становится молочно-непрозрачным, а на стенках формируется белый осадок. Стоит ожидать, что это Al(OH)3, согласно шагу [4].
И действительно, вливание нескольких капель уксуса просветляет раствор, косвенно подтверждая, что белый осадок — это именно Al(OH)3, реагирующий с уксусной кислотой примерно так: 2Al(OH)3 + 2CH3COOH -> 2Al(OH)2(CH3COO) + H2O:
Техническое приложение 2. Про «десяток способов».
Ибо знаю, что и спросят, и своих накидают. Поэтому записываю сразу.
1. Соляная кислота + цинк:
Zn + 2HCl -> ZnCl2 + H2
Или любой другой электропозитивный металл (железо, алюминий). Или любая другая разбавленная сильная кислота (серная, азотная). Которых, к сожалению, у меня не было.
2. Уксус + магний:
Mg + 2CH3COOH -> Mg(CH3COO)2 + H2
Идея та же, что и выше. Просто магний настолько электропозитивен, что согласен растворяться даже в относительно слабой уксусной кислоте.
Способ вполне рабочий и мы даже запустили им один шарик. Недостатков два. Во-первых, магний надо добывать на охраняемой свалке аэропорта, рискуя быть пойманным. Или выменивать его у тех, кто этим занимался. Во-вторых, то ли сам ацетат магния, то ли какие-то примеси в сплаве генерили в процессе получения водорода чудовищное количество пены, которую не удавалось толком сбить ни спиртом, ни солью. Отчего надувание шарика превращалось в танцы с бубном. Медленно, мучительно, грязно и ненадёжно.
3. Алюминий + сильная щелочь:
Al2O3 + 2NaOH -> 2NaAlO2 + H2O (разрушение оксида)
2Al + 6H2O -> 2Al(OH)3 + 3H2 (сам водород)
Al(OH)3 + NaOH -> Na[Al(OH)4] (вторичная реакция)
Все амфотерные металлы схожим образом реагируют в присутствии воды со щелочами как «кислоты», но из доступных лишь алюминий активно выделяет потом водород при контакте с водой. Вместо NaOH годится KOH, однако с раствором аммиака этот номер уже не проходит.
Вместо NaOH годится KOH, однако с раствором аммиака этот номер уже не проходит.
Проблема здесь всё та же: негде было достать сильную щелочь.
4. Разумеется, многие подумали: электролиз!
Разбалтываем в воде да хоть ту же поваренную соль, опускаем туда два электрода, пускаем ток, и собираем над катодом водород.
Оно действительно работает, но задачу не решает.
Первая причина очевидна. Водород, тупо выделяющийся над электродом, сам в шарик не соберётся. Чтобы его туда загнать, требуется давление в 30-50 мм ртутного столба. То есть, нужен герметичный прибор, позволяющий проводить электролиз под небольшим давлением. С разделением катода и анода. А это уже нетривиальная геометрия и сложное приборостроение. По тогдашним обстоятельствам, по крайней мере.
Вторая проблема более фатальна, хотя менее очевидна. Дело в том, что молекула у водорода очень мелкая. И подвижная. И легко диффундирует из шарика прямо сквозь стенку. Уже при объёме в три литра стандартный резиновый шарик теряет от этого плавучесть где-то через час. И скорость потери, как легко показать, пропорциональна четвёртой степени радиуса шарика. На практике это означает, что электролизный аппарат должен производить не менее где-то эдак литра водорода в час. Иначе потери сквозь стенки сравняются с поступлением раньше, чем вы наскребёте минимально необходимые для плавучести 2.5 литра.
И скорость потери, как легко показать, пропорциональна четвёртой степени радиуса шарика. На практике это означает, что электролизный аппарат должен производить не менее где-то эдак литра водорода в час. Иначе потери сквозь стенки сравняются с поступлением раньше, чем вы наскребёте минимально необходимые для плавучести 2.5 литра.
Литр водорода — это 1/20 моля. Чтобы восстановить этот водород из воды, надо вкачать в неё 2*(1/20) = 1/10 моля электронов. То есть, 1.6*10-19*6*1023*0.1 = 104 кулонов электричества. За час, он же 3600 секунд. Следовательно, через систему должен течь ток не менее 3 ампер, а с учётом неизбежных потерь — лучше пять-шесть. Однако типичные токи, реализуемые в небольших домашних или лабораторных электролизных установках, на порядок меньше. Задрать их, конечно, можно, но это опять уже серьёзная работа. Не для сборки на кухне.
5. А если не разделять газы?
Налить в бутылку раствор сульфата магния MgSO4. Опустить в неё два графитовых электрода, надеть поверх шарик и пустить ток. На электродах, фактически, будет идти реакция:
Опустить в неё два графитовых электрода, надеть поверх шарик и пустить ток. На электродах, фактически, будет идти реакция:
2H2O -> 2H2 + O2
Получающийся гремучий газ имеет молекулярную массу 12, что существенно легче воздуха. Надуваем им шарик и летим.
Или взлетаем. На воздух. Газ этот недаром гремучим зовётся. Уже тогда я прекрасно понимал, что достаточно искорки от статики — и можно остаться без шарика, оборудования, и без глаз. Я пробовать не стал и здесь настоятельно никому не рекомендую.
6. Обычное порошковое железо взаимодействует с водяным паром, давая водород:
2Fe + 3H2O -> Fe2O3 + 3H2
К сожалению, это уже эзотерика. Нужны трубки, по ним горячий пар, охладитель, всё это герметично. В общем, нарисовать и забыть.
7. Сюда же относится реакция между обычным углём и водой:
C + H2O -> CO + H2
Именно за счёт неё сваленная на солнышке куча мокрого угля может самовоспламениться. Увы, при доступных температурах (эдак до 100 градусов) скорость уж больно мизерная, чтобы надуть хоть что-то. Да и выделяющийся угарный газ — решительно не подарок.
Увы, при доступных температурах (эдак до 100 градусов) скорость уж больно мизерная, чтобы надуть хоть что-то. Да и выделяющийся угарный газ — решительно не подарок.
8. Алюминий + вода, катализированные ртутью:
Алюминий растворяется в ртути. Получившаяся амальгама не способна поддерживать на своей поверхности защитную плёнку алюминиевого оксида. Поэтому, если залить её водой, начнётся всё та же реакция растворения алюминия:
2Al + 6H2O -> 2Al(OH)3 + 3H2
Ртуть при этом не расходуется и может быть переиспользована. Добыть её в советсткие времена можно было из обычных медицинских градусников.
Но возиться с этим ядовитым металлом не хотелось. Так что на этой затее я тоже поставил крест.
Забавно, что похожую реакцию можно провести, заменив ртуть галлием. С алюминием этот металл тоже смешивается, и получившийся сплав реагирует с водой. Я интереса ради как-то проверил и подтверждаю: работает
Но непрактично. Скорость реакции очень неравномерна. Галлий в процессе частично расходуется (он окисляется на воздухе). Ну и достать его в советское время было ещё менее реально, чем гелий.
Скорость реакции очень неравномерна. Галлий в процессе частично расходуется (он окисляется на воздухе). Ну и достать его в советское время было ещё менее реально, чем гелий.
Дальнейшие способы в принципе являются вариациями уже перечисленных. С практической стороны, однако, для меня они были самостоятельными решениями, ибо доступность начальных реактивов, нежели весь путь преобразований, определял тогда доступность метода.
9. Сжигание ПВХ:
ПВХ, он же поливинилхлорид — это пластик состава (C2H3Cl)n. Из него делают оболочки проводов, кабелей, трубы, иногда синтетическую одежду и перчатки, некоторые виды линолеума, ну и обычную изоленту. Раздобыть пару кило этого пластика никогда не было проблемой.
Сгорание его приблизительно описывается уравнением:
(C2H3Cl)n + (5n/2)O2 -> 2nCO2 + nH2O + nHCl
Хлороводород, справа, видите? Основа соляной кислоты!
Возникает безумная идея. Разводим костерок. Палим в нём поливинилхлоридный мусор. Над костерком развешиваем кучу мокрых тряпок. Хлороводород, хорошо растворяющийся в воде, частично впитывается в эти тряпки, давая соляную кислоту. Которая потом выжимается в бутылку, ну и далее понятно.
Разводим костерок. Палим в нём поливинилхлоридный мусор. Над костерком развешиваем кучу мокрых тряпок. Хлороводород, хорошо растворяющийся в воде, частично впитывается в эти тряпки, давая соляную кислоту. Которая потом выжимается в бутылку, ну и далее понятно.
К счастью, уже тогда мне хватало ума понять, что вышеприведённое уравнение лишь приблизительно. И что на практике при горении ПВХ образуется злющий букетище побочных продуктов от «относительно» безвредного угарного газа до ядовитых и канцерогенных хлороргаников. Так что я не стал это пробовать. И вам не советую.
10. Медленный электролиз:
Если запихнуть в раствор медного купороса пару графитовых электродов, и неторопливо пропускать через них ток, на катоде будет выделяться медь. А на аноде разворачиваться следующая реакция:
SO4— — e— -> SO40 -> SO3 + (1/2) O2
Далее SO3 + H2O -> H2SO4
То есть, попросту говоря, будет образовываться серная кислота. И этот процесс можно вести неспеша. Днями. Прерываясь, когда надо. Пока не наберётся кислоты достаточно для запуска.
И этот процесс можно вести неспеша. Днями. Прерываясь, когда надо. Пока не наберётся кислоты достаточно для запуска.
Из всех вышеперечисленных этот путь — самый реальный и он действительно работает. Но я пришёл к нему уже под самый конец поисков и не успел масштабно применить.
Собственно, у меня всё. Спасибо всем, кто дочитал, и хорошего дня!
Ссылки
[10] Строго говоря, эта статья — вольный перевод рассказа, написанного сначала по-английски. Однако бесплатно он недоступен, автором его тоже являюсь я, и лишь случайность определила очерёдность языков написания. Так что проще считать её самостоятельной статьёй. Тем не менее, я должен указать английский исходник, так что вот он: Unforgettable — Stories That Stay With You Forever на Goodreads: https://www.goodreads.com/book/show/59113227-unforgettable—stories-that-stay-with-you-forever
[20] Николай Петрович Агафошин, «Металлы и сплавы», издательство «Просвещение», Смоленск, 1967.
[30] Скачать рассказ в PDF: https://1drv. ms/b/s!AhyC4Qz62r5BhPARYGIB4k1qv3gbYw?e=eHzQj8
ms/b/s!AhyC4Qz62r5BhPARYGIB4k1qv3gbYw?e=eHzQj8
Как получить водород из воды. Водород из воды
Водород — широко распространенный элемент. Благодаря своей уникальности он может выступать в качестве окислителя и в качестве восстановителя. Существует несколько методов получения водорода .
Промышленный метод получения водорода.
1. Электролиз водных растворов солей (поваренная соль NaCl ).
2. Пропускание паров поды над раскаленным коксом (Т = 1000 °С):
H 2 O + C = H 2 + CO ,
Реакция обратима!
Смесь (Н 2 , СО и Н 2 О ) называется водяным газом.
А на 2-ой стадии водяной газ пропускают над оксидом железа (III) при температуре около 450°С:
СО + Н 2 О = СО 2 + Н 2 ,
Часто эту реакцию называют реакцией сдвига.
3. Получение из природного газа. Основа — конверсия метана (основной компонент природного газа, СН 4 ) с водяным паром.
СН 4 + Н 2 О = СО 2 + 3Н 2 ,
Эту реакцию часто используют для получения водорода для реакции Габера (синтез аммиака).
4. Крекинг нефтяных продуктов.
Лабораторный метод получения водорода.
1. Под воздействием разбавленных кислот на металлы, которые стоят в ряду напряжения левее водорода.
Zn + HCl = ZnCl 2 + H 2 ,
2. Электролиз растворов кислот, щелочей на катоде выделяется водород.
3. Действие щелочей на цинк или алюминий:
2Al + 2NaOH + 6H 2 O = 2Na + 3H 2
4. Гидролиз гидридов:
NaH + H 2 O = NaOH + H 2 ,
5. Реакция кальция с водой:
Ca + 2H 2 O = Ca(ОН) 2 + H 2 .
Всем еще со школы известно, что водород в таблице Менделеева
занимает самое первое место и обозначается символом Н.
Изначально следует позаботиться о наличии под рукой всего
необходимого для химического эксперимента. Во-первых, нужно убедиться в том,
что пробирка для сбора водорода является полностью целой (даже самая маленькая
трещинка может испортить весь процесс).
Как только в колбе полностью завершится реакция, пробирку надо
сразу же закрыть очень плотной пробкой, которая держится верх дном, что поможет
предотвратить улетучивание более легкого водорода. Кстати, лучше всего это
проделать, продолжая ее край держать под водой. А вот для того чтобы проверить наличие
водорода, необходимо вытащить пробку, а затем к краю пробирки поднести тлеющую
лучинку.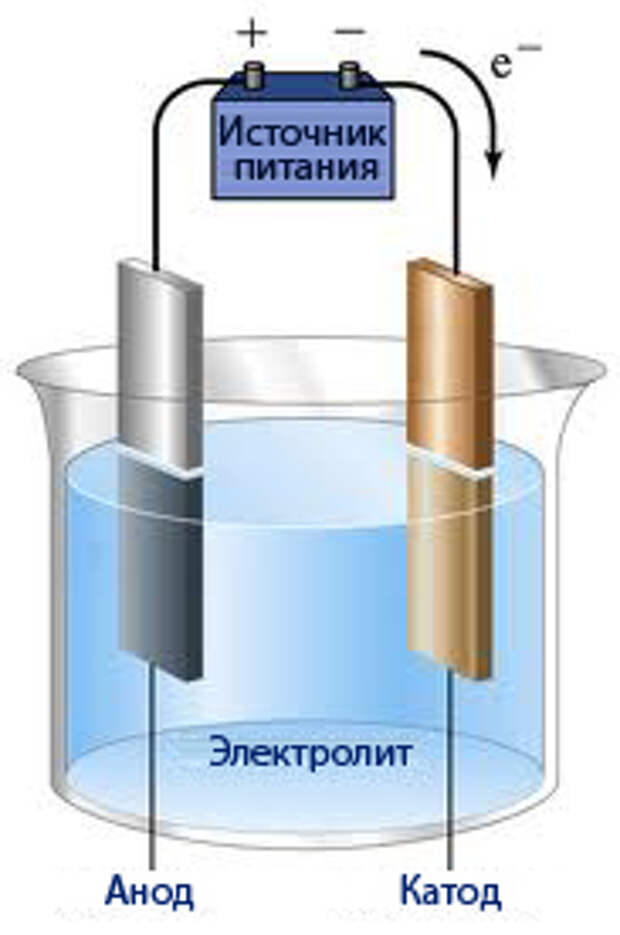
Также водород из воды в домашних условиях можно получить
следующим весьма не сложным методом. Изначально в бутылку из пластика объемом
в 1,5 литра набирается вода. После чего в этой воде растворяют едкий калий
(примерно 15 грамм)
или каустическую соль. Далее бутылку нужно поместить в кастрюлю, в которую
предварительно набирают воду. Теперь необходимо взять 40 сантиметровую
алюминиевую проволоку и порезать ее на кусочки, длина которых должна ровняться 5 сантиметрам.
Порезанная проволока кидается в бутылку, а на ее горловину надевается заранее
подготовленный резиновый шарик.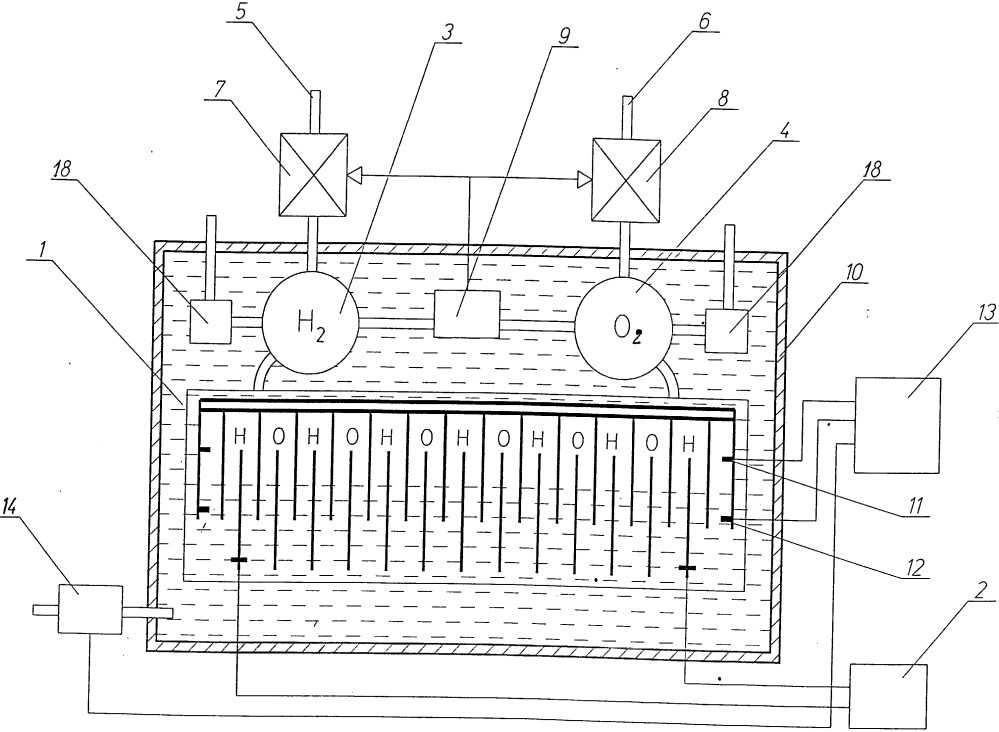
И наконец-то, водород из воды получают при помощи обычной
поваренной соли. Для этого в стеклянную емкость с узким горлышком засыпают соль
в размере пяти больших ложек и хорошо размешивают. После чего берется провод из
меди и просовывается в шприц со стороны поршня. Этот участок необходимо хорошо
герметизировать при помощи клея. Далее шприц
опускают в емкость с соляным раствором и постепенно заполняют его. Медный
провод надо подключить к отрицательному выводу аккумулятора 12 Вольт. В итоге
реакции электролиза, возле проводка начнет выделяться водород, который
вытесняется из шприца соляным раствором. Как только медный провод перестанет
контактировать с соленой водой, реакция полностью завершиться. Вот так можно с
помощью довольно простых методов самостоятельно получить водород из воды.
Актуальность этого вопроса на сегодняшний день достаточно высока по причине того, что сфера использования водорода чрезвычайно обширна, а в чистом виде он практически нигде в природе не встречается. Именно поэтому было разработано несколько методик, позволяющих осуществлять добычу этого газа из других соединений посредством химических и физических реакций. Об этом и рассказывается в приведенной статье.
Способы получения водорода в промышленных условиях
Добыча путем конверсии метана . Вода в парообразном состоянии, предварительно нагретая до 1000 градусов по Цельсию, смешивается с метаном под давлением и в присутствии катализатора. Способ этот интересный и проверенный, также надо отметить, что он постоянно совершенствуется: ведется поиск новых катализаторов, более дешевых и эффективных.
Рассмотрим самый древний метод получения водорода — газификацию угля . При условии отсутствия доступа воздуха и температуре в 1300 градусов Цельсия, нагревают уголь и водяной пар. Таким образом, происходит вытеснение водорода из воды, и получается углекислый газ (водород будет наверху, углекислый газ, также получаемый в результате проводимой реакции, – внизу). Таким будет разделение газовой смеси, все очень просто.
При условии отсутствия доступа воздуха и температуре в 1300 градусов Цельсия, нагревают уголь и водяной пар. Таким образом, происходит вытеснение водорода из воды, и получается углекислый газ (водород будет наверху, углекислый газ, также получаемый в результате проводимой реакции, – внизу). Таким будет разделение газовой смеси, все очень просто.
Получение водорода путем электролиза воды считается самым простым вариантом. Для его осуществления необходимо залить в емкость раствор соды, поместить также туда два электрических элемента. Один будет заряжен положительно (анод), а второй – отрицательно (катод). При подаче тока водород отправится на катод, а кислород — на анод.
Electrolysis of WaterПолучение водорода по методике частичного окисления . Для этого используется сплав алюминия и галлия. Его помещают в воду, что приводит к образованию водорода и оксида алюминия в процессе реакции. Галлий необходим для того, чтобы реакция произошла в полном объеме (этот элемент не позволит алюминию окислиться преждевременно).
В последнее время приобрела актуальность
Chlamydomonas
Не стоит забывать и еще один старый, проверенный метод добычи водорода, который заключается в использовании разных щелочных элементов и воды. В принципе, эта методика осуществима в лабораторных условиях при наличии необходимых мер безопасности. Таким образом, в ходе реакции (она протекает при нагревании и с катализаторами) образуется оксид металла и водород. Остается только его собрать.
Получить водород путем взаимодействия воды и угарного газа можно только в промышленных условиях. Образуется углекислый газ и водород, принцип их разделения описан выше.
Carbon monoxide
Возможно ли получить водород в лабораторных или домашних условиях?
Сделать это можно, однако лучше не стоит.
Для того чтобы добыть водород в домашних условиях, используется несколько реагентов: медный купорос, кухонная соль, алюминий и вода. Сам процесс включает в себя несколько этапов.
- Необходимо смешать раствор купороса с раствором хлорида натрия, в результате чего получится раствор зеленого цвета.
- В приготовленный раствор помещаем алюминий.
- Скопившиеся вокруг алюминия пузырьки – не что иное, как водород. Когда алюминиевая фольга покроется красным налетом, это будет свидетельствовать о том, что медь полностью вытеснена алюминием из раствора.

Опять-таки, если вы решили работать над получением водорода в домашних условиях, то необходимо позаботиться о том, чтобы в результате вашей деятельности не пострадали окружающие. показано, какие интересные и безопасные опыты с водородом можно провести дома.
Вам понадобится
- пластиковая бутылка емкостью 1,5 литра, резиновый шарик, кастрюля с водой, гидроксид калия или гидроксид натрия (каустическая сода, едкий натр), 40 сантиметров проволоки из алюминия, кусочек цинка, стеклянная емкость с узким горлышком, раствор соляной кислоты, резиновый шарик, аккумулятор 12 Вольт, провод из меди, провод из цинка, стеклянный сосуд, вода, поваренная соль, клей, шприц.
Инструкция
Заполните наполовину водой пластиковую бутылку. Киньте в бутылку и растворите в воде 10-15 грамм едкого натра или соды. Поставьте бутылку в кастрюлю с водой. Нарежьте алюминиевую проволоку кусочками по 5 сантиметров длиной и киньте в бутылку. Наденьте на горловину бутылки резиновый шарик.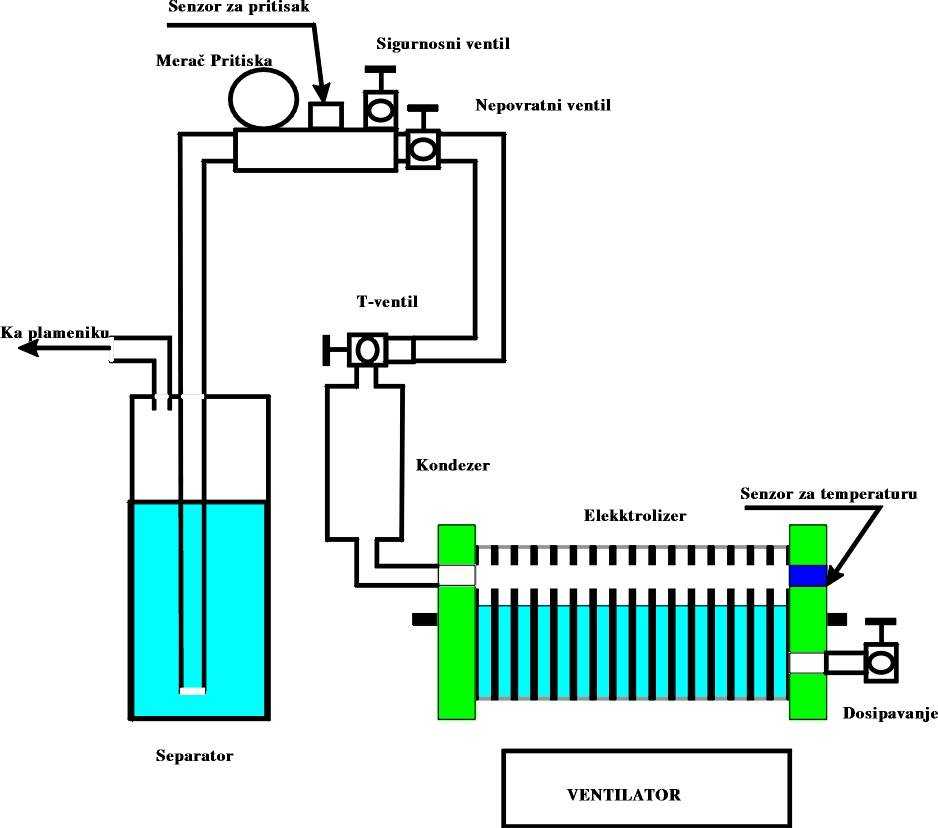 Выделяемый во время реакции с раствором щелочи будет в резиновом шарике. Эта происходит с бурным выделением — будьте осторожны!
Выделяемый во время реакции с раствором щелочи будет в резиновом шарике. Эта происходит с бурным выделением — будьте осторожны!
Налейте в стеклянную емкость соляной и киньте в нее цинк. Наденьте на горловину стеклянной емкости воздушный шарик. Выделяемый во время реакции с соляной кислотой водород будет собираться в воздушном шаре.
Налейте в стеклянную емкость воду и размешайте в ней 4–5 столовых ложек поваренной соли. Затем просуньте в шприц со стороны поршня медный провод. Герметизируйте это место клеем. Опустите шприц в сосуд с соляным раствором и отодвигая поршень, заполните шприц. Подключите медный провод к отрицательному выводу аккумулятора. Опустите рядом со шприцом в раствор соли цинковый провод и подключите его к положительному выводу аккумулятора. В результате реакции электролиза около медного провода выделяется водород, который вытесняет , контакт медного провода с соляным раствором прервется, и реакция прекратится.
Современное название водороду – гидроген, дал французский знаменитый химик Лавуазье. Название обозначает – гидро (вода) и генез (рождающий). Открыл «горючий воздух», как его раньше называли, Кавендиш в 1766 году, он же и доказал, что водород легче воздуха. В школьной программе по химии присутствуют уроки, в которых рассказывается не только об этом газе, но и способе его получения.
Название обозначает – гидро (вода) и генез (рождающий). Открыл «горючий воздух», как его раньше называли, Кавендиш в 1766 году, он же и доказал, что водород легче воздуха. В школьной программе по химии присутствуют уроки, в которых рассказывается не только об этом газе, но и способе его получения.
Вам понадобится
- Колба Вюрца, гидроксид натрия, алюминий в гранулах и пудра, мерный стакан, алюминиевая ложка, штатив,капельная воронка. Защитные очки и перчатки, лучина, зажигалка или спички.
Инструкция
Первый способ.
Возьмите колбу Вюрца, в которой к горловине припаяна стеклянная отводная трубка, и капельную воронку. Соберите систему на штативе, прикрепив колбу зажимом и установив ее на поверхность стола. Сверху в нее вставьте капельную воронку с краником.
Проверьте плотное закрепление всех системы – колбы Вюрца и зажима. Возьмите . Он должен быть в гранулах. Положите его в колбу. Налейте в капельную воронку более-менее насыщенный раствор . Приготовьте две емкости для сдерживания , а также лучину и зажигалку или спички, чтобы ее поджечь.
Влейте из капельной воронки в колбу Вюрца гидроксид натрия, для этого откройте кран на воронке. Подождите, через некоторое начнется выделение водорода. Водород, с небольшим содержанием , заполнит колбу полностью. Чтобы ускорить этот процесс, нагрейте колбу Вюрца снизу при помощи горелки.
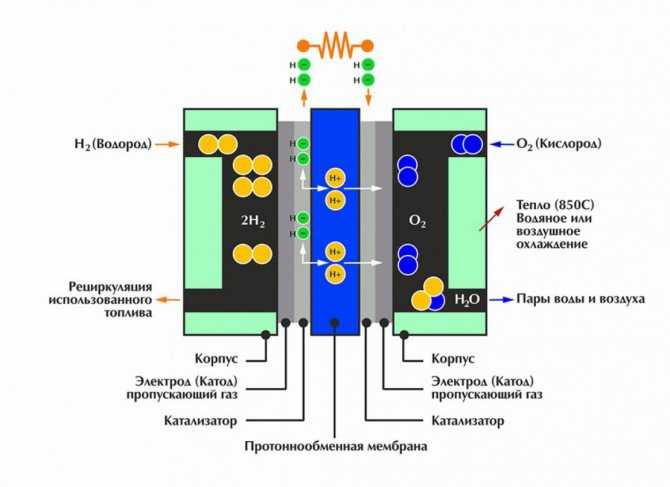
Электролиз воды один из наиболее известных и хорошо исследованных методов получения водорода. Он обеспечивает получение чистого продукта (99,6-99,9% H 2) в одну технологическую ступень. В производственных затратах на получение водорода стоимость электрической энергии составляет примерно 85%.
Электролиз воды один из наиболее известных и хорошо исследованных методов получения водорода . Он обеспечивает получение чистого продукта (99,6-99,9 % Н 2) в одну технологическую ступень. Экономика процесса в основном зависит от стоимости электроэнергии. В производственных затратах на получение водорода стоимость электрической энергии составляет примерно 85 % .
Этот метод получил применение в ряде стран, обладающих значительными ресурсами дешевой гидроэнергии. Наиболее крупные электрохимические комплексы находятся в Канаде, Индии, Египте, Норвегии, но созданы и работают тысячи более мелких установок во многих странах мира. Важен этот метод и потому, что он является наиболее универсальным в отношении использования первичных источников энергии. В связи с развитием атомной энергетики возможен новый расцвет электролиза воды на базе дешевой электроэнергии атомных электростанций. Ресурсы современной электроэнергетики недостаточны для получения водорода в качестве продукта для дальнейшего энергетического использования. Если электроэнергию получать за счет наиболее дешевой атомной энергии, то при КПД процесса получения электроэнергии, равном 40 % (в случае быстрых реакторов-размножителей) и КПД процесса получения водорода электролизом даже 80 %, полный КПД электролизного процесса составит 0,8-0,4 = 0,32, или 32 %. Далее, если предположить, что электроэнергия составляет 25 % полного производства энергии, а 40 % электроэнергии расходуется на электролиз, тогда вклад этого источника в общее энергообеспечение составит в лучшем случае 0,25Х X 0,4-0,32 = 0,032, или 3,2%.
Наиболее крупные электрохимические комплексы находятся в Канаде, Индии, Египте, Норвегии, но созданы и работают тысячи более мелких установок во многих странах мира. Важен этот метод и потому, что он является наиболее универсальным в отношении использования первичных источников энергии. В связи с развитием атомной энергетики возможен новый расцвет электролиза воды на базе дешевой электроэнергии атомных электростанций. Ресурсы современной электроэнергетики недостаточны для получения водорода в качестве продукта для дальнейшего энергетического использования. Если электроэнергию получать за счет наиболее дешевой атомной энергии, то при КПД процесса получения электроэнергии, равном 40 % (в случае быстрых реакторов-размножителей) и КПД процесса получения водорода электролизом даже 80 %, полный КПД электролизного процесса составит 0,8-0,4 = 0,32, или 32 %. Далее, если предположить, что электроэнергия составляет 25 % полного производства энергии, а 40 % электроэнергии расходуется на электролиз, тогда вклад этого источника в общее энергообеспечение составит в лучшем случае 0,25Х X 0,4-0,32 = 0,032, или 3,2%. Следовательно, электролиз воды, как метод получения водорода для энергоснабжения может рассматриваться в строго ограниченных рамках. Однако как метод получения водорода для химической и металлургической индустрии его следует иметь на технологическом вооружении, поскольку при определенных экономических условиях он может быть использован в крупнопромышленном масштабе.
Следовательно, электролиз воды, как метод получения водорода для энергоснабжения может рассматриваться в строго ограниченных рамках. Однако как метод получения водорода для химической и металлургической индустрии его следует иметь на технологическом вооружении, поскольку при определенных экономических условиях он может быть использован в крупнопромышленном масштабе.
Электролиз с успехом может быть использован на гидростанциях или в тех случаях, когда тепловые и атомные электростанции имеют избыточные мощности, и получение водорода является средством для использования, хранения и накопления энергии. Для этой цели могут быть использованы мощные электролизеры производительностью до 1 млн. м 3 водорода в сутки. На крупном заводе электролиза воды мощностью 450 т/сут и выше расход электроэнергии на 1 м 3 водорода может быть доведен до 4-4,5 кВт-ч. При таком расходе электроэнергии в ряде энергетических ситуаций электролиз воды даже в современных условиях сможет стать конкурентоспособным методом получения водорода .
Электрохимический метод получения водорода из воды обладает следующими положительными качествами: 1) высокая чистота получаемого водорода – до 99,99% и выше; 2) простота технологического процесса, его непрерывность, возможность наиболее полной автоматизации, отсутствие движущихся частей в электролитической ячейке; 3) возможность получения ценнейших побочных продуктов – тяжелой воды и кислорода; 4) общедоступное и неисчерпаемое сырье – вода; 5) гибкость процесса и возможность получения водорода непосредственно под давлением; 6) физическое разделение водорода и кислорода в самом процессе электролиза.
Во всех процессах получения водорода разложением воды в качестве побочного продукта будут получаться значительные количества кислорода. Это даст новые стимулы его применения. Он найдет свое место не только как ускоритель технологических процессов, но и как незаменимый очиститель и оздоровитель водоемов, промышленных стоков. Эта сфера использования кислорода может быть распространена на атмосферу, почву, воду. Сжигание в кислороде растущих количеств бытовых отходов сможет решить проблему твердых отбросов больших городов.
Сжигание в кислороде растущих количеств бытовых отходов сможет решить проблему твердых отбросов больших городов.
Еще более ценным побочным продуктом электролиза воды является тяжелая вода – хороший замедлитель нейтронов в атомных реакторах. Кроме того, тяжелая вода используется в качестве сырья для получения дейтерия, который в свою очередь является сырьем для термоядерной энергетики.
Электролитическое разложение воды.
2 H 2 O = 2 H 2 + O 2
Чистая вода практически не проводит тока, поэтому к ней прибавляются электролиты (обычно КОН). При электролизе водород выделяется на катоде. На аноде выделяется эквивалентное количество кислорода, который, следовательно, в этом методе является побочным продуктом.
Получающийся при электролизе водород очень чист, если не считать примеси небольших количеств кислорода, который легко удалить пропусканием газа над подходящими катализаторами, например над слегка нагретым палладированным асбестом. Поэтому его используют как для гидрогенизации жиров, так и для других процессов каталитического гидрирования. Водород, получаемый этим методом довольно дорог.
Водород, получаемый этим методом довольно дорог.
Отопление наших домов водородом
Использование ископаемого топлива для обогрева наших домов, предприятий и зданий больше не является вариантом, если мы хотим достичь нулевых выбросов углерода к 2050 году. Теперь мы должны искать альтернативные источники энергии с низким или нулевым выбросом углерода, и водород является одним из них. из самых перспективных вариантов.
Почему нам нужны новые источники энергии для обогрева наших домов?
Природный газ составляет почти 85% топлива, используемого для отопления и приготовления пищи в домах Великобритании и около 40% в домах США. Но в качестве ископаемого топлива природный газ (в основном метан) производит выбросов парниковых газов при сжигании, а это означает, что значительная часть наших выбросов приходится на отопление наших домов и предприятий, нагрев воды или приготовление пищи.
В Великобритании на сжигание природного газа в качестве источника топлива дома, на работе и в промышленности приходится 37 % 1 всех выбросов двуокиси углерода (CO 2 ), 18 % которых приходится на бытовое использование.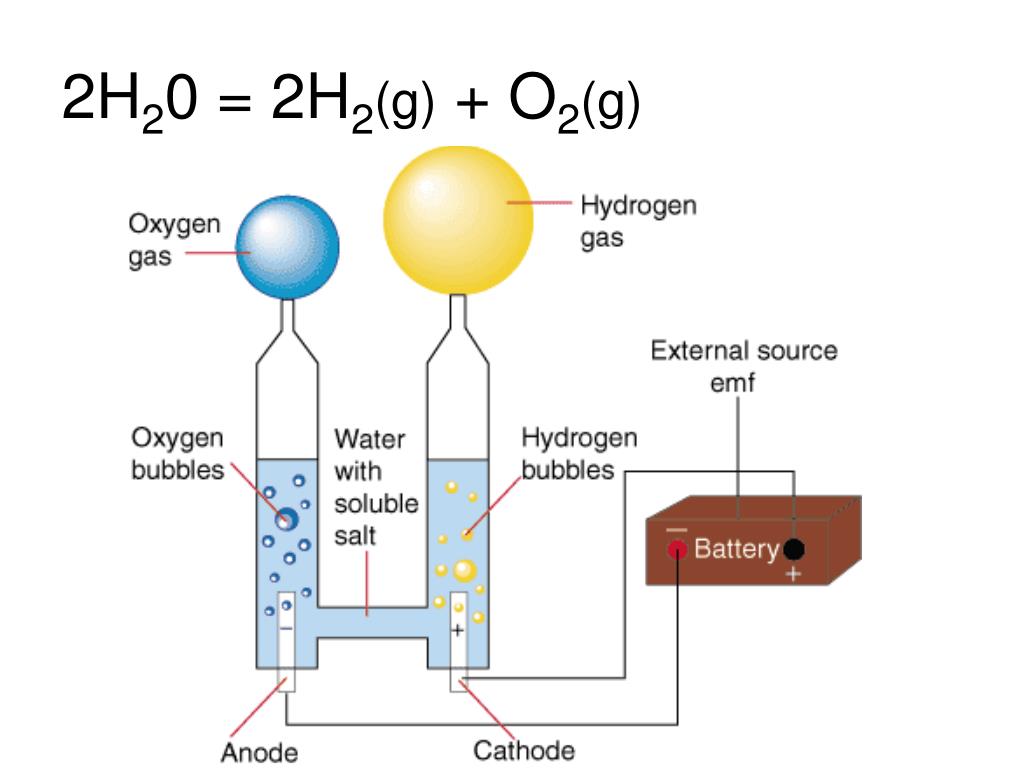 Это число составляет 48% в США, из которых 13% приходится на жилой и коммерческий контекст. 2
Это число составляет 48% в США, из которых 13% приходится на жилой и коммерческий контекст. 2
Чтобы достичь цели по чистому нулю к 2050 году , крайне важно найти другие источники топлива, которые производят низкий или нулевой уровень выбросов, и водород считается идеальной альтернативой. Одной из основных задач является производство водорода в достаточно больших масштабах, чтобы его можно было использовать в коммерческих целях на национальном уровне.
Почему водород рассматривается как топливо для отопления?
Водород — самый распространенный элемент во Вселенной, поэтому его много. В отличие от ископаемого топлива (при сгорании которого образуются вредные выбросы), единственным отходом от сжигания водорода является водяной пар. Таким образом, использование его для отопления может иметь огромное значение для наших выбросов углерода и сыграть решающую роль в достижение чистого нуля.
Водород бывает разных «цветов» , в зависимости от метода его производства. Самым чистым из них является зеленый водород, который производится с использованием электричества из возобновляемых источников энергии, таких как энергия солнца или ветра.
Самым чистым из них является зеленый водород, который производится с использованием электричества из возобновляемых источников энергии, таких как энергия солнца или ветра.
Зеленый водород в настоящее время составляет небольшой процент используемого водорода; поскольку спрос все еще низок, производство дорого. Но так же, как энергия ветра снизилась в цене, зеленый водород будет дешеветь по мере того, как он станет более распространенным.
Подача водорода в дома
Чтобы доставить этот чистый газообразный водород в наши дома, мы должны убедиться, что бытовые приборы, такие как бойлеры, кухонные приборы и газовые плиты, готовы к работе с водородом. Производители уже построили водородные котлы, поэтому технология доступна — просто требуется широкомасштабное стратегическое переключение под централизованным руководством правительства.
Подобно переходу с аналогового на цифровое телевидение, поскольку мы знаем, что грядут изменения в нашей системе отопления, можно составить соответствующий план, чтобы сделать переход максимально простым и понятным. Правительство может потребовать, чтобы все новые газовые котлы были готовы к работе с водородом, чтобы обеспечить плавный переход, когда придет время переходить на водород.
Правительство может потребовать, чтобы все новые газовые котлы были готовы к работе с водородом, чтобы обеспечить плавный переход, когда придет время переходить на водород.
Эксперты настроены оптимистично и полагают, что переход на водородное отопление начнется в ближайшие 10 лет в соответствии с целями правительств Великобритании и США по сокращению выбросов углерода наполовину к 2035 году. Energy учредила инициативу Hydrogen Earthshot , целью которой является снижение стоимости водорода до 1 доллара за килограмм за одно десятилетие.
Хорошая новость заключается в том, что водород можно транспортировать через нашу существующую газовую сеть и легко хранить с помощью обычных технологий. Это было бы более рентабельным решением, позволяющим сократить объем дорогостоящей новой инфраструктуры, необходимой для создания новых сетей передачи и распределения водорода, а также свести к минимуму сбои в работе.
В настоящее время проводятся испытания смешивания водорода, чтобы выяснить, сколько водорода можно использовать в наших существующих трубопроводах.
Что такое смешивание водорода?
Переход на 100% водород пока нецелесообразен по следующим причинам:
инфраструктура для производства водорода в достаточно больших количествах все еще разрабатывается
водород и метан имеют некоторые важные отличия (например скорость, с которой движется газ), поэтому нам нужно проверить, как будет работать существующая сеть газопроводов, когда в нее будет введен водород.
Итак, ученые тестируют способы «смешивания» водорода с природным газом, чтобы снизить выбросы, поскольку потребуется меньше природного газа. Водород впрыскивается в систему природного газа, производя «смесь» природного газа и водорода.
Смешивание водорода в Великобритании
В Великобритании в настоящее время разрешено включать только смесь водорода с концентрацией 0,1% в смесь природного газа, подаваемую в дома, предприятия и промышленность.
Проходит одно из испытаний смешивания водорода FutureGrid – специально построенная установка для исследования водорода, которая проверит возможность использования водородных смесей при увеличении концентрации до 100% на газотранспортных объектах.
В национальном масштабе считается, что водородное смешивание может иметь такой же ежегодный эффект экономии углерода, как удаление двух миллионов автомобилей с дорог . Это побудило Ассоциацию энергетических сетей (ENA) поддержать планы смешивания водорода по всей Великобритании. Ожидается, что необходимая модернизация национальной системы электропередач Великобритании может обеспечить смесь 2% к 2024 г. и смесь 20% к 2027 г. 3
Смешивание водорода в США
Один из первых и крупнейших проектов по производству чистого водорода в США HyGrid Project был запущен в 2021 году и расположен на Лонг-Айленде. Добавляя зеленый водород в существующую систему распределения, он поможет обезуглерожить существующие газовые сети и, как ожидается, будет обогревать около 800 домов, а также будет обеспечивать чистый и смешанный водород для использования в транспортных средствах.
Другие проекты National Grid, находящиеся в разработке как для производства, так и для использования зеленого водорода, включают многоцелевой водородный объект, который будет построен в центре Нью-Йорка в 2023 году.

 Внутри вы найдете несколько слитков графита, из которых можно сделать идеальные электроды для этой цели. Очистите их наждачной бумагой, чтобы избавиться от всей грязи, прежде чем использовать их. (Вы можете увидеть иллюстрированные инструкции по этой экстракции под углем.)
Внутри вы найдете несколько слитков графита, из которых можно сделать идеальные электроды для этой цели. Очистите их наждачной бумагой, чтобы избавиться от всей грязи, прежде чем использовать их. (Вы можете увидеть иллюстрированные инструкции по этой экстракции под углем.) Используйте отдельные разъемы на каждом конце цепи или разрежьте один разъем пополам, чтобы разделить две клеммы. Вы можете нарастить до некоторые довольно высокие напряжения с помощью всего нескольких батарей, так что будьте осторожны.На самом деле, когда ваши руки мокрые от соленой воды, даже одна батарея 9 В может дать вам удивительно неприятный шок.При подключении нескольких последовательно вы должны носить резиновые перчатки, в моем случае мнение.)
Используйте отдельные разъемы на каждом конце цепи или разрежьте один разъем пополам, чтобы разделить две клеммы. Вы можете нарастить до некоторые довольно высокие напряжения с помощью всего нескольких батарей, так что будьте осторожны.На самом деле, когда ваши руки мокрые от соленой воды, даже одна батарея 9 В может дать вам удивительно неприятный шок.При подключении нескольких последовательно вы должны носить резиновые перчатки, в моем случае мнение.) Но водород чистый, потому что любой натрий, который вы выделяете электролизом, немедленно реагирует с окружающей водой, образуя больше водорода и растворенного гидроксида натрия. Другими словами, решение будет становиться все более простым.
Но водород чистый, потому что любой натрий, который вы выделяете электролизом, немедленно реагирует с окружающей водой, образуя больше водорода и растворенного гидроксида натрия. Другими словами, решение будет становиться все более простым.
 )
)
 Когда вы используете электричество для расщепления воды, вы отправляете электрон из батареи вниз в воду, где он находит молекулу воды, отрывает протон, и протон и электрон объединяются, образуя атом водорода. (Технически два электрона отрывают два протона и образуют молекулу, содержащую два атома водорода, но это деталь.) Дело в том, что, добавляя электроны к воде, вы создаете атомы водорода из двух субатомных частиц. Практически в любой другой химической реакции вокруг атомов уже есть много электронов, и вы просто вносите изменения по краям. Но здесь вы создаете атомы практически с нуля, не требуется ни ускорителя, ни ядерного реактора, просто 9батарея В.
Когда вы используете электричество для расщепления воды, вы отправляете электрон из батареи вниз в воду, где он находит молекулу воды, отрывает протон, и протон и электрон объединяются, образуя атом водорода. (Технически два электрона отрывают два протона и образуют молекулу, содержащую два атома водорода, но это деталь.) Дело в том, что, добавляя электроны к воде, вы создаете атомы водорода из двух субатомных частиц. Практически в любой другой химической реакции вокруг атомов уже есть много электронов, и вы просто вносите изменения по краям. Но здесь вы создаете атомы практически с нуля, не требуется ни ускорителя, ни ядерного реактора, просто 9батарея В.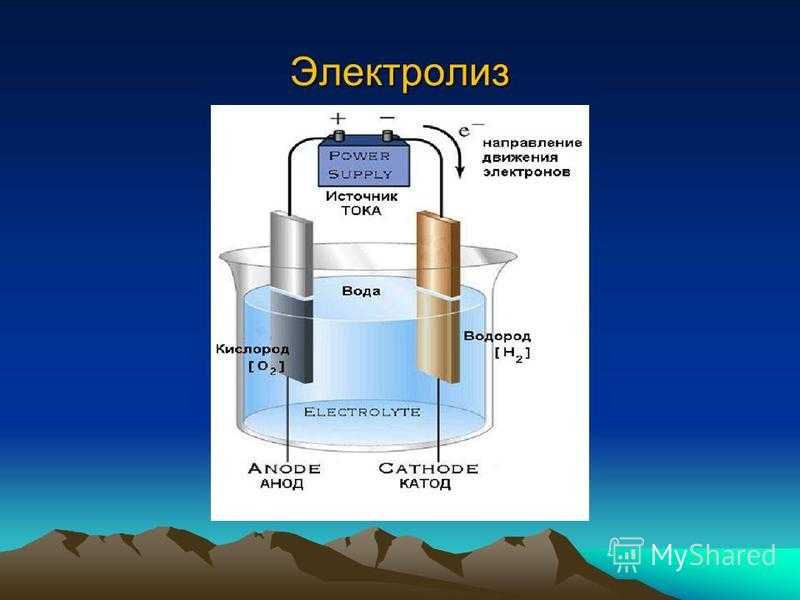 Это звучит тривиально, но я уверен, что им пришлось использовать множество уловок, чтобы заставить его работать, точно так же, как плазменно-дуговой резак звучит просто, но в конечном итоге требует гафния всего, что есть в электроде. если вы хотите, чтобы он действительно резал сталь.
Это звучит тривиально, но я уверен, что им пришлось использовать множество уловок, чтобы заставить его работать, точно так же, как плазменно-дуговой резак звучит просто, но в конечном итоге требует гафния всего, что есть в электроде. если вы хотите, чтобы он действительно резал сталь.