- ПОЛУЧЕНИЕ ВОДОРОДА МЕТОДОМ НИЗКОВОЛЬТНОГО ЭЛЕКТРОЛИЗА
- «Зеленый» водород: как два литра воды могут обеспечить ваш дом энергией на несколько дней
- ученых нашли простой способ получения водорода из воды при комнатной температуре: ScienceAlert
- Получение водорода электролизом воды в домашних условиях — Чат STEM
ПОЛУЧЕНИЕ ВОДОРОДА МЕТОДОМ НИЗКОВОЛЬТНОГО ЭЛЕКТРОЛИЗА
Главная Научные конференции XLVII международная научно-практическая конференция «Химия, физика, биология, математика: теоретические и прикладные исследования» ПОЛУЧЕНИЕ ВОДОРОДА МЕТОДОМ НИЗКОВОЛЬТНОГО ЭЛЕКТРОЛИЗА
ПОЛУЧЕНИЕ ВОДОРОДА МЕТОДОМ НИЗКОВОЛЬТНОГО ЭЛЕКТРОЛИЗА
Кучерявый Александр Игоревич
студент, Санкт-Петербургский государственный университет телекоммуникаций,
РФ, г. Санкт-Петербург
HYDROGEN PRODUCTION BY LOW-VOLTAGE ELECTROLYSIS
Alexandr Kucheryavyi
Student, St. Petersburg State University of Telecommunications,
Russia, Blagoveshchensk
АННОТАЦИЯ
Целью проведения выполненных работ, было непрерывное получение стабильного объема гремучего газа посредством низковольтного электролиза постоянным током умеренной плотности при температурах до 70.
ABSTRACT
The purpose of the work was continuous receiving a fixed volume oxygen-hydrogen mixture by low voltage electrolysis of moderate density at temperatures up to 70 ℃. The mixture can be used, for example, in an internal combustion engine, to power a fuel cell, and the like. The relative ease of manufacture and the availability of scrap materials made it possible to manufacture the installation and carry out the first experiments «at home», without involving production facilities and significant costs for development.
Ключевые слова: водородная энергетика, получение водорода, низковольтный электролиз.
Keywords: hydrogen energy, hydrogen production, low-voltage electrolysis.
Введение. Получение водорода – это важная задача для самых разных областей науки и техники. Автор, заинтересовавшийся проблемой получения водорода в условиях примитивной лаборатории, поставил цель получить заметное количество водорода без использования сложного и дорогого оборудования. В рамках поставленной цели методом получения водорода был выбрал электролиз. В работе описана установка, полностью справившаяся с изначально поставленными задачами. Также приводятся первоначальные результаты измерений и делаются первые оценки эффективности использования подобного типа оборудования.
Теория низковольтного электролиза при постоянном токе.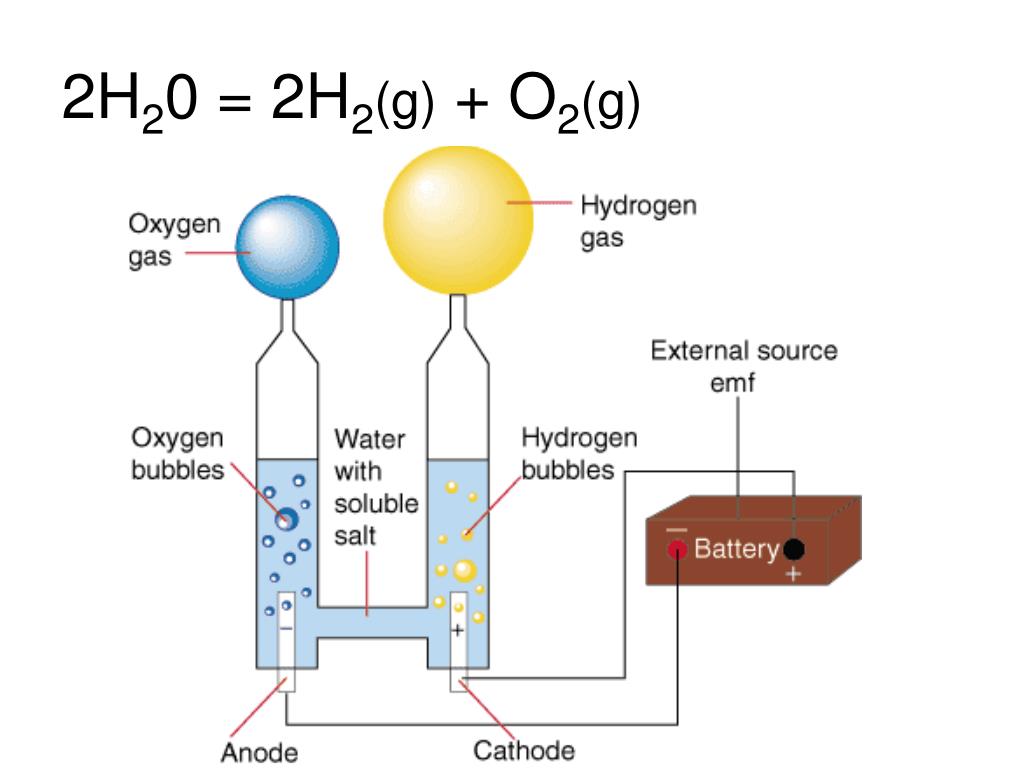 При прохождении тока через некоторые электролиты происходит разложение воды на составные части – водород и кислород, которые выделяются на пластинах, соединенных соответственно с отрицательным и положительным полюсом батареи. В данной работе использовался раствор пищевой соды , являющийся раствором щелочного типа.
При прохождении тока через некоторые электролиты происходит разложение воды на составные части – водород и кислород, которые выделяются на пластинах, соединенных соответственно с отрицательным и положительным полюсом батареи. В данной работе использовался раствор пищевой соды , являющийся раствором щелочного типа.
Проводимость электролитов является ионной, т.е. обусловлена движением в них положительных и отрицательных ионов, которые образуются из нейтральной молекулы путем диссоциации её на две части, заряженные равными и противоположными зарядами. Эти ионы способны перемещаться независимо друг от друга [1].
Рисунок 1. а) цепь разомкнута; б) цепь замкнута, через электролит идет ионный ток
Движение ионов иллюстрируются рисунком 1. Кружками со знаками «+» и «-» между электродами схематически изображены положительные и отрицательные ионы растворенного вещества. Пока между электродами А и К не создано поле, ионы совершают только беспорядочное тепловое движение, как и все остальные молекулы раствора. В каждом направлении за единицу времени протекает одинаковый положительный и отрицательный заряд, т.е. нет электрического тока – переноса заряда в определенном направлении. При наложении разности потенциалов на электроды А (анод) и К (катод), когда внутри электролита возникает электрическое поле, на это беспорядочное движение накладывается упорядоченное движение в противоположные стороны ионов различных знаков: отрицательных – к аноду А, положительных – катоду К.
В каждом направлении за единицу времени протекает одинаковый положительный и отрицательный заряд, т.е. нет электрического тока – переноса заряда в определенном направлении. При наложении разности потенциалов на электроды А (анод) и К (катод), когда внутри электролита возникает электрическое поле, на это беспорядочное движение накладывается упорядоченное движение в противоположные стороны ионов различных знаков: отрицательных – к аноду А, положительных – катоду К.
При соприкосновении с катодом положительные ионы получают недостающие им электроны и выделяются в виде нейтральных атомов, а взамен электронов, нейтрализовавших ионы, новые электроны переходят от батареи к катоду. Точно так же, отрицательные ионы при соприкосновении с анодом отдают свои избыточные электроны, превращаясь в нейтральные атомы; электроны же уходят по металлическим проводам в батарею. Таким образом, ток в электролите обусловлен движущимися ионами, а на электродах происходит нейтрализация ионов и выделение их в виде нейтральных атомов (или молекул).
При электролизе раствора пищевой соды на катоде выделяется водород, на аноде – кислород. Недостаток ионов у катода восполняется за счёт диссоциации молекул воды с образованием атомов водорода и ионов , и последующей рекомбинацией атомарного водорода в молекулы:
,
где Me – металл, из которого изготовлен катод.
Выделение на аноде кислорода происходит в результате разряда гидроксильных ионов. В щелочных растворах, при умеренных плотностях тока, ионы на аноде разряжаются по формуле:
Часть электрической энергии, затраченной в процессе электролиза, используется на разложение воды на кислород и водород, остальная часть энергии выделяется в виде тепла.
Тепло, выделяющееся в процессе электролиза, отводится из ячейки в основном за счет рассеивания тепла в раствор. При увеличении температуры электролита увеличивается сила тока, протекающая через него, поэтому следует следить, как за температурой установки, так и за величиной протекающего тока, пока не будет достигнут тепловой баланс установки [2].
Описание установки. На рисунке 2 схематически изображен комплекс использованного оборудования.
Рисунок 2. Схематическое изображение установки
Источником постоянного напряжения был выбран компьютерный блок питания. Для питания электролизера используется пятивольтовая линия источника питания, способная выдать до 22 ампер. Дополнительным плюсом использования готового блока является встроенная защита от короткого замыкания.
На рисунке 3 показаны электролизер и соединенный с ним баблер. Основой данного самодельного электролизера стали отрезки 50 и 30 миллиметровых труб из нержавеющей стали, служащие в качестве катода и анода. Для изоляции труб была использована распиленная на две части водопроводная муфта из пластика диаметром 50мм и соответствующие заглушки. Для обеспечения герметичности были использованы разрезанные на две части цанговые фитинги и трубки для тормозной жидкости из тормозной системы грузовых автомобилей.
Рисунок 3. Фотография электролизера и баблера
Использование баблера необходимо по нескольким причинам. Если уровень электролита поднимется выше положенной отметки, то, во-первых, электролит, попадая в трубку, начнет заполнять собой гидрозатвор, что крайне нежелательно. Во-вторых, электролит будет вытекать из электролизера, после чего его нужно будет доливать. В-третьих, электролит будет перекрывать непрерывную подачу газа, что также крайне нежелательно.
В качестве гидрозатвора в данной установке используется модифицированный медицинский шприц на 50 миллилитров (рисунок 4). В нем укорочен шток таким образом, чтобы шприц мог вертикально стоять, опираясь на собственный корпус. Сверху проделано дополнительное отверстие, через которое проходит трубка до уплотняющего кольца. Благодаря наличию поршня можно регулировать объем гидрозатвора и уровень воды в нем.
Характеристики установки, полученные в ходе испытаний. Объем выделяемого газа был определен с помощью измерения времени необходимого на вытеснение жидкости из стеклянного сосуда заранее известного объема. На рисунке 5 приведена схема измерений объема с использованием данного метода.
Объем выделяемого газа был определен с помощью измерения времени необходимого на вытеснение жидкости из стеклянного сосуда заранее известного объема. На рисунке 5 приведена схема измерений объема с использованием данного метода.
Рисунок 5. Вытеснение воды газом
В таблице 1 представлены результаты измерений скорости выделения газа от времени работы установки.
Таблица 1.
Скорость выделения газа в зависимости от времени работы установки
|
Холодный запуск |
78,94 мл/мин |
|
Через 5 минут работы |
98,36 мл/мин |
|
Через 10 минут работы |
115,38 мл/мин |
|
Через 15 минут работы |
114,49 мл/мин |
|
Через 20 минут работы |
114,80 мл/мин |
Из таблицы видно, что время выхода установки на стационарный режим составляет около 10 минут.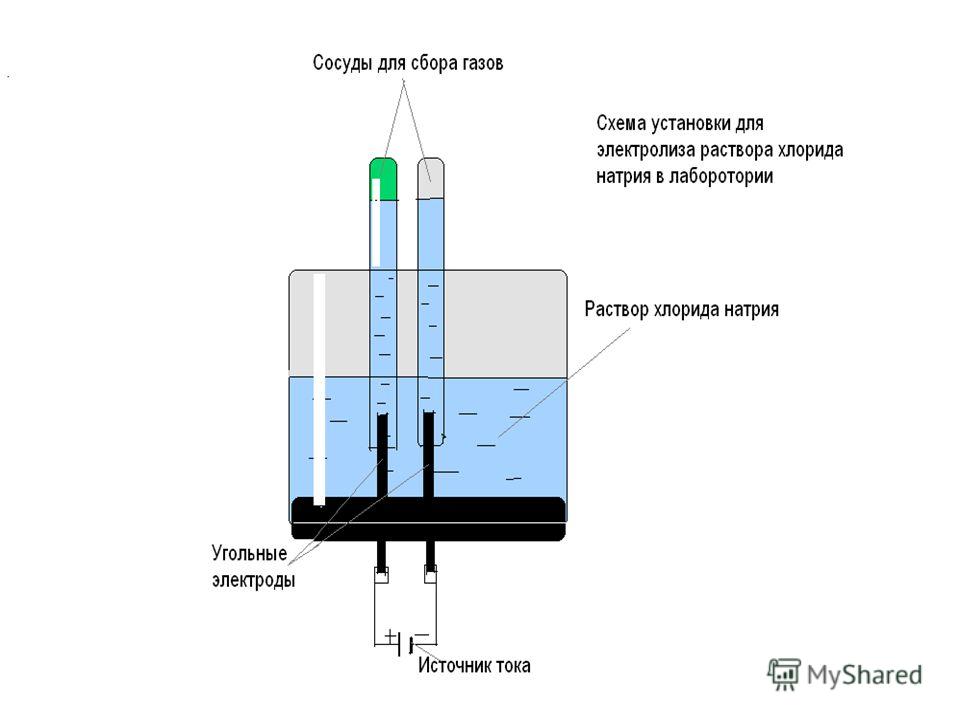
Мощность, необходимая для выделения одного миллилитра газа, была измерена с помощью вольтметра и амперметра, включенных в цепь по схеме, представленной на рисунке 6.
Рисунок 6. Схема подключения электролизера для измерения мощности
Для этого, после выхода установки на рабочий режим, методом вытеснения воды из стеклянной бутылки был определен объем газа V=500мл, выделившегося за время t=265c. Каждые 10 секунд снимались данные с амперметра и вольтметра на основе которых была вычислена средняя мощность потребления электроэнергии электролизером:
,
где: N – число измерений.
Поделив среднюю мощность на объем выделенного газа, получаем мощность необходимую для выделения одного миллилитра газа.
Выразим массу из уравнения Клапейрона-Менделеева [3]:
Процесс происходит при атмосферном давлении P=100 КПа и комнатной температуре Т=300К.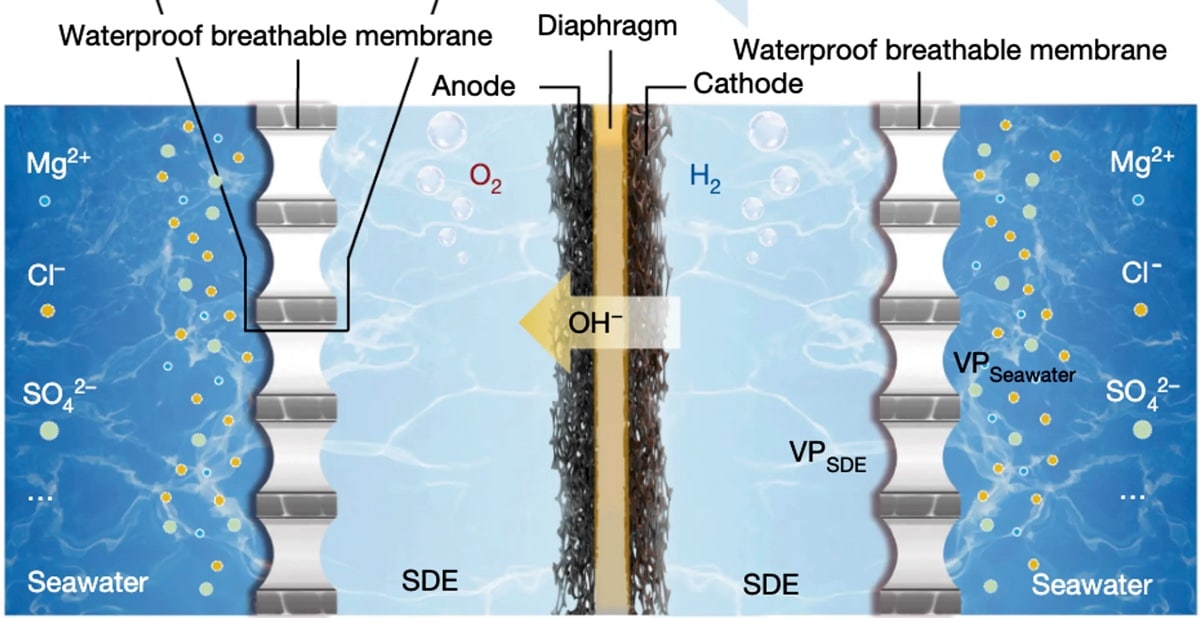 Молярная масса водорода 2г/моль.
Молярная масса водорода 2г/моль.
В электролизере не реализовано разделение газов, поэтому в полученном газе присутствует, как водород, так и кислород. Число молекул водорода, выделяющихся в электролизере, в 2 раза больше числа молекул кислорода. Согласно закону Авогадро, объемы газов будут относиться, как отношение числа их молекул [4], поэтому объём водорода, равен двум третям от общего объёма выделяющегося газа.
Подставив все значения в формулу, получим массу водорода равную m= кг (для 500 миллиметрового объема смеси кислорода и водорода)
Если весь выделившийся водород сжечь в выделившемся кислороде, то с учетом теплоты сгорания водорода q=140 МДж/кг, получим для теоретического тепловыделения :
Отнеся это значение к энергии, затраченной на выделение гремучей смеси из раствора электролита:
,
получим максимально возможный условный КПД процесса электролиза:
Следует отметить, что вычисления, приведенные выше, весьма условны в силу того, что на реальный КПД влияет множество факторов, в частности – устройство двигателя, а экспериментальная установка никак не оптимизировалась на предмет повышения выхода водорода.
Заключение. В ходе проделанной работы была построена установка для электролитического получения водорода из раствора пищевой соды методом низковольтного электролиза, и был проведен ряд измерений. Эксперименты показали, что получение гремучей смеси при помощи простейшей установки, собранной из подручных средств, возможно. Установка показала положительный баланс по затратам энергии на получение и ее предельному значению от сжигания полученного водорода, что говорит о перспективности метода и необходимости продолжения экспериментов.
Список литературы:
- Ландсберг Г.С. Элементарный учебник физики. Т.2. Электричество и магнетизм. М.: Наука, 1985. 479 с.
- Якименко Л.М. Электролиз воды. М.: Химия, 1970. 264 с.
- Сивухин Д.В. Общий курс физики. Термодинамика и молекулярная физика Том II. М.: Наука, 1990. 591 с.
- Савельев И.В. Курс общей физики, том I. Механика, колебания и волны, молекулярная физика.
 М.: Наука, 1970. 508 с.
М.: Наука, 1970. 508 с.
«Зеленый» водород: как два литра воды могут обеспечить ваш дом энергией на несколько дней
Doloresz Katanich
«Зеленый» водород в будущем может полностью заменить ископаемое топливо. Сотрудники немецкого стартапа считают, что у них есть ключевой элемент для того, чтобы сделать его доступным для всех.
Вайтеа Кован родилась на острове в Тихом океане, испытывающем на себе влияние изменения климата. Она верит в перспективы технологии «зеленого» водорода. Более трех лет назад Вайтеа стала соучредителем компании Enapter.
«Я хотела заменить все дизельные генераторы в Новой Каледонии, а также в других отдаленных районах, которые не должны зависеть от «грязного» дизельного топлива», — говорит Кован.
«Осознав потенциал «зеленого» водорода, который способен заменить ископаемое топливо, мне захотелось стать частью этих перемен».
Зеленые решения принимаются только в том случае, если они экономически привлекательны. В этом и заключается наша миссия — сделать «зеленый» водород экономически конкурентоспособным.
Вайтеа Кован Enapter, сооснователь
Электролизеры с ионообменной мембраной (ИОМ) этой немецкой компании используются более в чем 100 проектах в 33 странах. Эта технология позволяет производить водород без эмиссии с помощью энергии из возобновляемых источников.
Разработанный быстрее и дешевле, чем предполагалось, электролизер с ИОM уже заправляет автомобили и самолеты, питает промышленность и обогревает дома.
Водородные генераторы компании Enapter недавно получили премию принца Уильяма Earthshot Prize в номинации «Исправление климата».
Что такое зеленый водород?
Большая часть водорода на планете содержится в воде. «Зеленый» водород извлекают из воды без выбросов в атмосферу (обычно его производят путем сжигания ископаемого топлива). Этот способ производства основан на возобновляемой энергии, которая используется для электролиза, химического процесса, необходимого для разделения атомов водорода и кислорода в воде.
Этот способ производства основан на возобновляемой энергии, которая используется для электролиза, химического процесса, необходимого для разделения атомов водорода и кислорода в воде.
Основными недостатками этого способа считаются низкая эффективность производства водорода и высокая стоимость. Однако компания Enapter утверждает, что ее электролизер с ИОМ решает эти проблемы и обеспечивает быстрый и простой способ получения экологически чистой энергии даже в домашних условиях.
Половина воды, используемой для смыва в туалете, может питать дом в течение нескольких дней
Компания Enapter утверждает, что ее электролизеру необходимо всего около 2,4 литра воды для выработки водорода, достаточного для питания дома, в котором проживает семейная пара, в течение нескольких дней.
Однако точное количество дней зависит от емкости накопителя энергии. Это количество воды равно половине воды, используемой для однократного смыва унитаза (5 литров), и в восемь раз меньше, чем потребление воды посудомоечной машиной (20 литров).
Премия Earthshot поможет Enapter начать массовое производство.
«На площадке, которую мы начали строить шесть недель назад, серийное производство стартует в начале 2023 года», — говорит Вайтеа.
К 2050 году компания Enapter’s надеется производить 10% водорода в мире.
ученых нашли простой способ получения водорода из воды при комнатной температуре: ScienceAlert
Пузырьки газообразного водорода образуются в результате реакции воды с алюминиево-галлиевым композитом. (Амберчан и др., Прикладные наноматериалы, 2022 г.)
Водородное топливо обещает стать чистым и обильным источником энергии в будущем — до тех пор, пока ученые смогут найти способы его практического и дешевого производства без ископаемого топлива.
Новое исследование дает нам еще один многообещающий шаг в этом направлении, при условии, что вы сможете использовать существующие запасы алюминия и галлия, бывших в употреблении.
В новом исследовании ученые описывают относительно простой метод с использованием наночастиц алюминия, которые способны отделять кислород от молекул воды и оставлять газообразный водород.
Процесс дает большое количество водорода, и все это работает при комнатной температуре.
Это устраняет одно из серьезных препятствий для производства водородного топлива: большое количество энергии, необходимой для его производства с использованием существующих методов.
Этот метод работает с любой водой, включая сточные воды и океанскую воду.
«Нам не нужна никакая энергия, а водород пузырится как сумасшедший», — говорит материаловед Скотт Оливер из Калифорнийского университета в Санта-Круз (UCSC).
«Я никогда не видел ничего подобного.»
Ключом к процессу является использование металлического галлия, чтобы обеспечить непрерывную реакцию с водой. Эта реакция алюминия-галлия-воды известна уже несколько десятилетий, но здесь команда оптимизировала и усовершенствовала ее несколькими конкретными способами.
С помощью методов сканирующей электронной микроскопии и рентгеновской дифракции исследователи смогли найти наилучшую смесь алюминия и галлия для получения водорода с наибольшей эффективностью: композит галлия-алюминия 3:1.
Сплав, богатый галлием, выполняет двойную функцию: удаляет оксидное покрытие алюминия (которое обычно блокирует реакцию с водой) и производит наночастицы алюминия, ускоряющие реакции.
«Галлий разделяет наночастицы и препятствует их агрегации в более крупные частицы», — говорит Бактан Сингарам, профессор органической химии Калифорнийского университета в Южной Калифорнии.
«Люди изо всех сил пытались создать наночастицы алюминия, и вот мы производим их при нормальном атмосферном давлении и комнатной температуре».
Исследователи сообщают, что метод смешивания не сложен, а композитный материал можно хранить не менее трех месяцев при погружении в циклогексан для защиты от влаги, которая в противном случае ухудшила бы его эффективность.
Алюминий легче достать, чем галлий, поскольку его можно получить из материалов, бывших в употреблении, таких как выброшенные алюминиевые банки и фольга.
Галлий дороже и менее распространен, но, по крайней мере, в этом процессе его можно многократно извлекать и повторно использовать без потери его эффективности.
Предстоит еще много работы, не в последнюю очередь для того, чтобы убедиться, что это можно масштабировать от лабораторной установки до чего-то, что можно использовать в промышленных масштабах. Тем не менее, первые признаки того, что это еще один метод, который имеет большой потенциал для производства водородного топлива.
«В целом смесь Ga-Al [богатая галлием галлий-алюминий] производит значительное количество водорода при комнатной температуре без подвода энергии, манипуляций с материалами или изменения pH», — заключают исследователи в своей статье.
Исследование опубликовано в журнале Applied Nano Materials .
Получение водорода электролизом воды в домашних условиях — Чат STEM
HariSharanKalia (Хари Шаран Калия)
#1
Сегодня учитель дал мне задание провести эксперимент по электролизу воды.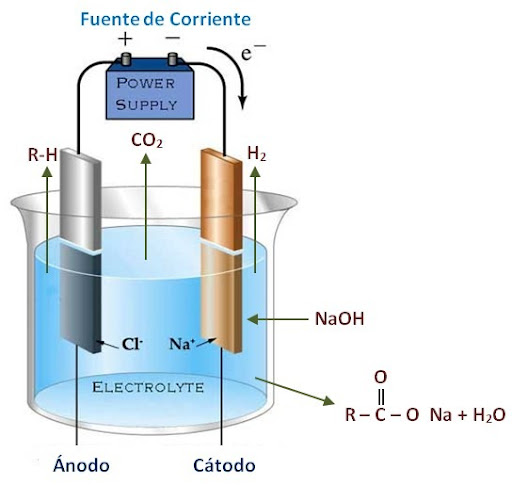
Но я перешел на другой уровень, получив водород путем электролиза воды.
Что такое электролиз воды:
Электролиз воды — это процесс использования электричества для разложения воды на газообразный кислород и водород в процессе, называемом электролизом.
Вот материалы, которые я использовал
В качестве источника питания я использовал зарядное устройство для автомобильного аккумулятора (от него мало электроэнергии, поэтому я смог сделать только немного водорода), Fevi quick, клей, скрутка, нож, нагретый на плите, бутылки с водой, поваренная соль, нержавеющая сталь. ручные посудомоечные машины, провода и трубки (это фото сделано после эксперимента, поэтому на бутылке осталась ржавчина)
Как это работает в моем случае:
Во-первых, вода должна была проводить электричество, что я и сделал, добавив в нее поваренную соль.
Далее нам понадобились катод и анод. (отрицательный и положительный)
В котором я использовал ручные посудомоечные машины из нержавеющей стали. Я связал их и соединил проводами.
Я связал их и соединил проводами.
Затем мне нужно было улавливать газы по-другому, поэтому я использовал бутылки с трубками сверху, чтобы улавливать их.
Водород выходит из катода, а кислород из анода. с соотношением 2:1 соответственно.
Это установка
Как доказать, что это водород :
Чтобы доказать, что это водород, я взял трубку с водородом и сделал пузыри водорода, поместив ее в мыльную воду, и сжег их.
Несколько видео пожаров.
/uploads/по умолчанию/оригинал/2X/5/58bdb84bc700d2bda3f270ea60a2dff22a117a7a.mov
/uploads/по умолчанию/оригинал/2X/5/53ce31444751dac00b3937fd67aea79ed3e48eef.mov
Что производит другая труба:
Кислород
Откуда взялась ржавчина :
помните катод и анод. анод удаляет ржавчину на используемом металле, а катод добавляет ржавчины на металл, используемый для него.
3 лайков
(Мригиндер Сингх)
#2
Отличная работа. Так держать.
Кстати, не подскажете, на каком терминале (+ve или -ve) будет выпускаться водород?
Почему это происходит?
Заметили ли вы разницу в объеме выделяемых газов?
1 Нравится
(Хари Шаран Калия)
#3
Я отредактировал пост, так что он также говорит нам об этом.
1 Нравится
NAVTEJ7939 (НАВТЕЙ СИНГХ)
#4
Водород будет выпущен из терминала { -ve } . Поскольку водород по своей природе положителен, тогда как кислород отрицателен, и положительный заряд притягивает отрицательный заряд, а отрицательный притягивает положительный заряд
Поскольку водород по своей природе положителен, тогда как кислород отрицателен, и положительный заряд притягивает отрицательный заряд, а отрицательный притягивает положительный заряд
Существует также разница в объеме выделяемых газов из-за закона постоянных пропорций. Соотношение масс Кислорода и Водорода в воде 8:1. Таким образом, когда 8 граммов кислорода проходят через (+ve) терминал, 1 грамм водорода выйдет через (-ve) терминал.
1 Нравится
(Мригиндер Сингх)
#5
@NAVTEJ7939 будет ли отношение их объемов таким же, как отношение их масс?
Есть ли определенная связь между ними?
NAVTEJ7939 (НАВТЕЙ СИНГХ)
