Метан: способы получения и свойства
Метан CH4 – это предельный углеводород, содержащий один атом углерода в углеродной цепи. Бесцветный газ без вкуса и запаха, легче воды, нерастворим в воде и не смешивается с ней.
Все алканы — вещества, схожие по физическим и химическим свойствам, и отличающиеся на одну или несколько групп –СН2– друг от друга. Такие вещества называются гомологами, а ряд веществ, являющихся гомологами, называют гомологическим рядом.
Самый первый представитель гомологического ряда алканов – метан CH4, или Н–СH2–H.
Продолжить гомологический ряд можно, последовательно добавляя группу –СН2– в углеводородную цепь алкана.
| Название алкана | Формула алкана |
| Метан | CH4 |
| Этан | C2H6 |
| Пропан | C3 |
| Бутан | C4H10 |
| Пентан | C5H12 |
| Гексан | C6H14 |
| Гептан | C7H16 |
| Октан | C8H18 |
| Нонан | C9H20 |
| Декан | C10H22 |
Общая формула гомологического ряда алканов CnH2n+2.
Первые четыре члена гомологического ряда алканов – газы, C5–C17 – жидкости, начиная с C18 – твердые вещества.
В молекуле метана встречаются связи C–H. Связь C–H ковалентная слабополярная. Это одинарная σ-связь. Атом углерода в метане образует четыре σ-связи. Следовательно, гибридизация атома углерода в молекуле метана– sp3:
При образовании связи С–H происходит перекрывание sp3-гибридной орбитали атома углерода и s-орбитали атома водорода:
Четыре sp3-гибридные орбитали атома углерода взаимно отталкиваются, и располагаются в пространстве так, чтобы угол между орбиталями был максимально возможным.
Поэтому четыре гибридные орбитали углерода в алканах направлены в пространстве под углом 109о 28′ друг к другу:
Это соответствует тетраэдрическому строению молекулы.
| Например, в молекуле метана CH4 атомы водорода располагаются в пространстве в вершинах тетраэдра, центром которого является атом углерода |
Для метана не характерно наличие изомеров – ни структурных (изомерия углеродного скелета, положения заместителей), ни пространственных.
Метан – предельный углеводород, поэтому он не может вступать в реакции присоединения.
Для метана характерны реакции:
- разложения,
- замещения,
- окисления.
Разрыв слабо-полярных связей С – Н протекает только по гомолитическому механизму с образованием свободных радикалов.
Поэтому для метана характерны только радикальные реакции.
Метан устойчив к действию сильных окислителей (KMnO4, K2Cr2O7 и др.), не реагирует с концентрированными кислотами, щелочами, бромной водой.
1. Реакции замещения
Для метана характерны реакции радикального замещение.
1.1. Галогенирование
Метан реагирует с хлором и бромом на свету или при нагревании.
При хлорировании метана сначала образуется хлорметан:
Хлорметан может взаимодействовать с хлором и дальше с образованием дихлорметана, трихлорметана и тетрахлорметана:
Химическая активность хлора выше, чем активность брома, поэтому хлорирование протекает быстро и неизбирательно. |
Бромирование протекает более медленно.
Реакции замещения в алканах протекают по свободнорадикальному механизму.
Свободные радикалы R∙ – это атомы или группы связанных между собой атомов, которые содержат неспаренный электрон.
Первая стадия. Инициирование цепи.
Под действием кванта света или при нагревании молекула галогена разрывается на два радикала:
Свободные радикалы – очень активные частицы, которые стремятся образовать связь с каким-либо другим атомом.
Вторая стадия. Развитие цепи.
Радикал галогена взаимодействует с молекулой алкана и отрывает от него водород.
При этом образуется промежуточная частица – алкильный радикал, который в свою очередь взаимодействует с новой нераспавшейся молекулой хлора:
Третья стадия. Обрыв цепи.
При протекании цепного процесса рано или поздно радикалы сталкиваются с радикалами, образуя молекулы, радикальный процесс обрывается.
Могут столкнуться как одинаковые, так и разные радикалы, в том числе два метильных радикала:
1.2. Нитрование метана
Метан взаимодействует с разбавленной азотной кислотой по радикальному механизму, при нагревании до 140оС и под давлением. Атом водорода в метане замещается на нитрогруппу NO2.
| Например. При нитровании метана образуется преимущественно нитрометан: CH4 + HNO3 = CH3NO2 + H2O |
При медленном и длительном нагревании до 1500оС метан разлагается до простых веществ:
Если процесс нагревания метана проводить очень быстро (примерно 0,01 с), то происходит межмолекулярное дегидрирование и образуется ацетилен:
Пиролиз метана – промышленный способ получения ацетилена.
Алканы – малополярные соединения, поэтому при обычных условиях они не окисляются даже сильными окислителями (перманганат калия, хромат или дихромат калия и др.).
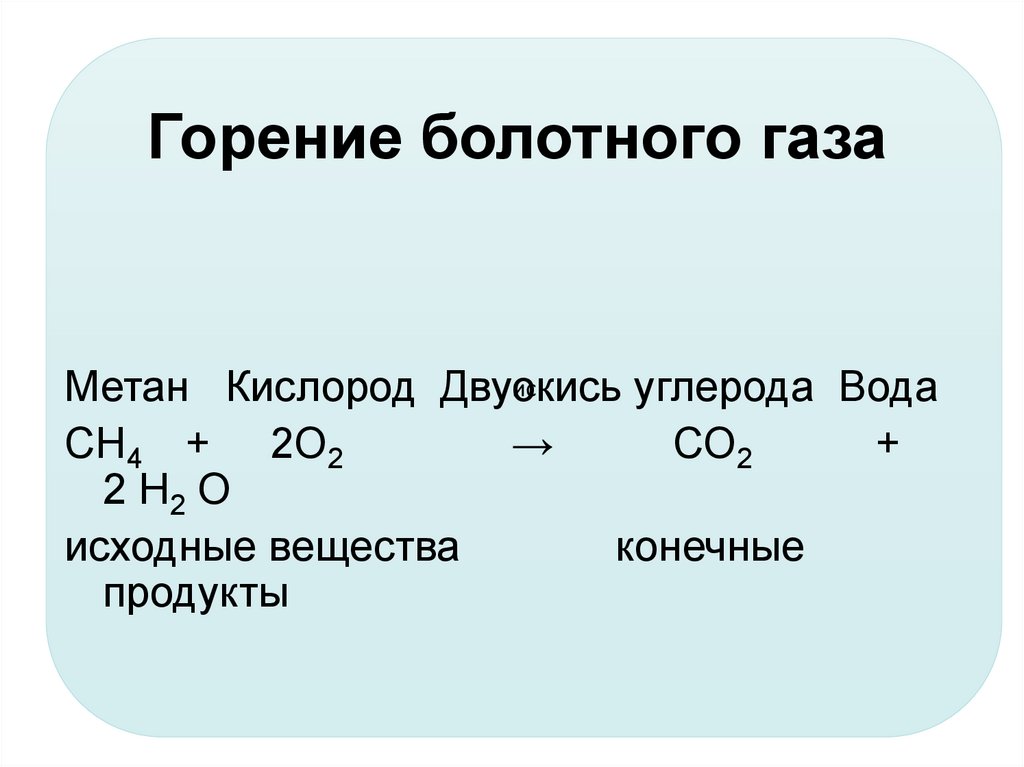
3.1. Полное окисление – горение
Алканы горят с образованием углекислого газа и воды. Реакция горения алканов сопровождается выделением большого количества теплоты.
CH4 + 2O2 → CO2 + 2H2O + Q
Уравнение сгорания алканов в общем виде:
CnH2n+2 + (3n+1)/2O2 → nCO2 + (n+1)H2O + Q
При горении алканов в недостатке кислорода может образоваться угарный газ СО или сажа С.
Промышленное значение имеет реакция окисления метана кислородом до простого вещества – углерода:
CH4 + O2 → C + 2H2O
Эта реакция используется для получения сажи.
3.2. Каталитическое окисление
- При каталитическом окислении метана кислородом возможно образование различных продуктов в зависимости от условий проведения процесса и катализатора. Возможно образование метанола, муравьиного альдегида или муравьиной кислоты:
- Важное значение в промышленности имеет паровая конверсия метана: окисление метана водяным паром при высокой температуре.
Продукт реакции – так называемый «синтез-газ».
1. Взаимодействие галогеналканов с металлическим натрием (реакция Вюрца)
Это один из лабораторных способов получения алканов. При этом происходит удвоение углеродного скелета. Реакция больше подходит для получения симметричных алканов. Получить таким образом метан нельзя.
2. Водный или кислотный гидролиз карбида алюминия
Al4C3 + 12H2O = 4Al(OH)3 + 3CH4
Al4C3 + 12HCl = 4AlCl3 + 3CH4
Этот способ получения используется в лаборатории для получения метана.
3. Декарбоксилирование солей карбоновых кислот (реакция Дюма)
Реакция Дюма — это взаимодействие солей карбоновых кислот с щелочами при сплавлении.
R–COONa + NaOH → R–H + Na2CO3
Декарбоксилирование — это отщепление (элиминирование) молекулы углекислого газа из карбоксильной группы (-COOH) или органической кислоты или карбоксилатной группы (-COOMe) соли органической кислоты.
При взаимодействии ацетата натрия с гидроксидом натрия при сплавлении образуется метан и карбонат натрия:
4. Синтез Фишера-Тропша
Из синтез-газа (смесь угарного газа и водорода) при определенных условиях (катализатор, температура и давление) можно получить различные углеводороды:
nCO + (3n+1)H2 = CnH2n+2 + nH2O
Это промышленный процесс получения алканов.
Синтезом Фишера-Тропша можно получить метан:
CO + 4H2 = CH4 + 2H2O
5. Получение метана в промышленности
В промышленности метан получают из нефти, каменного угля, природного и попутного газа. При переработке нефти используют ректификацию, крекинг и другие способы.
Понравилось это:
Нравится Загрузка…
Метан, структурная формула, химические, физические свойства
1
H
ВодородВодород
1,008
1s1
2,2
Бесцветный газ
t°пл=-259°C
t°кип=-253°C
2
He
ГелийГелий
4,0026
1s2
Бесцветный газ
t°кип=-269°C
3
Li
ЛитийЛитий
6,941
2s1
0,99
t°пл=180°C
t°кип=1317°C
4
Be
БериллийБериллий
9,0122
2s2
1,57
Светло-серый металл
t°пл=1278°C
t°кип=2970°C
5
B
БорБор
10,811
2s2 2p1
2,04
Темно-коричневое аморфное вещество
t°пл=2300°C
t°кип=2550°C
6
C
УглеродУглерод
12,011
2s2 2p2
2,55
Прозрачный (алмаз) / черный (графит) минерал
t°пл=3550°C
t°кип=4830°C
7
N
АзотАзот
14,007
2s2 2p3
3,04
Бесцветный газ
t°пл=-210°C
t°кип=-196°C
8
O
КислородКислород
15,999
2s2 2p4
3,44
Бесцветный газ
t°пл=-218°C
t°кип=-183°C
9
F
ФторФтор
18,998
2s2 2p5
4,0
Бледно-желтый газ
t°пл=-220°C
t°кип=-188°C
10
Ne
НеонНеон
20,180
2s2 2p6
Бесцветный газ
t°пл=-249°C
t°кип=-246°C
11
Na
НатрийНатрий
22,990
3s1
0,93
Мягкий серебристо-белый металл
t°пл=98°C
t°кип=892°C
12
Mg
МагнийМагний
24,305
3s2
1,31
Серебристо-белый металл
t°пл=649°C
t°кип=1107°C
13
Al
АлюминийАлюминий
26,982
3s2 3p1
1,61
Серебристо-белый металл
t°пл=660°C
t°кип=2467°C
14
Si
КремнийКремний
28,086
3s2 3p2
1,9
Коричневый порошок / минерал
t°пл=1410°C
t°кип=2355°C
15
P
ФосфорФосфор
30,974
3s2 3p3
2,2
Белый минерал / красный порошок
t°пл=44°C
t°кип=280°C
16
S
СераСера
32,065
3s2 3p4
2,58
Светло-желтый порошок
t°пл=113°C
t°кип=445°C
17
Cl
ХлорХлор
35,453
3s2 3p5
3,16
Желтовато-зеленый газ
t°пл=-101°C
t°кип=-35°C
18
Ar
АргонАргон
39,948
3s2 3p6
Бесцветный газ
t°пл=-189°C
t°кип=-186°C
19
K
КалийКалий
39,098
4s1
0,82
Мягкий серебристо-белый металл
t°пл=64°C
t°кип=774°C
20
Ca
КальцийКальций
40,078
4s2
1,0
Серебристо-белый металл
t°пл=839°C
t°кип=1487°C
21
Sc
СкандийСкандий
44,956
3d1 4s2
1,36
Серебристый металл с желтым отливом
t°пл=1539°C
t°кип=2832°C
22
Ti
ТитанТитан
47,867
3d2 4s2
1,54
Серебристо-белый металл
t°пл=1660°C
t°кип=3260°C
23
V
ВанадийВанадий
50,942
3d3 4s2
1,63
Серебристо-белый металл
t°пл=1890°C
t°кип=3380°C
24
Cr
ХромХром
51,996
3d5 4s1
1,66
Голубовато-белый металл
t°пл=1857°C
t°кип=2482°C
25
Mn
МарганецМарганец
54,938
3d5 4s2
1,55
Хрупкий серебристо-белый металл
t°пл=1244°C
t°кип=2097°C
26
Fe
ЖелезоЖелезо
55,845
3d6 4s2
1,83
Серебристо-белый металл
t°пл=1535°C
t°кип=2750°C
27
Co
КобальтКобальт
58,933
3d7 4s2
1,88
Серебристо-белый металл
t°пл=1495°C
t°кип=2870°C
28
Ni
НикельНикель
58,693
3d8 4s2
1,91
Серебристо-белый металл
t°пл=1453°C
t°кип=2732°C
29
Cu
МедьМедь
63,546
3d10 4s1
1,9
Золотисто-розовый металл
t°пл=1084°C
t°кип=2595°C
30
Zn
ЦинкЦинк
65,409
3d10 4s2
1,65
Голубовато-белый металл
t°пл=420°C
t°кип=907°C
31
Ga
ГаллийГаллий
69,723
4s2 4p1
1,81
Белый металл с голубоватым оттенком
t°пл=30°C
t°кип=2403°C
32
Ge
ГерманийГерманий
72,64
4s2 4p2
2,0
Светло-серый полуметалл
t°пл=937°C
t°кип=2830°C
33
As
МышьякМышьяк
74,922
4s2 4p3
2,18
Зеленоватый полуметалл
t°субл=613°C
(сублимация)
34
Se
СеленСелен
78,96
4s2 4p4
2,55
Хрупкий черный минерал
t°пл=217°C
t°кип=685°C
35
Br
БромБром
79,904
4s2 4p5
2,96
Красно-бурая едкая жидкость
t°пл=-7°C
t°кип=59°C
36
Kr
КриптонКриптон
83,798
4s2 4p6
3,0
Бесцветный газ
t°пл=-157°C
t°кип=-152°C
37
Rb
РубидийРубидий
85,468
5s1
0,82
Серебристо-белый металл
t°пл=39°C
t°кип=688°C
38
Sr
СтронцийСтронций
87,62
5s2
0,95
Серебристо-белый металл
t°пл=769°C
t°кип=1384°C
39
Y
ИттрийИттрий
88,906
4d1 5s2
1,22
Серебристо-белый металл
t°пл=1523°C
t°кип=3337°C
40
Zr
ЦирконийЦирконий
91,224
4d2 5s2
1,33
Серебристо-белый металл
t°пл=1852°C
t°кип=4377°C
41
Nb
НиобийНиобий
92,906
4d4 5s1
1,6
Блестящий серебристый металл
t°пл=2468°C
t°кип=4927°C
42
Mo
МолибденМолибден
95,94
4d5 5s1
2,16
Блестящий серебристый металл
t°пл=2617°C
t°кип=5560°C
43
Tc
ТехнецийТехнеций
98,906
4d6 5s1
1,9
Синтетический радиоактивный металл
t°пл=2172°C
t°кип=5030°C
44
Ru
РутенийРутений
101,07
4d7 5s1
2,2
Серебристо-белый металл
t°пл=2310°C
t°кип=3900°C
45
Rh
РодийРодий
102,91
4d8 5s1
2,28
Серебристо-белый металл
t°пл=1966°C
t°кип=3727°C
46
Pd
ПалладийПалладий
106,42
4d10
2,2
Мягкий серебристо-белый металл
t°пл=1552°C
t°кип=3140°C
47
Ag
СереброСеребро
107,87
4d10 5s1
1,93
Серебристо-белый металл
t°пл=962°C
t°кип=2212°C
48
Cd
КадмийКадмий
112,41
4d10 5s2
1,69
Серебристо-серый металл
t°пл=321°C
t°кип=765°C
49
In
ИндийИндий
114,82
5s2 5p1
1,78
Мягкий серебристо-белый металл
t°пл=156°C
t°кип=2080°C
50
Sn
ОловоОлово
118,71
5s2 5p2
1,96
Мягкий серебристо-белый металл
t°пл=232°C
t°кип=2270°C
51
Sb
СурьмаСурьма
121,76
5s2 5p3
2,05
Серебристо-белый полуметалл
t°пл=631°C
t°кип=1750°C
52
Te
ТеллурТеллур
127,60
5s2 5p4
2,1
Серебристый блестящий полуметалл
t°пл=450°C
t°кип=990°C
53
I
ИодИод
126,90
5s2 5p5
2,66
Черно-серые кристаллы
t°пл=114°C
t°кип=184°C
54
Xe
КсенонКсенон
131,29
5s2 5p6
2,6
Бесцветный газ
t°пл=-112°C
t°кип=-107°C
55
Cs
ЦезийЦезий
132,91
6s1
0,79
Мягкий серебристо-желтый металл
t°пл=28°C
t°кип=690°C
56
Ba
БарийБарий
137,33
6s2
0,89
Серебристо-белый металл
t°пл=725°C
t°кип=1640°C
57
La
ЛантанЛантан
138,91
5d1 6s2
1,1
Серебристый металл
t°пл=920°C
t°кип=3454°C
58
Ce
ЦерийЦерий
140,12
f-элемент
Серебристый металл
t°пл=798°C
t°кип=3257°C
59
Pr
ПразеодимПразеодим
140,91
f-элемент
Серебристый металл
t°пл=931°C
t°кип=3212°C
60
Nd
НеодимНеодим
144,24
f-элемент
Серебристый металл
t°пл=1010°C
t°кип=3127°C
61
Pm
ПрометийПрометий
146,92
f-элемент
Светло-серый радиоактивный металл
t°пл=1080°C
t°кип=2730°C
62
Sm
СамарийСамарий
150,36
f-элемент
Серебристый металл
t°пл=1072°C
t°кип=1778°C
63
Eu
ЕвропийЕвропий
151,96
f-элемент
Серебристый металл
t°пл=822°C
t°кип=1597°C
64
Gd
ГадолинийГадолиний
157,25
f-элемент
Серебристый металл
t°пл=1311°C
t°кип=3233°C
65
Tb
ТербийТербий
158,93
f-элемент
Серебристый металл
t°пл=1360°C
t°кип=3041°C
66
Dy
ДиспрозийДиспрозий
162,50
f-элемент
Серебристый металл
t°пл=1409°C
t°кип=2335°C
67
Ho
ГольмийГольмий
164,93
f-элемент
Серебристый металл
t°пл=1470°C
t°кип=2720°C
68
Er
ЭрбийЭрбий
167,26
f-элемент
Серебристый металл
t°пл=1522°C
t°кип=2510°C
69
Tm
ТулийТулий
168,93
f-элемент
Серебристый металл
t°пл=1545°C
t°кип=1727°C
70
Yb
ИттербийИттербий
173,04
f-элемент
Серебристый металл
t°пл=824°C
t°кип=1193°C
71
Lu
ЛютецийЛютеций
174,96
f-элемент
Серебристый металл
t°пл=1656°C
t°кип=3315°C
72
Hf
ГафнийГафний
178,49
5d2 6s2
Серебристый металл
t°пл=2150°C
t°кип=5400°C
73
Ta
ТанталТантал
180,95
5d3 6s2
Серый металл
t°пл=2996°C
t°кип=5425°C
74
W
ВольфрамВольфрам
183,84
5d4 6s2
2,36
Серый металл
t°пл=3407°C
t°кип=5927°C
75
Re
РенийРений
186,21
5d5 6s2
Серебристо-белый металл
t°пл=3180°C
t°кип=5873°C
76
Os
ОсмийОсмий
190,23
5d6 6s2
Серебристый металл с голубоватым оттенком
t°пл=3045°C
t°кип=5027°C
77
Ir
ИридийИридий
192,22
5d7 6s2
Серебристый металл
t°пл=2410°C
t°кип=4130°C
78
Pt
ПлатинаПлатина
195,08
5d9 6s1
2,28
Мягкий серебристо-белый металл
t°пл=1772°C
t°кип=3827°C
79
Au
ЗолотоЗолото
196,97
5d10 6s1
2,54
Мягкий блестящий желтый металл
t°пл=1064°C
t°кип=2940°C
80
Hg
РтутьРтуть
200,59
5d10 6s2
2,0
Жидкий серебристо-белый металл
t°пл=-39°C
t°кип=357°C
81
Tl
ТаллийТаллий
204,38
6s2 6p1
Серебристый металл
t°пл=304°C
t°кип=1457°C
82
Pb
СвинецСвинец
207,2
6s2 6p2
2,33
Серый металл с синеватым оттенком
t°пл=328°C
t°кип=1740°C
83
Bi
ВисмутВисмут
208,98
6s2 6p3
Блестящий серебристый металл
t°пл=271°C
t°кип=1560°C
84
Po
ПолонийПолоний
208,98
6s2 6p4
Мягкий серебристо-белый металл
t°пл=254°C
t°кип=962°C
85
At
АстатАстат
209,98
6s2 6p5
2,2
Нестабильный элемент, отсутствует в природе
t°пл=302°C
t°кип=337°C
86
Rn
РадонРадон
222,02
6s2 6p6
2,2
Радиоактивный газ
t°пл=-71°C
t°кип=-62°C
87
Fr
ФранцийФранций
223,02
7s1
0,7
Нестабильный элемент, отсутствует в природе
t°пл=27°C
t°кип=677°C
88
Ra
РадийРадий
226,03
7s2
0,9
Серебристо-белый радиоактивный металл
t°пл=700°C
t°кип=1140°C
89
Ac
АктинийАктиний
227,03
6d1 7s2
1,1
Серебристо-белый радиоактивный металл
t°пл=1047°C
t°кип=3197°C
90
Th
ТорийТорий
232,04
f-элемент
Серый мягкий металл
91
Pa
ПротактинийПротактиний
231,04
f-элемент
Серебристо-белый радиоактивный металл
92
U
УранУран
238,03
f-элемент
1,38
Серебристо-белый металл
t°пл=1132°C
t°кип=3818°C
93
Np
НептунийНептуний
237,05
f-элемент
Серебристо-белый радиоактивный металл
94
Pu
ПлутонийПлутоний
244,06
f-элемент
Серебристо-белый радиоактивный металл
95
Am
АмерицийАмериций
243,06
f-элемент
Серебристо-белый радиоактивный металл
96
Cm
КюрийКюрий
247,07
f-элемент
Серебристо-белый радиоактивный металл
97
Bk
БерклийБерклий
247,07
f-элемент
Серебристо-белый радиоактивный металл
98
Cf
КалифорнийКалифорний
251,08
f-элемент
Нестабильный элемент, отсутствует в природе
99
Es
ЭйнштейнийЭйнштейний
252,08
f-элемент
Нестабильный элемент, отсутствует в природе
100
Fm
ФермийФермий
257,10
f-элемент
Нестабильный элемент, отсутствует в природе
101
Md
МенделевийМенделевий
258,10
f-элемент
Нестабильный элемент, отсутствует в природе
102
No
НобелийНобелий
259,10
f-элемент
Нестабильный элемент, отсутствует в природе
103
Lr
ЛоуренсийЛоуренсий
266
f-элемент
Нестабильный элемент, отсутствует в природе
104
Rf
РезерфордийРезерфордий
267
6d2 7s2
Нестабильный элемент, отсутствует в природе
105
Db
ДубнийДубний
268
6d3 7s2
Нестабильный элемент, отсутствует в природе
106
Sg
СиборгийСиборгий
269
6d4 7s2
Нестабильный элемент, отсутствует в природе
107
Bh
БорийБорий
270
6d5 7s2
Нестабильный элемент, отсутствует в природе
108
Hs
ХассийХассий
277
6d6 7s2
Нестабильный элемент, отсутствует в природе
109
Mt
МейтнерийМейтнерий
278
6d7 7s2
Нестабильный элемент, отсутствует в природе
110
Ds
ДармштадтийДармштадтий
281
6d9 7s1
Нестабильный элемент, отсутствует в природе
Металлы
Неметаллы
Щелочные
Щелоч-зем
Благородные
Галогены
Халькогены
Полуметаллы
s-элементы
p-элементы
d-элементы
f-элементы
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
Метан | Определение, свойства, использование и факты
метановый цикл
Смотреть все СМИ
- Ключевые люди:
- Алессандро Вольта
- Похожие темы:
- природный газ парниковый газ биогаз воздуха трифенилметан
См. все связанные материалы →
метан , бесцветный газ без запаха, широко распространенный в природе и являющийся продуктом определенных видов деятельности человека. Метан является простейшим представителем парафинового ряда углеводородов и одним из самых мощных парниковых газов. Его химическая формула CH 4 .
Химические свойства метана
Метан легче воздуха и имеет удельный вес 0,554. Он мало растворим в воде. Легко горит на воздухе с образованием углекислого газа и водяного пара; пламя бледное, слегка светящееся и очень горячее. Температура кипения метана составляет -162 ° C (-259,6 ° F), а температура плавления составляет -182,5 ° C (-296,5 ° F). Метан в целом очень стабилен, но смеси метана с воздухом при содержании метана от 5 до 14% по объему взрывоопасны. Взрывы таких смесей часто происходили на угольных шахтах и угольных шахтах и были причиной многих аварий на шахтах.
Метан в целом очень стабилен, но смеси метана с воздухом при содержании метана от 5 до 14% по объему взрывоопасны. Взрывы таких смесей часто происходили на угольных шахтах и угольных шахтах и были причиной многих аварий на шахтах.
Подробнее из Britannica
глобальное потепление: метан
Источники метана
Понять процессы образования и выделения метанового газа в заболоченных местах
Посмотреть все видео к этой статье В природе метан образуется в результате анаэробного бактериального разложения растительное вещество под водой (где его иногда называют болотным газом или болотным газом). Водно-болотные угодья являются основным естественным источником метана, производимого таким образом. Другими важными природными источниками метана являются термиты (в результате процессов пищеварения), вулканы, жерла на дне океана и залежи гидрата метана, которые встречаются вдоль континентальных окраин, подо льдом Антарктиды и вечной мерзлотой Арктики. Метан также является основным компонентом природного газа, который содержит от 50 до 90 процентов метана (в зависимости от источника) и встречается как компонент рудничного газа (горючего газа) вдоль угольных пластов.
Метан также является основным компонентом природного газа, который содержит от 50 до 90 процентов метана (в зависимости от источника) и встречается как компонент рудничного газа (горючего газа) вдоль угольных пластов.
Производство и сжигание природного газа и угля являются основными антропогенными (антропогенными) источниками метана. Такие виды деятельности, как добыча и переработка природного газа и деструктивная перегонка битуминозного угля при производстве угольного и коксового газа, приводят к выбросу значительного количества метана в атмосферу. Другие виды деятельности человека, связанные с производством метана, включают сжигание биомассы, животноводство и управление отходами (где бактерии производят метан, разлагая осадок на очистных сооружениях и разлагающиеся вещества на свалках).
Использование метана
Метан является важным источником водорода и некоторых органических химических веществ. Метан реагирует с паром при высоких температурах с образованием монооксида углерода и водорода; последний используется в производстве аммиака для удобрений и взрывчатых веществ. Другие ценные химические вещества, полученные из метана, включают метанол, хлороформ, четыреххлористый углерод и нитрометан. При неполном сгорании метана образуется сажа, которая широко используется в качестве армирующего агента в резине для автомобильных шин.
Другие ценные химические вещества, полученные из метана, включают метанол, хлороформ, четыреххлористый углерод и нитрометан. При неполном сгорании метана образуется сажа, которая широко используется в качестве армирующего агента в резине для автомобильных шин.
Роль парникового газа
Метан, который производится и выбрасывается в атмосферу, поглощается поглотителями метана, которые включают почву и процесс окисления метана в тропосфере (самая нижняя область атмосферы). Большая часть природного метана компенсируется его поглощением в естественные поглотители. Однако антропогенное производство метана может привести к более быстрому увеличению концентрации метана, чем его поглотители. С 2007 года концентрация метана в атмосфере Земли увеличивалась на 6,8–10 частей на миллиард (ppb) в год. К 2020 году содержание метана в атмосфере достигло 1873,5 частей на миллиард, что примерно в два-три раза превышает доиндустриальные уровни, которые колебались на уровне 600–700 частей на миллиард.
Оформите подписку Britannica Premium и получите доступ к эксклюзивному контенту. Подпишитесь сейчас
Увеличение концентрации метана в атмосфере способствует возникновению парникового эффекта, при котором парниковые газы (в частности, двуокись углерода, метан и водяной пар) поглощают инфракрасное излучение (чистую тепловую энергию) и повторно излучают его обратно на поверхность Земли, потенциально улавливая тепло и вызывая существенные изменения климата. Повышенное содержание метана в атмосфере также косвенно способствует парниковому эффекту. Например, при окислении метана гидроксильные радикалы (ОН — ) удаляют метан, реагируя с ним с образованием двуокиси углерода и водяного пара, а по мере увеличения концентрации атмосферного метана концентрации гидроксильных радикалов уменьшаются, эффективно продлевая время жизни метана в атмосфере.
Редакторы Британской энциклопедии Эта статья была недавно отредактирована и обновлена Адамом Августином.
Рекуперация метана | Wisconsin Public Service
- Экологические преимущества утилизации метана
- Что такое анаэробный метантенк?
- Типы варочных котлов
- Экологические преимущества
- Средство от запаха
- Лучше ли это для вашей фермы?
Экологические преимущества рекуперации метана
- Биогаз может производить как электричество, так и тепло. Это может компенсировать затраты фермы на электроэнергию.
- Вываривание снижает вероятность загрязнения поверхностных и грунтовых вод.
- Биогаз также может снизить потребность в других видах топлива. Это уменьшает загрязнение, возникающее при бурении, добыче полезных ископаемых, транспортировке и сжигании. Это также снижает выбросы углекислого газа — фактора изменения климата.
- Сбор биогаза предотвращает попадание метана в воздух. В атмосфере метан становится парниковым газом.
- Анаэробное сбраживание обычно уменьшает объем твердых частиц навоза.
 Объем обычно уменьшается более чем на 90%. Остальные биосолиды можно использовать в качестве удобрения.
Объем обычно уменьшается более чем на 90%. Остальные биосолиды можно использовать в качестве удобрения.
Установка системы анаэробного сбраживания имеет экологические и экономические преимущества. Система производит электричество из метана. В свою очередь, это может снизить затраты на электроэнергию. Он также может контролировать запахи и улучшать обращение с навозом. Система может снизить вероятность загрязнения поверхностных и подземных вод. Он также может контролировать вредные патогены. Фермы могут использовать анаэробное сбраживание, чтобы соответствовать новым правилам обращения с навозом. Однако этот процесс включает в себя ряд финансовых и управленческих ресурсов. Затраты и выгоды должны быть тщательно взвешены.
Вернуться к началу
Что такое анаэробный биореактор?
Анаэробный означает «без кислорода». Анаэробный метантенк состоит из закрытого резервуара, в котором отсутствует кислород. Природные бактерии разлагают навоз. Навоз оставляют в виде ряда газов. Одним из таких газов является метан.
Одним из таких газов является метан.
Бактерии, вырабатывающие метан, наиболее активны при температуре от 95 до 105°F. По этой причине некоторые метантенки пропускают горячую воду по трубам. Он нагревает навоз, чтобы поддерживать идеальный температурный диапазон. Крышка варочного котла задерживает биогаз. Покрытие одновременно гибкое и непроницаемое. Попавший в ловушку биогаз можно сжечь в открытом пламени. Он также может проходить через электрический генератор. Существует множество типов генераторов. Однако наиболее распространенным является модифицированный двигатель внутреннего сгорания. Полученную электроэнергию затем можно использовать на ферме.
Вернуться к началу
Типы метантенков
- Варочный котел с закрытым отстойником: Используется в отстойниках для жидкого навоза большого объема. В лагунах содержится менее 2% твердых веществ. Пластиковая крышка улавливает газ, образующийся при разложении. Для сбора метана необходима плавучая крышка лагуны.
 В системе также нужен газовый насос. Эту систему можно использовать на свиноводческих и молочных фермах. Это лучше всего работает, когда навоз обрабатывается в виде жидкости. Климат должен быть умеренным или теплым в течение всего года. Это самая дешевая система. Но он не подходит для использования в холодном климате. Фермерам в Висконсине и на Верхнем полуострове нужна другая система.
В системе также нужен газовый насос. Эту систему можно использовать на свиноводческих и молочных фермах. Это лучше всего работает, когда навоз обрабатывается в виде жидкости. Климат должен быть умеренным или теплым в течение всего года. Это самая дешевая система. Но он не подходит для использования в холодном климате. Фермерам в Висконсине и на Верхнем полуострове нужна другая система. - Комплексный метантенк: Используется для навоза с содержанием твердых веществ от 2 до 10%. Сюда входит молочный или свиной навоз, собранный системой смыва. В этой системе обогреваются резервуары. Система смешивания удерживает твердые вещества во взвешенном состоянии, что ускоряет процесс пищеварения. Эти варочные котлы дороги в строительстве. Их эксплуатация и обслуживание обходятся дороже, чем лагунные метантенки. Дополнительная вода увеличивает требуемый размер варочного котла. Это также увеличивает стоимость строительства и эксплуатации, не увеличивая выгоды.
- Автоклав с поршневым потоком: Используется для навоза жвачных животных, который содержит от 11 до 14% твердых веществ.
 Эта система не работает для навоза с низким содержанием твердых веществ. В лучших условиях пробка проходит через варочный котел за 15-20 дней. В этой системе мало движущихся частей. Он требует небольшого обслуживания.
Эта система не работает для навоза с низким содержанием твердых веществ. В лучших условиях пробка проходит через варочный котел за 15-20 дней. В этой системе мало движущихся частей. Он требует небольшого обслуживания.
Вернуться к началу
Экологические преимущества
Анаэробное сбраживание уменьшает объем твердых частиц навоза более чем на 90%. Оставшиеся твердые биологические вещества имеют более высокие уровни азота, фосфора и калия (NPK), чем навоз. Они также имеют более высокие уровни микроэлементов. Это делает их отличным дополнением почвы. Они также содержат аммоний-N. Подобно коммерческим удобрениям, это делает азот доступным, когда его разбрасывают по полям.
Поскольку сбраживание навоза является анаэробным процессом, большинство семян сорняков и патогенов погибает в процессе. Кроме того, такие патогены, как кишечная палочка, сальмонелла и криптоспоридии, не выдерживают высоких температур. Количество фекальных колиформных бактерий в твердых биологических веществах составляет всего около 1% от их количества в свежем и хранящемся навозе. Это снижает вероятность загрязнения воды.
Это снижает вероятность загрязнения воды.
На некоторых фермах навоз хранится в ямах или лагунах. При производстве метана он выбрасывается в атмосферу. Метан в 21 раз сильнее вызывает глобальное потепление, чем углекислый газ. Улавливая и сжигая метан, полученный из навоза животных, анаэробные реакторы снижают скорость глобального потепления.
Вернуться к началу
Борьба с запахом
Анаэробные микроорганизмы расщепляют соединения, вызывающие запах навоза. Это избавит от проблем с запахом. Исследования показывают, что анаэробное сбраживание может уменьшить запах свежего навоза на 97%. В проектах по расширению ферм основной причиной установки варочного котла может быть устранение запаха.
Наверх
Лучше ли это для вашей фермы?
Стоимость варочного котла зависит от фермы, а срок окупаемости варьируется. Это может занять от нескольких лет до более чем 10 лет. Около 30% биогаза используется для обогрева системы пищеварения. Многие системы могут обеспечивать все потребности фермы в электричестве или отоплении.